
La precipitación de carbonato cálcico (cal) es un problema común de obstrucción en los sistemas de microrriego. El agua con un pH de 7,5 o superior y un nivel de bicarbonato de al menos 2 meq/l (120 ppm) es susceptible de precipitación de carbonato cálcico si hay niveles comparables de calcio presentes de forma natural en el sistema o si se inyecta en él un compuesto que contenga calcio.
Causas de la precipitación de carbonato cálcico
El grado en que se produce el carbonato cálcico en el agua a presión atmosférica depende del pH y la temperatura del agua. A valores de pH inferiores a aproximadamente 6, en el agua existe principalmente dióxido de carbono disuelto y una pequeña cantidad de ácido carbónico. A valores de pH entre 6,5 y 10, el bicarbonato es dominante. A valores de pH superiores a unos 10,5, domina el ion carbonato. Las causas de la precipitación incluyen las siguientes.
- Para las aguas subterráneas, el bombeo reduce la presión del agua a medida que fluye hacia el pozo. Esta reducción libera gas de dióxido de carbono disuelto, lo que hace que el pH del agua subterránea aumente, y eso a su vez puede causar la precipitación de carbonato de calcio.
- La evaporación aumenta la concentración de productos químicos que se disuelven en el agua que permanece en el emisor. Debido a su baja solubilidad en el agua, el carbonato de calcio precipita fácilmente durante la evaporación.
- El grado de solubilidad del carbonato de calcio disminuye a medida que aumenta la temperatura del agua. La temperatura del agua en los sistemas de microrriego de superficie puede aumentar a medida que el agua baja por los laterales.
- La inyección de ciertos productos químicos como el aqua amoníaco y la lejía o la inyección de fertilizantes que contienen calcio o materiales como el yeso pueden provocar precipitaciones.
Prevención y corrección de problemas de obstrucción
La disminución del pH del agua disuelve cualquier precipitado de carbonato de calcio existente y evita la formación de sales de carbonato adicionales. El tratamiento habitual para la precipitación de carbonato cálcico es inyectar ácido para acidificar el agua, bajando el pH a 7 o menos. Los ácidos más comunes utilizados para este fin son el ácido sulfúrico, el ácido muriático y el ácido clorhídrico. Se pueden utilizar otros ácidos como el ácido cítrico y el ácido nítrico, pero son más caros.
Un compuesto ácido-fertilizante como el ácido urea-sulfúrico es más seguro de utilizar que un ácido puro. Sin embargo, la inyección continua de productos ácidos que contienen nitrógeno puede causar problemas a lo largo de una temporada para los cultivos que son sensibles a las aplicaciones excesivas de nitrógeno, como las manzanas y las uvas de vino.
Los investigadores han evaluado otros compuestos como un fosfonato y materiales de ácido fosfónico y han encontrado que son eficaces para prevenir la precipitación de carbonato de calcio.
Los tratamientos recomendados para prevenir la obstrucción son los siguientes.
- Inyectar ácido continuamente para mantener el pH del agua entre 5 y 7.
- Inyectar ácido intermitentemente para mantener el pH del agua por debajo de 4 durante al menos 30 a 60 minutos. La frecuencia de la inyección depende de la velocidad a la que se produce la precipitación de carbonatos. Cuando utilice emisores con compensación de presión, consulte al fabricante antes de bajar el pH a 4 o menos. El latón y cualquier otro accesorio de metal no inoxidable puede picarse.
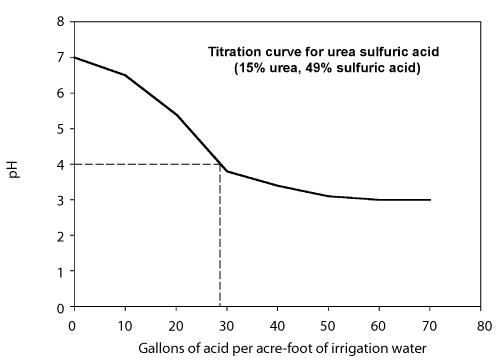
La cantidad de ácido necesaria para bajar el pH al nivel deseado depende de la alcalinidad del agua y del pH objetivo. Se pueden utilizar dos enfoques para determinar la cantidad de ácido necesaria. - Desarrollar una curva de valoración que muestre la cantidad de ácido necesaria para bajar el pH del agua a un valor deseado para un agua de riego en particular. Esto lo suele hacer un laboratorio y requiere que se proporcionen muestras del agua y del ácido. El comportamiento de la valoración depende de la alcalinidad del agua de riego, por lo que la curva de valoración puede variar de una fuente de agua a otra. La figura 8 muestra una curva de valoración utilizando una solución de urea-ácido sulfúrico que contiene un 49 por ciento de ácido sulfúrico.
- Utilice un método de ensayo y error añadiendo ácido al agua en incrementos y midiendo el pH, repitiendo hasta alcanzar el nivel de pH deseado. Para determinar el pH del agua se puede utilizar papel tornasol, kits de pruebas colormétricas para acuarios y piscinas y medidores de pH portátiles. Numerosas fuentes venden medidores de pH de bolsillo; requieren una calibración periódica utilizando soluciones estándar que también pueden adquirirse.
Figura 8. Curva de valoración de la urea sulfúrica con ácido sulfúrico al 49%.
Calcular la tasa de inyección
Una vez que determine la cantidad de ácido que necesita, puede calcular la tasa de inyección de ácido utilizando la siguiente ecuación:
IR = (A × Q × 60) ÷ 326.000
donde
IR = la tasa de inyección en galones por hora (gph)
A = los galones de ácido por acre-pie de agua necesarios para bajar el pH
Q = el caudal del sistema de riego en galones por minuto (gpm)
Los acres-pie de agua se pueden determinar mediante la fórmula Q × T × 60 ÷ 326,000, donde T es el tiempo de riego establecido en horas.
Supervise el pH del agua durante el proceso de inyección para asegurarse de que no baje mucho de 4. Todas las aguas se “amortiguan” de forma diferente por las sales que contienen; un agua puede requerir 10 gph mientras que otra sólo requerirá 2 gph.
Ejemplo
Calcule la tasa de inyección necesaria para bajar el pH a 4 utilizando un ácido urea-sulfúrico (49%). La figura anterior es la curva de valoración. El caudal del sistema es de 1.000 galones por minuto.
Paso 1. De la curva de valoración, observe que se necesitan 26 galones de ácido urea-sulfúrico por acre-pie de agua para bajar el pH a 4.
Paso 2.
IR = (26 × 1.000 × 60) ÷ 326.000 = 4,8 gph
Medidas de seguridad
- No mezcle directamente ácido y cloro. Esto hará que se forme un gas de cloro venenoso.
- No añada agua al ácido. En su lugar, añada siempre ácido al agua.