Co je polární kovalentní vazba?
Kovalentní vazba vzniká, když dva atomy mezi sebou sdílejí elektrony. Kovalentní vazba bude pravděpodobně polární, pokud jsou elektrony sdíleny nerovnoměrně. Šikmost vzniká v důsledku rozdílu elektronegativit obou atomů. Elektronegativita je mírou tendence atomu přitahovat vazebný pár elektronů. Měří se pomocí stupnice známé jako Paulingova stupnice a pohybuje se v rozmezí od 0,7 do 4. Následující tabulka vysvětluje typ chemické vazby vzniklé v důsledku tohoto rozdílu elektronegativit .
| Typ chemické vazby | Rozdíl elektronegativit |
|---|---|
| Nepolární kovalentní | 0 |
| Mírně polární kovalentní | 0 .1 až 0,4 |
| Polární kovalentní | 0,5 až 2 |
| Iontové | > 2 |
Čím výraznější je rozdíl v elektronegativitě, tím větší je polarita a pevnost vazby. Proto mají polární kovalentní vazby střední pevnost vazby.
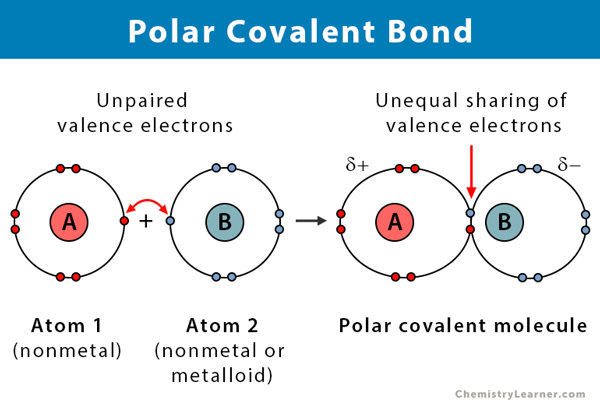
Vlastnosti polárních kovalentních vazeb
Zde jsou uvedeny některé skutečnosti o polárních kovalentních vazbách.
- Probíhá mezi dvěma nekovy nebo mezi nekovem a metaloidem
- Nerovné sdílení elektronů ve sloučenině
- Rozdíl elektronegativit atomů je v rozmezí 0.1 a 2
- Jeden konec vazby je kladně nabitý a druhý konec je záporně nabitý
- Polární sloučeniny se rozpouštějí v polárním rozpouštědle
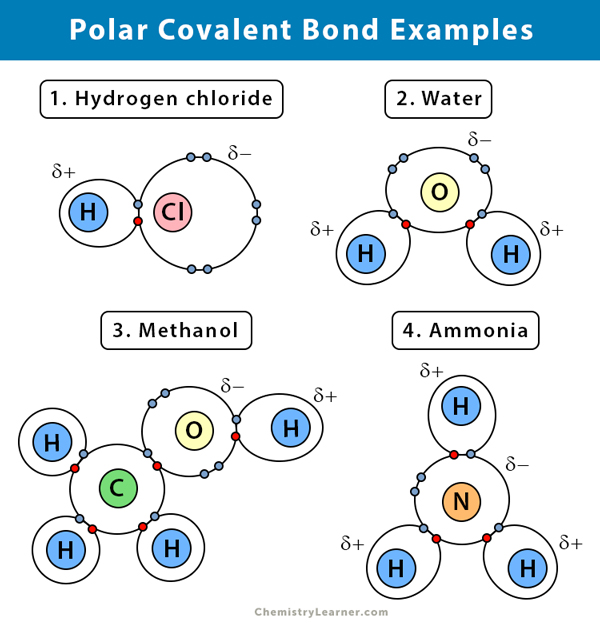
Příklady polárních kovalentních vazeb
Níže jsou uvedeny některé příklady polární kovalentní vazby s rozdílem elektronegativity mezi oběma vazebnými atomy :
| Název sloučeniny | Molekulární vzorec | Vazba | Elektronegativita rozdíl |
|---|---|---|---|
|
Voda |
H2O |
O-H |
|
| Fluorovodík | HF | H-F | 1.9 |
| Chlorid vodíku | HCl |
H-Cl |
0.9 |
|
Bromovodík |
HBr |
H-Br |
|
|
Amonia |
NH3 |
N-H |
|
|
Dioxid siřičitý |
SO2 | S=O | 1 |
| Sulfid vodíku | H2S | H-S | 0.4 |
| Metanol | CH3OH | O-H | 1,4 |
Vysvětlení polární kovalentní vazby v některých sloučeninách je uvedeno níže.
Voda (H2O)
Voda je polární rozpouštědlo. Polární kovalentní vazba vzniká, když atom kyslíku (O), který je elektronegativnější než vodík, přitahuje sdílené elektrony k sobě. V důsledku toho je s atomem kyslíku spojen částečný záporný náboj. Vodíky (H) jsou naopak v podstatě protony a je s nimi spojen částečný kladný náboj.
Chlorovodík (HCl)
Chlorovodík je polární kovalentní sloučenina, protože atom chloru (Cl) je elektronegativnější než atom vodíku (H). Chlor tedy nese částečný záporný náboj, zatímco vodík nese částečný kladný náboj.
Amoniak (NH3)
Amoniak je polární molekula. Centrální atom, dusík (N), je vázán na tři atomy vodíku (H). Protože N je elektronegativnější než H, elektrony budou mít tendenci viset kolem atomu N.
Bromovodík (HBr)
Rozdíl v elektronegativitě mezi vodíkem (H) a bromem (Br) není příliš velký. Proto má plyn HBr kovalentní vazbu polarizovanou a atom vodíku má mírně kladný náboj a brom má mírně záporný náboj. V důsledku toho je elektronový pár přitahován k bromu.
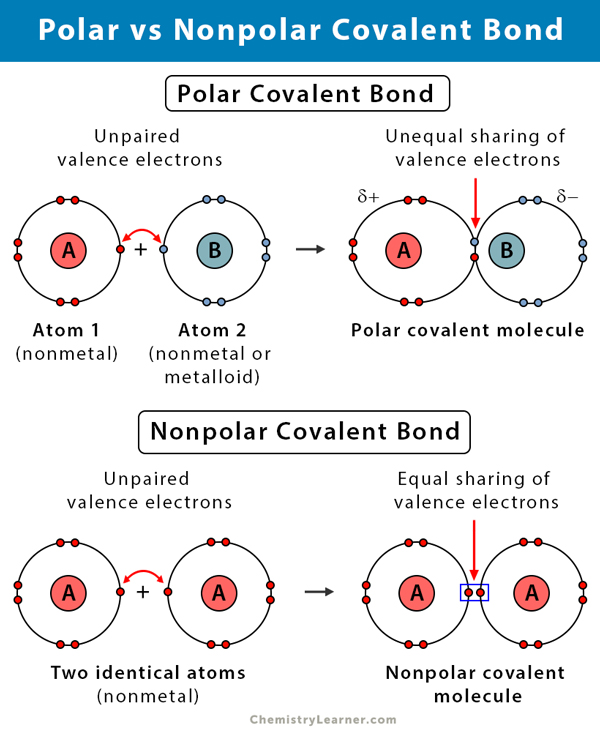
Rozdíl mezi polární a nepolární kovalentní vazbou
V následující tabulce jsou porovnány a porovnávány polární a nepolární kovalentní vazby.
Polární kovalentní vazba vs. nepolární kovalentní vazba. Nepolární kovalentní vazba |
||
| Polární | Nepolární | |
|---|---|---|
|
Typy atomů |
Mezi dvěma nekovy. s různou elektronegativitou |
Mezi dvěma nekovy se stejnou elektronegativitou |
|
Rozdíl elektronegativit |
0.1 – 2 |
|
|
Rozdělení elektronů |
Asymetrické. Nerovnoměrné rozdělení. |
Symetrické. Rovnoměrné sdílení. |
|
Přesun sdílených elektronů |
Směrem k elektronegativnějšímu atomu, čímž se tato část stává zápornou |
Žádný přesun. Elektricky neutrální. |
|
Dipólový moment |
Ne-.nulový |
Nulový |
|
Přítomnost dalších typů vazeb ve sloučeninách |
Vodíková vazba |
Van der Waalsova vazba |
|
Afinita k vodě |
Hydrofilní |
Hydrofobní |
|
Fyzikální vlastnosti látek |
Vysoké tání a varu |
Nízké teploty tání a varu |
|
Levnost kapalin |
Nízká těkavost |
Vysoká těkavost |
|
Rozpustnost sloučenin |
Rozpustné v polárních rozpouštědlech |
Rozpustné v nepolárních rozpouštědlech |
|
Příklady |
Voda (H2O), amoniak (NH3) a chlorovodík (HCl) |
Vodík (H2), kyslík (O2) a dusík (N2) |
.