Generický název: neostigmin bromid
Dávkovací forma: tableta
Medicínské hodnocení: Drugs.com. Naposledy aktualizováno 21. dubna 2020.
- Nežádoucí účinky
- Dávkování
- Odborné
- Interakce
- Těhotenství
- Další
Vyjádření: Tento lék nebyl FDA shledán bezpečným a účinným a toto označení nebylo FDA schváleno. Další informace o neschválených léčivých přípravcích naleznete zde.
Ve Spojených státech amerických byl ukončen prodej značkového přípravku Prostigmin. Pokud FDA schválila generické verze tohoto přípravku, mohou být k dispozici generické ekvivalenty.
- Prostigmin Popis
- Prostigmin – klinická farmakologie
- Indikace a použití přípravku Prostigmin
- Kontraindikace
- Upozornění
- Upozornění
- Všeobecně:
- Lékové interakce:
- Karcinogeneze, mutageneze a poškození fertility:
- Těhotenství:
- Kojící matky:
- Pediatrické použití:
- Nežádoucí účinky
- Předávkování
- Dávkování a způsob podání Prostigminu
- Jak se přípravek Prostigmin dodává
- Základní zobrazovací panel – 15 mg štítek
- Více o Prostigminu. (neostigmin)
- Odborné zdroje
- Související léčebné příručky
Prostigmin Popis
Prostigmin (neostigmin-bromid), anticholinesterázový přípravek, je k dispozici k perorálnímu podání v 15 mg tabletách. Každá tableta dále obsahuje želatinu, laktosu, kukuřičný škrob, kyselinu stearovou, cukr a mastek.
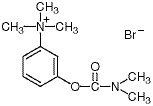
Chemicky je neostigmin-bromid (m-hydroxy-fenyl)trimethylamonium-bromid dimethylkarbamát. Je to bílý, krystalický, hořký prášek, rozpustný 1:1 ve vodě, s molekulovou hmotností 303,20 a následujícím strukturním vzorcem:
Prostigmin – klinická farmakologie
Neostigmin inhibuje hydrolýzu acetylcholinu tím, že soutěží s acetylcholinem o vazbu na acetylcholinesterasu v místech cholinergního přenosu. Zvyšuje cholinergní účinek tím, že usnadňuje přenos impulzů přes nervosvalové spoje. Má také přímý cholinomimetický účinek na kosterní svalstvo a pravděpodobně i na autonomní gangliové buňky a neurony centrálního nervového systému. Neostigmin podléhá hydrolýze cholinesterázou a je také metabolizován mikrozomálními enzymy v játrech. Vazba na bílkoviny lidského sérového albuminu se pohybuje od 15 do 25 %.
Neostigmin-bromid se po perorálním podání špatně vstřebává z gastrointestinálního traktu. Zpravidla 15 mg neostigmin-bromidu perorálně odpovídá 0,5 mg neostigmin-methylsulfátu parenterálně, a to z důvodu špatné absorpce tablety ze střevního traktu. Ve studii u pacientů s myastenií nalačno byl rozsah absorpce odhadnut na 1 až 2 % požité 30 mg jednorázové perorální dávky. Maximální koncentrace v plazmě se objevily 1 až 2 hodiny po požití léku, se značnými individuálními rozdíly. Poločas se pohyboval od 42 do 60 minut s průměrným poločasem 52 minut.
Indikace a použití přípravku Prostigmin
Prostigmin je indikován k symptomatické léčbě myasthenia gravis. Jeho největší užitečnost je při dlouhodobé léčbě, kdy nejsou přítomny potíže s polykáním. Při akutní myastenické krizi, kdy jsou přítomny potíže s dýcháním a polykáním, by měla být použita parenterální forma (neostigmin-methylsulfát). Pacient může být převeden na perorální formu, jakmile ji bude tolerovat.
Kontraindikace
Prostigmin je kontraindikován u pacientů se známou přecitlivělostí na lék. Vzhledem k přítomnosti bromidového iontu by neměl být používán u pacientů s předchozí reakcí na bromidy v anamnéze. Je kontraindikován u pacientů s peritonitidou nebo mechanickou obstrukcí střevního nebo močového traktu.
Upozornění
Prostigmin by měl být používán s opatrností u pacientů s epilepsií, bronchiálním astmatem, bradykardií, nedávnou koronární okluzí, vagotonií, hypertyreózou, srdeční arytmií nebo peptickým vředem. Zpravidla platí, že 15 mg neostigmin-bromidu perorálně odpovídá 0,5 mg neostigmin-methylsulfátu parenterálně, a to z důvodu špatné absorpce tablety ze střevního traktu. Velkým dávkám je třeba se vyhnout v situacích, kdy by mohlo dojít ke zvýšené absorpci ze střevního traktu. Při současném podávání s anticholinergními léky je třeba postupovat opatrně, aby nedošlo ke snížení pohyblivosti střeva.
Upozornění
Všeobecně:
Je důležité rozlišovat mezi myastenickou krizí a cholinergní krizí způsobenou předávkováním přípravkem Prostigmin. Oba stavy vedou k extrémní svalové slabosti, ale vyžadují radikálně odlišnou léčbu. (Viz bod PŘEDÁVKOVÁNÍ.)
Lékové interakce:
Některá antibiotika, zejména neomycin, streptomycin a kanamycin, mají mírný, ale určitý nedepolarizující blokovací účinek, který může zvýraznit nervosvalový blok. Tato antibiotika by měla být u pacienta s myastenií použita pouze v případech, kdy je to jednoznačně indikováno, a pak by mělo být pečlivě upraveno přídavné dávkování anticholinesteráz.
Lokální a některá celková anestetika, antiarytmika a další léky, které zasahují do nervosvalového přenosu, by měly být u pacientů s myastenií gravis používány opatrně, pokud vůbec; dávku přípravku Prostigmin bude možná nutné odpovídajícím způsobem zvýšit.
Karcinogeneze, mutageneze a poškození fertility:
Nebyly provedeny žádné studie s Prostigminem, které by umožnily vyhodnotit jeho karcinogenní nebo mutagenní potenciál. Studie vlivu prostigminu na fertilitu a reprodukci nebyly provedeny.
Těhotenství:
Teratogenní účinky: Kategorie těhotenství C
Neexistují žádné adekvátní nebo dobře kontrolované studie Prostigminu ani u laboratorních zvířat, ani u těhotných žen. Není známo, zda Prostigmin může při podávání těhotným ženám způsobit poškození plodu nebo zda může ovlivnit reprodukční schopnost. Prostigmin by měl být podáván těhotné ženě pouze v případě, že je to jednoznačně nutné.
Neteratogenní účinky:
Anticholinesterázy mohou při intravenózním podání těhotným ženám v blízkosti termínu porodu způsobit podráždění dělohy a vyvolat předčasný porod.
Kojící matky:
Není známo, zda se Prostigmin vylučuje do lidského mléka. Vzhledem k tomu, že se do lidského mléka vylučuje mnoho léků a vzhledem k možnosti závažných nežádoucích účinků Prostigminu u kojených dětí, je třeba rozhodnout, zda přerušit kojení nebo vysadit lék, s ohledem na význam léku pro matku.
Pediatrické použití:
Bezpečnost a účinnost u dětí nebyla stanovena.
Nežádoucí účinky
Nežádoucí účinky jsou obecně způsobeny zesílením farmakologických účinků, z nichž nejčastější jsou salivace a fascikulace. Mohou se také objevit střevní křeče a průjem.
Po použití neostigmin-bromidu nebo neostigmin-methylsulfátu byly hlášeny následující další nežádoucí reakce:
Alergické:
Neurologické: Alergické reakce a anafylaxe:
Kardiovaskulární: Závratě, křeče, ztráta vědomí, ospalost, bolest hlavy, dysartrie, mióza a změny zraku: Byly hlášeny srdeční arytmie (včetně bradykardie, tachykardie, A-V bloku a nodálního rytmu) a nespecifické změny EKG, jakož i srdeční zástava, synkopa a hypotenze. Ty byly zaznamenány převážně po použití injekční formy přípravku Prostigmin.
Respirační: Zvýšená orální, faryngeální a brochiální sekrece a dušnost. Po použití injekční formy přípravku Prostigmin byly hlášeny respirační deprese, zástava dechu a bronchospasmus.
Dermatologické:
Gastrointestinální: Vyrážka a kopřivka:
Genitourinární: Nevolnost, emeze, flatulence a zvýšená peristaltika:
Muskuloskeletální: Frekvence močení: Svalové křeče a spasmy, artralgie.
Různé: Diaforéza, zčervenání a slabost.
Předávkování
Předávkování přípravkem Prostigmin může způsobit cholinergní krizi, která je charakterizována narůstající svalovou slabostí a prostřednictvím postižení dýchacích svalů může vyústit ve smrt. Myastenická krize, v důsledku zvýšení závažnosti onemocnění, je rovněž doprovázena extrémní svalovou slabostí a může být obtížně symptomaticky odlišitelná od cholinergní krize. Toto rozlišení je však nesmírně důležité, protože zvýšení dávky přípravku Prostigmin nebo jiných léků této skupiny by v přítomnosti cholinergní krize nebo refrakterního či “necitlivého” stavu mohlo mít vážné následky. Oba typy krizí lze odlišit podle použití přípravku Tensilon® (edrofonium-chlorid) i podle klinického úsudku.
Léčba obou stavů se radikálně liší. Zatímco přítomnost myastenické krize vyžaduje intenzivnější anticholinesterázovou léčbu, cholinergní krize vyžaduje okamžité vysazení všech léků tohoto typu. Při cholinergní krizi se také doporučuje okamžité použití atropinu.
Atropin lze také použít ke zrušení nebo minimalizaci gastrointestinálních nežádoucích účinků nebo jiných muskarinových reakcí; takové použití však může maskováním příznaků předávkování vést k neúmyslnému vyvolání cholinergní krize.
LD50 neostigminmethylsulfátu u myší je 0,3±0,02 mg/kg intravenózně, 0,54±0….03 mg/kg subkutánně a 0,395±0,025 mg/kg intramuskulárně; u potkanů je LD50 0,315±0,019 mg/kg intravenózně, 0,445±0,032 mg/kg subkutánně a 0,423±0,032 mg/kg intramuskulárně.
Dávkování a způsob podání Prostigminu
Nástup účinku Prostigminu podaného perorálně je pomalejší než při parenterálním podání, ale trvání účinku je delší a intenzita účinku rovnoměrnější. Požadavky na dávkování pro dosažení optimálních výsledků se pohybují od 15 mg do 375 mg denně. V některých případech může být nutné tyto dávky překročit, ale je třeba si uvědomit možnost cholinergní krize. Průměrná dávka je 10 tablet (150 mg) podávaných po dobu 24 hodin. Interval mezi jednotlivými dávkami má zásadní význam. Dávkovací schéma by mělo být upraveno pro každého pacienta a měněno podle potřeby. Často je nutná léčba ve dne i v noci. Větší porce celkové denní dávky mohou být podávány v době, kdy je pacient náchylnější k únavě (odpoledne, v době jídla atd.). Pacient by měl být vyzván, aby si vedl denní záznamy o svém stavu, které pomohou lékaři při stanovení optimálního terapeutického režimu.
Jak se přípravek Prostigmin dodává
Vyznačené bílé tablety obsahující 15 mg neostigmin-bromidu-lahve po 100 (NDC 0187-3100-10). Potisk na tabletách: (vpředu) Prostigmin 15; (vzadu) V.
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
(949) 461-6000
Rev. 02/08
Základní zobrazovací panel – 15 mg štítek
NDC 0187-3100-10
Pouze na lékařský předpis
Prostigmin®
(neostigmin-bromid)
15 mg
100 tablet
Každá tableta obsahuje 15 mg neostigmin-bromidu
VALEANT™

| Prostigmin neostigmin-bromid tablety |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Etiketář -. Valeant Pharmaceuticals North America LLC (042230623)
Více o Prostigminu. (neostigmin)
- Nežádoucí účinky
- Během těhotenství nebo kojení
- Informace o dávkování
- Lékové interakce
- Třída léčivých přípravků: cholinergní svalová stimulancia
Odborné zdroje
- Předpisová informace
- Neostigmin methylsulfát injekce (FDA)
Ostatní značky Bloxiverz
Související léčebné příručky
- Myasthenia Gravis
- Retence moči
Vyjádření lékařské odpovědnosti