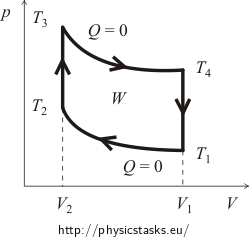
Na začátku je obvykle nutné získat představu o pV diagramu cyklu. Za tímto účelem budeme sledovat křivky izochorického a adiabatického děje. Přibližný graf Ottova cyklu je znázorněn na následujícím obrázku.
Účinnost η cyklu je definována jako
\
kde W je práce vykonaná plynem během jednoho cyklu minus práce vykonaná vnějšími silami (v diagramu je znázorněna plochou plochy vymezené přímkami cyklu!) a Qsup je teplo dodané soustavě během cyklu.
Práci W lze vypočítat pomocí vztahu mezi tlakem a objemem během adiabatické expanze a komprese (práce vykonaná během izochorického procesu je samozřejmě nulová). V této úloze však bude lepší využít toho, že celková změna vnitřní energie za cyklus musí být rovna nule (dostáváme se zpět do stejného stavu jako na začátku, proto teplota a tedy i vnitřní energie zůstávají stejné!) Podle prvního termodynamického zákona lze práci vykonanou plynem vyjádřit jako rozdíl mezi dodaným teplem Qsup a uvolněným teplem Qrel. Vzorec pro účinnost cyklu má tedy tvar
\
Nejprve vypočítáme dodané teplo Qsup. Je zřejmé, že při adiabatickém procesu nedochází k výměně tepla a při izochorickém ochlazování se teplo uvolňuje. To znamená, že teplo bude dodáno pouze během izochorického ohřevu z teploty T2 na teplotu T3. Množství tohoto tepla lze vyjádřit veličinami látkové množství n plynu a jeho molární tepelná kapacita CV takto:
\
Velmi podobně vyjádříme množství uvolněného tepla Qrel. Již víme, že teplo se uvolňuje pouze při izochorickém ochlazování z teploty T4 zpět na počáteční teplotu T1. Platí, že:
\
Nyní dosadíme tyto vzorce do vzorce účinnosti cyklu a okamžitě dostaneme:
\ \
Nyní budeme muset vyjádřit teplotní rozdíly pomocí daného kompresního poměru
\
a Poissonova poměru κ.
K tomu použijeme rovnici pro ideální plyn procházející adiabatickým procesem (Poissonův zákon) pVκ = C = konst., kde C je konstanta. Nyní vyhodnotíme tlak ze stavové rovnice ideálního plynu
\
, který dosadíme do Poissonova zákona. Nyní převedeme konstanty (C a K) na jednu stranu
\
Tento Poissonův zákon nyní použijeme pro oba adiabatické procesy. Pro adiabatickou expanzi dostaneme vztah
\
A pro adiabatickou kompresi dostaneme
\
Nyní odečteme druhou rovnici od první a vynásobíme V1κ – 1 na jedné straně a V2κ – 1 na straně druhé. Dostaneme:
\ \
Vidíme, že se nám skutečně podařilo vyjádřit teplotní rozdíly pomocí daných hodnot. Nyní dosadíme tento vztah do vzorce pro účinnost a dostaneme konečnou rovnici:
\ \