Toto je stručný přehled informací souvisejících se schválením FDA k uvedení tohoto výrobku na trh. Úplnější informace o tomto výrobku, indikacích k jeho použití a podkladech pro schválení FDA naleznete na níže uvedených odkazech na Souhrn údajů o bezpečnosti a účinnosti (SSED) a označení výrobku.
Název výrobku: Axonics Sacral Neuromodulation System
Žadatel o povolení k výrobě:
Adresa: Axonics Modulation Technologies, Inc: Technology Drive, Irvine, CA 92618
Datum schválení: 26 Technology Drive, Irvine, CA 92618
Datum schválení: November 13, 2019
Datum schválení: 13. listopadu 2019
Datum schválení: Schvalovací příkaz
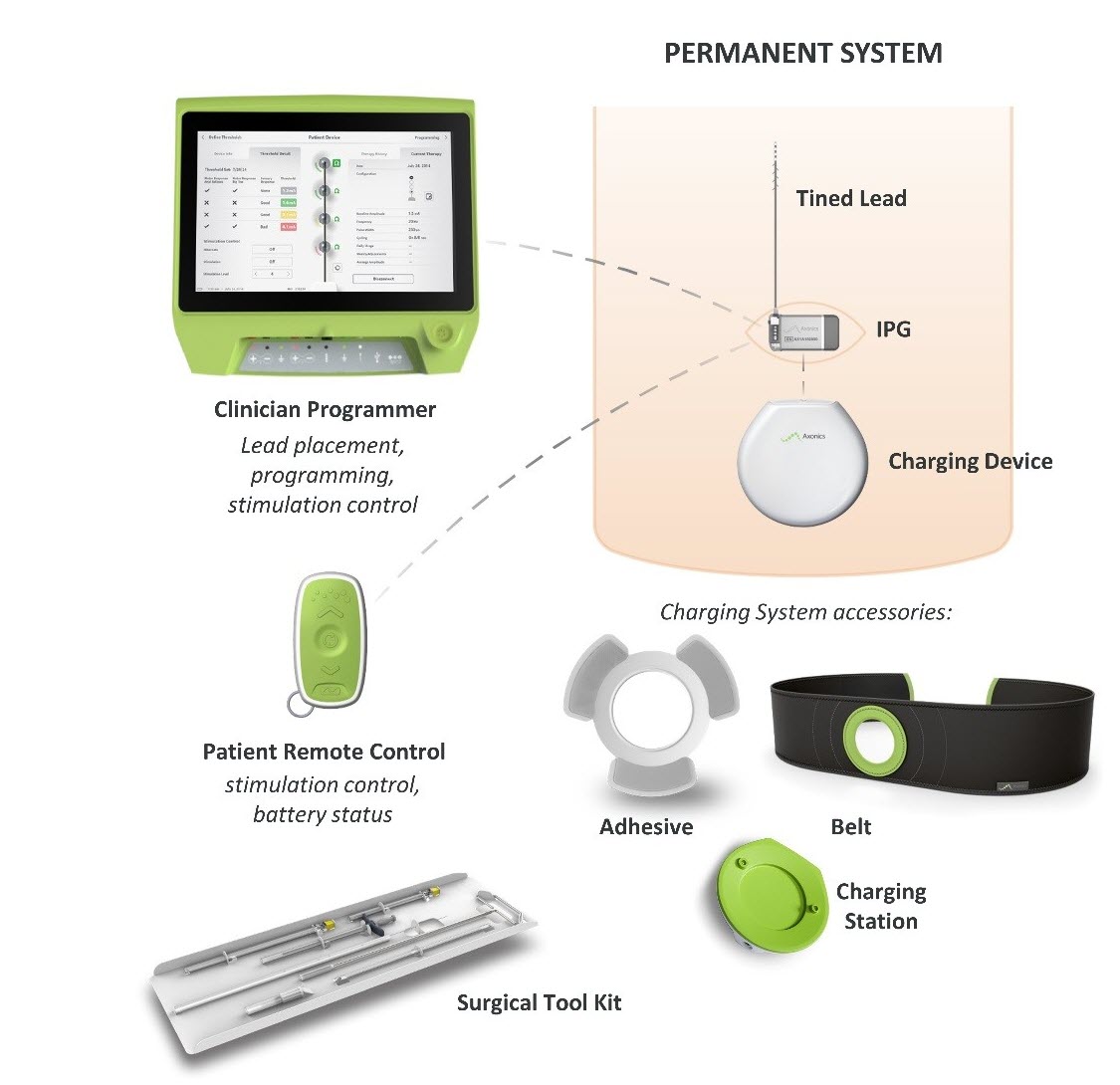
Co je to? Systém sakrální neuromodulace (SNM) společnosti Axonics je systém stimulace sakrálního nervu (SNS), který je určen k léčbě retence moči a příznaků hyperaktivního močového měchýře. Využívá implantovaný stimulátor, který přivádí elektrické impulzy prostřednictvím přívodního drátu k elektrodám umístěným v blízkosti sakrálního nervu.
Jak funguje? Implantovaný pulzní generátor (IPG) je chirurgicky umístěn pod kůži v horní části hýždí a připojen k olověnému drátu, který prochází mezi kyčelními kostmi pánve a končí u sakrálního nervu. IPG vysílá elektrické impulzy prostřednictvím olověného drátu do sakrálního nervu, který putuje z míchy do močového měchýře, aby pomohl zlepšit kontrolu močení.
Kdy se používá? Systém Axonics SNM pro kontrolu močení se používá k léčbě retence moči a příznaků hyperaktivního močového měchýře u pacientů, u kterých selhala nebo nemohli tolerovat jinou léčbu, jako je změna životního stylu, cvičení pánevního dna nebo léky. Pokud se neléčí, může retence moči a hyperaktivní močový měchýř snížit kvalitu života pacienta a může mít za následek značné problémy při udržování aktivit každodenního života.
Co se tím dosáhne? Výsledky klinické studie systému Axonics SNM v kombinaci s dalšími klinickými údaji sestavenými na základě systematického přehledu dostupné literatury o podobném zařízení SNM ukazují, že pro většinu pacientů s retencí moči a příznaky hyperaktivního močového měchýře, u kterých selhala nebo nemohli tolerovat jinou léčbu, je přínosem. V klinické studii společnosti Axonics u pacientů s urgentní inkontinencí dosáhlo 90 % (116/129) pacientů s implantovaným systémem SNM nejméně 50% snížení počtu úniků urgence po 6 měsících ve srovnání s počtem úniků urgence bez systému SNM. V dlouhodobější studii (van Kerrebroeck, 2007) bylo 152 pacientů s implantovaným podobným zařízením SNM sledováno po dobu 5 let. Po pěti letech došlo u 58 % (56/96) pacientů s urgentní inkontinencí k nejméně 50% zlepšení (měřeno počtem úniků za den). Navíc po 5 letech došlo u 40 % (10/25) pacientů s urgencí-frekvencí k nejméně 50% zlepšení (měřeno z hlediska počtu vyměšování za den) a u 58 % (18/31) pacientů s retencí moči došlo k nejméně 50% zlepšení (měřeno z hlediska počtu katetrizací za den). Vzhledem k podobnosti konstrukce, technologie, výkonu, indikací k použití, výstupních charakteristik a populace pacientů, pro které je určen, se FDA domnívá, že systém Axonics SNM bude mít podobný výkon jako komerčně dostupný systém SNM hodnocený v publikovaných studiích.
Kdy by se neměl používat? Systém Axonics SNM by neměl být používán u:
- Pacientů, kteří neprokázali odpovídající odpověď na testovací stimulaci, nebo
- Pacientů, kteří nejsou schopni systém Axonics SNM obsluhovat
Další informace (včetně upozornění, opatření a nežádoucích účinků):
- Souhrn údajů o bezpečnosti a účinnosti
- Označení pro pacienty
- Označení pro lékaře
- Záznam v databázi PMA
.