- Was ist eine polare kovalente Bindung?
- Eigenschaften von polaren kovalenten Bindungen
- Beispiele für polare kovalente Bindungen
- Wasser (H2O)
- Chlorwasserstoff (HCl)
- Ammoniak (NH3)
- Bromwasserstoff (HBr)
- Unterschied zwischen polaren und unpolaren kovalenten Bindungen
- Polare kovalente Bindung vs. Unpolare kovalente Bindung
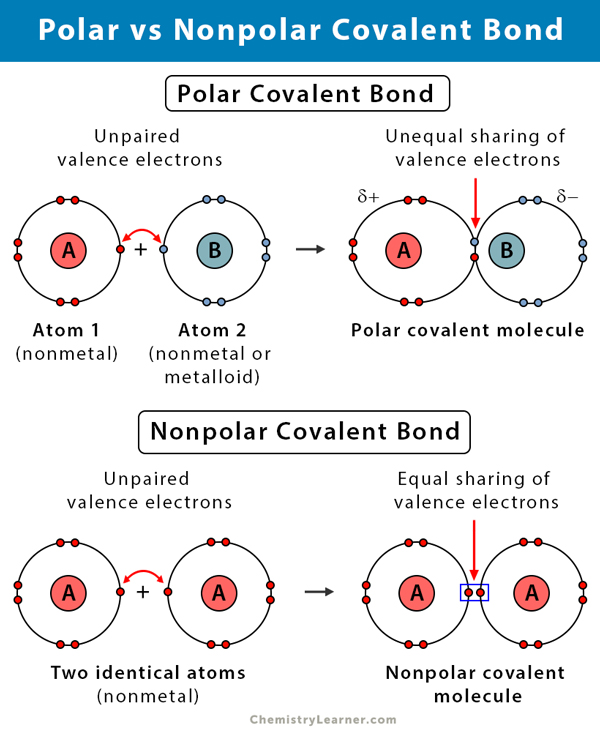
Was ist eine polare kovalente Bindung?
Eine kovalente Bindung entsteht, wenn zwei Atome Elektronen miteinander teilen. Die kovalente Bindung ist wahrscheinlich polar, wenn die Elektronen ungleichmäßig verteilt sind. Die Schieflage entsteht durch den Unterschied in der Elektronegativität der beiden Atome. Die Elektronegativität ist ein Maß für die Neigung eines Atoms, ein bindendes Elektronenpaar anzuziehen. Sie wird anhand einer Skala gemessen, die als Pauling-Skala bekannt ist und von 0,7 bis 4 reicht. Die folgende Tabelle erläutert die Art der chemischen Bindung, die aufgrund dieses Elektronegativitätsunterschieds entsteht.
| Art der chemischen Bindung | Elektronegativitätsunterschied |
|---|---|
| Unpolar kovalent | 0 |
| Leicht polar kovalent | 0.1 bis 0,4 |
| Polare kovalente | 0,5 bis 2 |
| Ionische | > 2 |
Je größer der Unterschied in der Elektronegativität ist, desto größer ist die Polarität und die Bindungsstärke. Daher haben polare kovalente Bindungen eine mittlere Bindungsstärke.
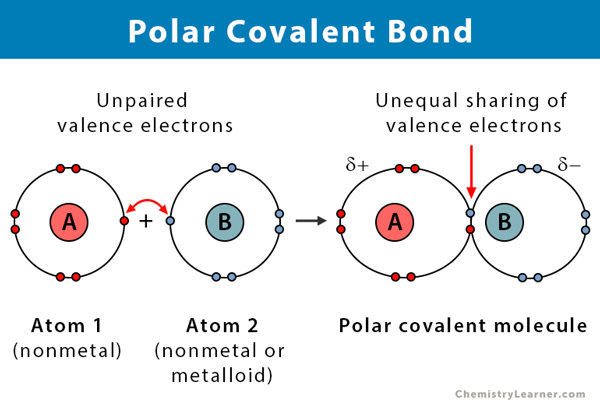
Eigenschaften von polaren kovalenten Bindungen
Hier sind einige Fakten über polare kovalente Bindungen.
- Findet zwischen zwei Nichtmetallen oder zwischen einem Nichtmetall und einem Metalloid statt
- Ungleiche Verteilung der Elektronen in einer Verbindung
- Elektronegativitätsunterschied zwischen den Atomen liegt zwischen 0.1 und 2
- Ein Ende der Bindung ist positiv geladen, das andere negativ
- Polare Verbindungen lösen sich in einem polaren Lösungsmittel auf
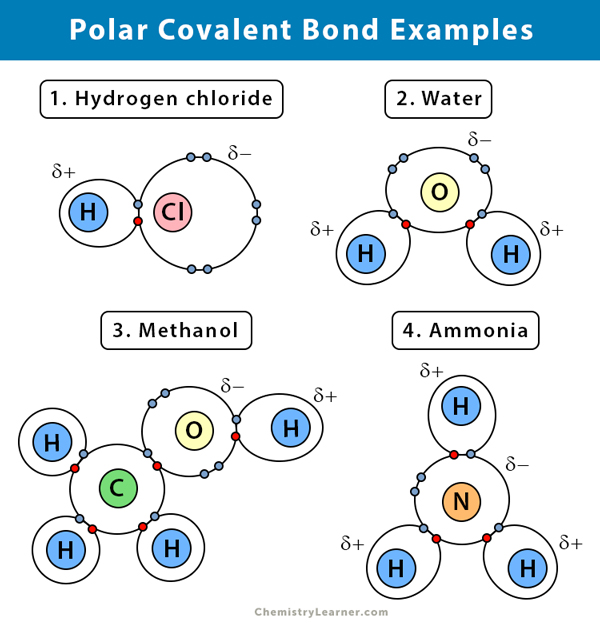
Beispiele für polare kovalente Bindungen
Hier sind einige Beispiele für eine polare kovalente Bindung mit dem Elektronegativitätsunterschied zwischen den beiden bindenden Atomen:
| Verbindungsname | Molekulare Formel | Bindung | Elektronegativität Unterschied |
|---|---|---|---|
|
Wasser |
H2O |
O-H |
|
| Fluorwasserstoff | HF | H-F | 1.9 |
| Chlorwasserstoff | HCl |
H-Cl |
0.9 |
|
Bromwasserstoff |
HBr |
H-Br |
|
|
Ammoniak |
NH3 |
N-H |
|
|
Schwefeldioxid |
SO2 | S=O | 1 |
| Schwefelwasserstoff | H2S | H-S | 0.4 |
| Methanol | CH3OH | O-H | 1.4 |
Eine Erklärung der polaren kovalenten Bindung in einigen Verbindungen wird unten gegeben.
Wasser (H2O)
Wasser ist ein polares Lösungsmittel. Eine polare kovalente Bindung entsteht, wenn das Sauerstoffatom (O), das elektronegativer ist als Wasserstoff, die gemeinsamen Elektronen zu sich zieht. Infolgedessen hat das Sauerstoffatom eine teilweise negative Ladung. Die Wasserstoffe (H) hingegen sind im Wesentlichen Protonen und tragen eine positive Teilladung.
Chlorwasserstoff (HCl)
Chlorwasserstoff ist eine polare kovalente Verbindung, da das Chloratom (Cl) elektronegativer ist als das Wasserstoffatom (H). Chlor ist also teilweise negativ geladen, während Wasserstoff teilweise positiv geladen ist.
Ammoniak (NH3)
Ammoniak ist ein polares Molekül. Das zentrale Atom, Stickstoff (N), ist an drei Wasserstoffatome (H) gebunden. Da das N-Atom elektronegativer ist als das H-Atom, bleiben die Elektronen eher am N-Atom hängen.
Bromwasserstoff (HBr)
Der Unterschied in der Elektronegativität zwischen Wasserstoff (H) und Brom (Br) ist nicht allzu groß. Daher hat das HBr-Gas eine kovalente Bindung, die polarisiert ist, und das Wasserstoffatom hat eine leichte positive Ladung, während das Bromatom eine leichte negative Ladung hat. Infolgedessen wird das Elektronenpaar vom Brom angezogen.
Unterschied zwischen polaren und unpolaren kovalenten Bindungen
Die folgende Tabelle vergleicht und kontrastiert polare und unpolare kovalente Bindungen.
Polare kovalente Bindung vs. Unpolare kovalente Bindung |
||
| Polar | Nichtpolar | |
|---|---|---|
|
Atomtypen |
zwischen zwei Nichtmetallen mit unterschiedlichen Elektronegativitäten |
Zwischen zwei Nichtmetallen mit gleichen Elektronegativitäten |
|
Elektronegativitätsunterschied |
0.1 – 2 |
|
|
Elektronenverteilung |
Asymmetrisch. Ungleiche Aufteilung. |
Symmetrisch. Gleiche Verteilung. |
|
Verschiebung der geteilten Elektronen |
Zu dem elektronegativeren Atom hin, wodurch dieser Teil negativ wird |
Keine Verschiebung. Elektrisch neutral. |
|
Dipolmoment |
NichtNull |
Null |
|
Vorhandensein anderer Bindungsarten in Verbindungen |
Wasserstoffbindung |
Van der Waals-Bindung |
|
Affinität zu Wasser |
Hydrophil |
Hydrophob |
|
Physikalische Eigenschaften der Verbindungen |
Hohe Schmelz- und Siedepunkte |
Niedrige Schmelz- und Siedepunkte |
|
Volatilität von Flüssigkeiten |
Niedrige Volatilität |
Hohe Volatilität |
|
Löslichkeit von Verbindungen |
Löslich in polaren Lösungsmitteln |
Löslich in unpolaren Lösungsmitteln |
|
Beispiele |
Wasser (H2O), Ammoniak (NH3) und Chlorwasserstoff (HCl) |
Wasserstoff (H2), Sauerstoff (O2) und Stickstoff (N2) |