- Introduction
- Methoden
- Verbreitungsdaten und Biom-Klassifikation
- Artenzusammensetzung zwischen den Biomen
- Merkmalsdaten
- Messung der Merkmals-Hypervolumina
- Funktionelle Besonderheit und Verbreitung
- Funktionsraum- und Biomähnlichkeit
- Ergebnisse
- Diskussion
- Wissenslücken
- Gemeinsame Muster innerhalb der Biome
- Vergleiche zwischen Biomen
- Schlussfolgerungen
- Datenverfügbarkeit
- Beiträge der Autoren
- Finanzierung
- Erklärung zu Interessenkonflikten
- Danksagungen
- Ergänzendes Material
Introduction
Ecologists and biogeographers organize land plant biodiversity into climatically-determined biomes, with physiognomies characterized by the growth forms and functional traits of the dominant species (Moncrieff et al., 2016). Das Konzept der Biome hat in der Tat eine lange Geschichte, die auf Carl Ludwig Willdenow und Alexander von Humboldt zurückgeht. Willdenow erkannte, dass ähnliche Klimate ähnliche Vegetationsformen begünstigen, und Humboldt beobachtete den weit verbreiteten Zusammenhang zwischen Pflanzenverbreitung, Physiognomie und Umweltfaktoren. Insgesamt spiegelt das Konzept der Biome die Annahme wider, dass ähnliche Umweltbelastungen Arten mit ähnlichen funktionalen Eigenschaften hervorbringen, unabhängig von ihrer Evolutionsgeschichte. Gleichzeitig sind die existierenden Biome der Erde bis zu einem gewissen Grad phylogenetisch unterschiedlich, wobei viele bzw. die meisten der charakteristischen Arten aus bestimmten Linien stammen, die wichtige Anpassungen nicht nur an klimatische Selektion, sondern auch an zusätzliche Belastungen wie Feuer oder Megaherbivoren aufweisen (Woodward et al., 2004; Pennington et al., 2006; Donoghue und Edwards, 2014). Da Biome großräumige Regelmäßigkeiten in der Vegetation der Erde darstellen, ist das Verständnis funktionaler Unterschiede zwischen den Biomen von entscheidender Bedeutung für die Modellierung des globalen Kohlenstoffkreislaufs und der Funktionsweise des Erdsystems, einschließlich der Reaktionen auf den anthropogenen globalen Wandel (Bonan et al., 2012; van Bodegom et al., 2014; Xia et al., 2015).
In den letzten zwei Jahrzehnten hat das Verständnis der funktionalen Dimension der Pflanzenbiodiversität auf kontinentaler Ebene rapide zugenommen (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018). Umfangreiche Bemühungen zur Datensynthese und -analyse haben einen begrenzten Raum funktionaler Merkmale definiert, der Variationen in der Gesamtgröße der Pflanze, der Blattökonomie und der Hydraulik umfasst und als funktionale Merkmalspektren bekannt ist (Wright et al., 2004; Díaz et al., 2016). Funktionale Eigenschaftsspektren definieren physiologische und ökologische Kompromisse, die die Lebensstrategien von Pflanzen bestimmen (Westoby, 1998; Reich et al., 2003; Craine, 2009) und ihren Einfluss auf die Zusammensetzung von Gemeinschaften (Kraft et al., 2008), die Funktion von Ökosystemen (Lavorel und Garnier, 2002; Garnier et al., 2004; Kerkhoff et al., 2005; Cornwell et al., 2008) und sogar die Evolutionsraten (Smith und Donoghue, 2008; Smith und Beaulieu, 2009). Die Allgemeingültigkeit und Nützlichkeit der Spektren funktionaler Pflanzeneigenschaften hat ihre Einbeziehung in Modelle der globalen Verteilung der Vegetation (van Bodegom et al., 2014), des biogeochemischen Kreislaufs (Bonan et al., 2012) und der Ökosystemdienstleistungen (Díaz et al., 2007; Cadotte et al., 2011; Lavorel et al., 2011) beschleunigt. Allerdings haben nur wenige Studien umfassende Messungen der funktionalen Vielfalt auf der Biomebene sowohl für dominante als auch für untergeordnete Arten und Lebensformen untersucht.
Es gibt zwei gegensätzliche Vorhersagen darüber, wie die funktionale Vielfalt zwischen klimatisch und physiognomisch unterschiedlichen Biomen variiert. Einerseits, wenn die biologische Vielfalt von Biomen die Variation im verfügbaren ökologischen Nischenraum widerspiegelt, sollten weniger taxonomisch vielfältige Biome eine kleinere, weitgehend verschachtelte Teilmenge des von vielfältigeren Biomen besetzten Funktionsraums darstellen. Andererseits können aufgrund des globalen Charakters grundlegender Kompromisse in der Pflanzenstruktur und -funktion und eines ähnlichen Selektionsdrucks, der auf alle Arten gleich wirkt, Artengruppen, die unterschiedliche Umgebungen bewohnen, tatsächlich ähnliche Bereiche des Merkmalsraums teilen (Reich et al., 2003; Wright et al., 2004; Díaz et al., 2016). Neuere Studien bestätigen, dass die Beziehungen zwischen dem Klima und der funktionalen und taxonomischen Vielfalt (d. h. dem Artenreichtum) komplex und skalenabhängig sind. In einigen Fällen folgt die funktionale Vielfalt eng den klimatischen Gradienten, wobei die funktionale Vielfalt unter variableren und extremeren Bedingungen geringer ist (Swenson et al., 2012; de la Riva et al., 2018), und das Volumen des funktionalen Raums in lokalen Assemblagen vergrößert sich mit zunehmendem taxonomischen Reichtum (Lamanna et al., 2014; Li et al., 2018). Analysen von Artenpools auf regionaler Ebene deuten jedoch darauf hin, dass große Veränderungen des Artenreichtums mit minimalen Auswirkungen auf die funktionale Vielfalt verbunden sein können (Lamanna et al., 2014; Šímová et al., 2015). Darüber hinaus können sich die Reaktionen der taxonomischen und funktionalen Vielfalt auf das Klima zwischen den wichtigsten Pflanzenwachstumsformen unterscheiden (Šímová et al., 2018), und die relative Vielfalt verschiedener Wachstumsformen kann sich entlang der Klimagradienten, die verschiedene Biome definieren, erheblich verändern (Engemann et al., 2016).
Fortschritte bei der Analyse der funktionalen Vielfalt auf kontinentaler bis globaler Ebene wurden zum Teil durch Datenmängel bei der Katalogisierung der taxonomischen, verbreitungsbezogenen, phylogenetischen und funktionalen Aspekte der biologischen Vielfalt eingeschränkt (Hortal et al., 2015). Darüber hinaus sind selbst angesichts der begrenzten verfügbaren Daten erhebliche informatische Herausforderungen mit der Standardisierung und Integration großer, disparater Datensätze verbunden, die die geografische Verteilung, funktionale Merkmale und phylogenetische Beziehungen von Arten beschreiben (Violle et al., 2014). Hier untersuchen wir die Verteilung der funktionellen Vielfalt von Pflanzenarten in den Biomen Nord- und Südamerikas mithilfe der Datenbank des Botanical Information and Ecology Network (BIEN; Enquist et al., 2016; Maitner et al., 2018), die Informationen zur Verbreitung und zu funktionellen Merkmalen von >100.000 Landpflanzenarten zusammenstellt. Insbesondere untersuchen wir die Variation in der funktionalen Vielfalt und Besonderheit von Biomen, basierend auf Karten der Verteilung von Landpflanzenarten auf einer Skala von 100 × 100 km Rasterzellen und einem umfassenden Datensatz von sechs funktionalen Merkmalen, die die wichtigsten Achsen der Variation in ökologischen Strategien widerspiegeln.
Unsere Ziele in dieser Studie sind dreifach. Erstens dokumentieren wir den Umfang der verfügbaren Daten, die die funktionelle Vielfalt und die Besonderheit von Biomen charakterisieren, um anhaltende Datendefizite aufzuzeigen. Zweitens charakterisieren wir auf der Grundlage der verfügbaren Daten die Verteilung der funktionellen Vielfalt innerhalb der Biome sowohl für die dominanten als auch für die untergeordneten Wachstumsformen. Diese Analysen ermöglichen es uns, die funktionelle Besonderheit eines Bioms besser zu quantifizieren, indem wir die häufigsten funktionellen Strategien der am weitesten verbreiteten Arten innerhalb des Bioms identifizieren. Drittens stellen wir uns die Frage, ob Biome tatsächlich durch funktional unterschiedliche Artenansammlungen charakterisiert sind, basierend auf der Überlappung mehrdimensionaler Hypervolumina im Raum der funktionalen Merkmale.
Methoden
Verbreitungsdaten und Biom-Klassifikation
Um die Auswirkungen der Stichprobenverzerrung zu reduzieren, die für aus mehreren Quellen zusammengestellte Vorkommensdaten charakteristisch ist, verwendeten wir die BIEN 2.0 Verbreitungskarten für 88.417 Pflanzenarten in Nord- und Südamerika (Goldsmith et al., 2016). Die BIEN-Datenbank enthält standardisierte Pflanzenbeobachtungen, die aus Herbariumsproben und Vegetationsbestandsaufnahmen stammen. Die Karten der Verbreitungsgebiete der Arten in den BIEN-Datenbanken wurden je nach den für die einzelnen Arten verfügbaren Vorkommen mit einem von drei Ansätzen geschätzt. Für Arten mit nur einem oder zwei Vorkommen (ca. 35 % der Arten) wurde das geografische Verbreitungsgebiet als ein quadratisches 75 000 km2 großes Gebiet um jeden Datenpunkt definiert. Die geografischen Verbreitungsgebiete von Arten mit drei oder vier Vorkommen wurden anhand einer konvexen Hülle ermittelt (ca. 15 % der Arten). Schließlich wurden die Verbreitungskarten für Arten mit mindestens fünf Vorkommen mithilfe des Maxent-Algorithmus zur Modellierung der Artenverteilung erstellt, wobei 19 klimatische Schichten als Vorhersagevariablen und 19 räumliche Eigenvektoren als Filter zur Einschränkung der Vorhersagen durch die Modelle verwendet wurden (siehe Goldsmith et al, 2016 für weitere Details zur Methodik der Verbreitungskarten).
Wir überlagerten die BIEN 2.0-Pflanzenartenkarten auf einer 100 × 100 km-Rasterkarte mit einer azimutalen Lambert-Gleichflächenprojektion, um eine Präsenz/Absenz-Matrix der Arten für jede Rasterzelle zu erhalten. Auf der Grundlage der Biom-Klassifikation von Olson et al. (2001) wurde jede Matrix-Gitterzelle einer der Biom-Kategorien zugeordnet. Aufgrund von Berechnungsbeschränkungen für die nachfolgenden Analysen haben wir einige Biome aufgrund ihrer Ähnlichkeiten in Bezug auf Klima, Vegetation und Literatur zusammengefasst, um eine umfassende Klassifizierung wie in Tabelle 1 beschrieben zu erhalten (mit Ausnahme von Binnengewässern, Felsen und Eis sowie Mangroven). Die Ökoregionen Chaco und Caatinga wurden in Anlehnung an Prado und Gibbs (1993), Pennington et al. (2000), Banda et al. (2016), Silva de Miranda et al. (2018) als Xeric Woodlands bzw. Dry forest klassifiziert.
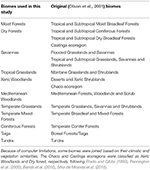
Table 1. Überblick über die in dieser Studie verwendete Biom-Klassifikation und die äquivalente (Olson et al., 2001) Biom-Klassifikation (ohne Binnengewässer, Fels und Eis und Mangroven).
Artenzusammensetzung zwischen den Biomen
Um die Variation im Raum der funktionalen Merkmale zwischen den Biomen zu verstehen, untersuchten wir zunächst die Unterschiede in der Zusammensetzung der Pflanzenarten zwischen ihnen. Auf der Grundlage der Artenliste für jede Gitterzelle und jedes Biom definierten wir die charakteristischen Arten jedes Bioms als diejenigen, die den größten Anteil ihres Verbreitungsgebiets in diesem Biom haben. Diese Listen der geografisch vorherrschenden Arten in einem bestimmten Biom wurden mit der Liste der Arten in anderen Biomen verglichen. Dieser paarweise Vergleich bietet eine einfache Möglichkeit, eine gerichtete taxonomische Überschneidung zwischen den Biomen zu ermitteln (d. h. den Anteil der vorherrschenden Arten eines Bioms, der mit einem anderen Biom gemeinsam ist). Von den 88.417 Arten mit verfügbaren Verbreitungskarten haben 44.899 Arten Verbreitungsgebiete, die sich über mehr als ein Biom erstrecken, und 43.518 Arten sind in einem bestimmten Biom endemisch.
Merkmalsdaten
Wir haben alle Merkmalsinformationen für Pflanzenarten in der Neuen Welt extrahiert, die im BIEN 3.0-Datensatz (abgerufen am 7. Februar 2018) verfügbar sind, was insgesamt 80.405 Merkmalsbeobachtungen auf Artniveau ergibt. Anschließend filterten wir die Informationen für sechs funktionale Merkmale: maximale Pflanzenhöhe (m), Samenmasse (mg), Holzdichte (mg/cm3), spezifische Blattfläche SLA (cm2/g) und Blattphosphor- und Blattstickstoffkonzentration pro Masseneinheit (mg/g). Nach der Filterung blieben insgesamt 18 192 Beobachtungen auf Artniveau übrig. Von diesen wurden 8 820 Arten, die sowohl über Verbreitungskarten als auch über Merkmalsinformationen verfügten, für weitere Analysen verwendet.
Um den Raum der funktionalen Merkmale für jedes Biom zu schätzen, benötigten wir vollständige Merkmalsdaten. Aus diesem Grund haben wir fehlende Merkmalsdaten phylogenetisch imputiert (Bruggeman et al., 2009; Penone et al., 2014; Swenson, 2014; Swenson et al., 2017), indem wir das R-Paket “Rphylopars” v 0.2.9 (Goolsby et al., 2017) und die kürzlich veröffentlichte Phylogenie der Samenpflanzen von Smith und Brown (2018) als Grundlage verwendeten. Die phylogenetische Imputation ist ein Instrument zur Vorhersage fehlender Daten in Datensätzen mit funktionalen Merkmalen, das auf der Annahme beruht, dass eng verwandte Arten tendenziell ähnliche Merkmalswerte aufweisen (Swenson, 2014). Wir verwendeten den ALLBM-Baum (d. h. Genbank und Open Tree of life Taxa mit einem Rückgrat, das von Magallón et al. (2015) zur Verfügung gestellt wurde), weil er die Überlappung zwischen Arten mit verfügbaren Merkmals- und Verteilungsinformationen maximierte. Nach der Merkmals-Imputation blieben insgesamt 7.842 Arten mit vollständigen Merkmalsinformationen und Verbreitungskarten für die weitere Analyse übrig.
Messung der Merkmals-Hypervolumina
Wir haben die relative funktionale Vielfalt der Biome gemessen, indem wir Merkmals-Hypervolumina aus Artenpools innerhalb der Biome-Zellen berechnet haben. Aufgrund von Rechenbeschränkungen haben wir die Merkmals-Hypervolumina anhand einer Zufallsstichprobe von 20 % der Zellen in jedem Biom erstellt. Die Hypervolumina für jede Gitterzelle wurden anhand der extrahierten sechs funktionalen Merkmale und des R-Pakets “hypervolume” (Blonder et al., 2014, 2018) unter Verwendung der Gauß-KDE-Methode mit dem standardmäßigen Silverman-Bandbreitenschätzer geschätzt. Samenmasse, Höhe und Holzdichte wurden log-transformiert, während SLA Quadratwurzel-transformiert wurde. Alle Merkmale wurden vor der Analyse skaliert und zentriert. Hypervolumina werden in Einheiten von Standardabweichungen (sd) zur Potenz der Anzahl der verwendeten Merkmale (d. h. sd6) angegeben.
Funktionelle Besonderheit und Verbreitung
Da Biome durch ihre dominante Vegetation charakterisiert sind, haben wir auch die geografische Häufigkeit und funktionelle Besonderheit von Arten innerhalb von Biomen untersucht. Mithilfe von Karten des Verbreitungsgebiets der Arten und Informationen zu funktionalen Merkmalen schätzten wir die funktionale Besonderheit und die Verbreitung jeder Art in jedem Biom nach dem konzeptionellen Rahmen der funktionalen Seltenheit von Violle et al. (2017). Unter Verwendung des gesamten Satzes von (gemessenen und unterstellten) Merkmalen haben wir zunächst den euklidischen Abstand im standardisierten Merkmalsraum zwischen allen Artenpaaren gemessen. Anschließend berechneten wir die funktionelle Unterscheidbarkeit (Di) für jede Art in jedem Biom als den durchschnittlichen funktionellen Abstand einer Art zu den N anderen Arten innerhalb des Artenpools des Bioms. Di wurde innerhalb jedes Bioms zwischen 0 und 1 skaliert, wobei niedrigere Werte für Arten stehen, die funktionell häufig vorkommen (redundant sind), und höhere Werte für Arten, die im Vergleich zu den anderen Arten des Bioms funktionell unterscheidbar sind. Wir schätzen auch die geografische Verbreitung (Wi) einer Art in einem Biom, gemessen als die Anzahl der von der Art in einem Biom besetzten Gitterzellen im Verhältnis zur Gesamtzahl der Zellen in diesem Biom. Ein Wert von 1 bedeutet, dass die Schwerpunktart in allen vom Biom abgedeckten Rasterzellen vorkommt. Sowohl die funktionale Unterscheidbarkeit als auch die geografische Verbreitung wurden mit dem R-Paket “funrar” (Grenié et al., 2017) berechnet.
Da wir keine umfassenden Maße für die Dominanz auf der Grundlage der lokalen Abundanz oder Biomasse haben, haben wir die Maße Di und Wi verwendet, um für jedes Biom die “häufigsten” Arten zu identifizieren, d. h. diejenigen, die sowohl geografisch weit verbreitet (Wi > 0,5) als auch funktional ähnlich sind (Di < 0,25). Dieser letzte Schwellenwert wurde verwendet, da das dritte Quantil der Werte für die funktionelle Unterscheidbarkeit zwischen den Biomen zwischen 0,2 und 0,3 lag. Zur Unterscheidung zwischen funktionell unterschiedlichen Arten und funktionell ähnlichen Arten in den nachfolgenden Analysen verwendeten wir daher einen Wert von 0,25 als Grenzwert (d. h., Arten mit Unterscheidungswerten < 0,25 wurden als funktionell gemeinsam oder redundant innerhalb eines bestimmten Bioms betrachtet).
Funktionsraum- und Biomähnlichkeit
Um die Überlappung zwischen den Hypervolumina der Biome zu schätzen, verwendeten wir den Sørensen-Ähnlichkeitsindex unter Verwendung (i) der Gesamtzahl der Arten und (ii) der Liste der Arten, die als funktionell gemeinsam und geografisch weit verbreitet für jedes Biom betrachtet wurden. Die Ähnlichkeit des funktionalen Merkmalsraums wurde als die paarweise fraktionelle Überlappung der Hypervolumina zwischen den Biomen berechnet. Die fraktionelle Überlappung wurde berechnet, indem das doppelte Volumen der Schnittmenge zweier Hypervolumina durch das Volumen ihrer Vereinigung geteilt wurde. Alle Hypervolumina wurden mit dem R-Paket “hypervolume” (Blonder et al.
Ergebnisse
Wir fanden erhebliche Überschneidungen in der Zusammensetzung der Pflanzenarten zwischen den Biomen, basierend auf der Schnittmenge der modellierten Artenbereiche (siehe Abbildung 1 und ergänzende Tabelle 1). Diese taxonomische Überschneidung ist in den tropischen und gemäßigten Biomen größer, wobei nur relativ wenige Arten in diesen beiden Klimazonen vorkommen. Interessanterweise kommen in den trockenen Wäldern Arten sowohl in den tropischen als auch in den gemäßigten Klimazonen vor. Trotz des hohen Anteils an Arten, die für tropische Feuchtwälder charakteristisch sind (83 %), teilt dieses Biom auch eine große Anzahl von Arten mit anderen tropischen Biomen wie Trockenwäldern, Savannen, xerischen Wäldern und tropischen Graslandschaften. Die hohe taxonomische Überschneidung mit gemäßigten Biomen wie gemäßigten Grasländern, mediterranen Wäldern, Taiga und Tundra deutet auf das Potenzial für eine geringe funktionelle Besonderheit hin, wobei einige gemäßigte Biome eine schlechtere Untergruppe der artenreicheren, funktionell vielfältigen tropischen Biome darstellen.
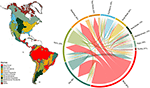
Abbildung 1. Überschneidung von Pflanzenarten in den Biomen der Neuen Welt. Die Prozentwerte geben den Anteil der in einem Biom vorkommenden Arten an, die den größten Teil ihres geografischen Verbreitungsgebiets in diesem Biom haben, N = 84.413. Die Basis jedes verzweigten Pfeils ist so positioniert, dass sie das Biom zeigt, das den größten Anteil des Verbreitungsgebiets einer Art umfasst, während die Breite die Anzahl der Arten darstellt, die mit den Biomen an den Pfeilspitzen geteilt werden. Die zugrundeliegende Matrix finden Sie in der ergänzenden Tabelle 1.
Mit weniger als 10 % der kartierten Arten waren die Merkmalsdaten für unsere biomeigenen Artengemeinschaften recht spärlich (Abbildung 2A). Darüber hinaus unterschieden sich die verfügbaren Merkmalsdaten erheblich zwischen den Merkmalen, Pflanzengruppen und Biomen. Phylogenetisch gesehen waren Blatt-P und Holzdichte besonders schlecht vertreten, da für ganze Kladen keine Daten verfügbar waren. Infolgedessen mussten von den etwa 2/3 der Merkmalswerte für unsere 7.842 Arten, die imputiert werden mussten, viele in Ermangelung von eng verwandten Taxa zugeordnet werden. Geografisch gesehen sind SLA, Höhe und Samenmasse in den Tropen und im gemäßigten Südamerika untererfasst, während Blatt-N und Holzdichte in den verschiedenen Regionen gleichmäßiger erfasst werden. Blatt-P ist in allen Biomen schlecht erfasst. Hypervolumina von Merkmalen, die aus Artenpools mit einer Zufallsauswahl von 20 % der Zellen für jedes Biom erstellt wurden, zeigen hauptsächlich Unterschiede zwischen tropischen und gemäßigten/kalten Biomen (Abbildung 2B). Hypervolumina von Merkmalen sind in tropischen Biomen tendenziell größer und variabler, wobei die höchste Variation in feuchten und trockenen tropischen Wäldern zu verzeichnen ist. Unter den gemäßigten/kalten Biomen weisen Nadelwälder und gemäßigte Mischwälder die größten Merkmalshypervolumina auf. Interessanterweise weisen xerische Strauchlandschaften eine Verteilung der Hypervolumina auf, die eher den tropischen als den gemäßigten Biomen entspricht.
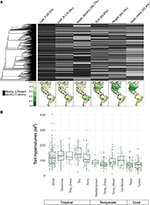
Abbildung 2. (A) Anteil der Arten in der BIEN 3.0 Datenbank mit bekannten (grau) oder fehlenden (schwarz) Merkmalswerten. Die Phylogenie auf der linken Seite entspricht dem ALLBM-Baum der Samenpflanzen von Smith und Brown (2018) (d. h. GenBank und Open Tree of life Taxa mit einem Rückgrat von Magallón et al., 2015). Die Karten stellen den Anteil der Arten mit Merkmalsinformationen im Verhältnis zur Gesamtzahl der Arten in der BIEN 2.0-Datenbank dar. (B) Verteilung der Merkmals-Hypervolumina von 20 % der zufällig ausgewählten 100 × 100 km großen Zellen in jedem Biom. Die Hypervolumina werden in Einheiten von Standardabweichungen hoch der Anzahl der verwendeten Merkmale angegeben.
Die Beziehung zwischen funktioneller Unterscheidbarkeit und geografischer Verteilung ist in den verschiedenen Biomen bemerkenswert ähnlich (Abbildung 3). In jedem Biom ist die überwiegende Mehrheit der Arten sowohl geographisch begrenzt als auch funktionell ähnlich. Gleichzeitig waren die funktionell ausgeprägtesten Arten in jedem Biom im Allgemeinen auch geografisch begrenzt, und die geografisch am weitesten verbreiteten Arten waren fast immer funktionell ähnlich.
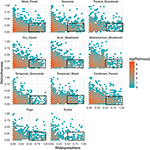
Abbildung 3. Muster der funktionellen Unterscheidbarkeit in verschiedenen Biomen. Die Unterscheidungskraft gibt an, wie weit die Arten innerhalb eines Bioms funktionell voneinander entfernt sind (d. h. der mittlere paarweise phänotypische Abstand zwischen einer Fokusart und allen anderen). Je größer der Wert ist, desto weiter ist eine Art vom Schwerpunkt des Funktionsraums des Bioms entfernt. Die Verbreitung misst, wie weit eine Art in einem Biom verbreitet ist. Ein Wert von 0 bedeutet, dass eine Art nur in einer einzigen Biomzelle vorkommt. Die Bin-Werte sind die Anzahl der Arten auf einer Logenskala. Die Rechtecke stellen die Arten dar, die in jedem Biom als funktionell ähnlich und weit verbreitet gelten, wobei Grenzwerte von 0,25 und 0,5 für die Unterscheidbarkeit bzw. die Verbreitung verwendet werden.
Wir fanden beträchtliche Unterschiede in der proportionalen Verteilung der Wuchsformen innerhalb und zwischen Biomen. In tropischen Biomen sind holzige Arten die vorherrschenden Wuchsformen, während in gemäßigten Klimazonen krautige Arten dominieren (Abbildung 4). Wenn wir nur die in den einzelnen Biomen weit verbreiteten und funktionell häufigen Arten betrachteten, änderte sich die Verteilung der Wuchsformen über die Biome hinweg, insbesondere im Hinblick auf den Anteil der Bäume, Kräuter und Gräser. So nahm beispielsweise in den tropischen Biomen der Anteil der Bäume in allen Biomen mit Ausnahme der feuchten Wälder ab. In den gemäßigten Biomen nahm der Anteil der Gräser zu, insbesondere in den Polarregionen. Interessanterweise ähnelt die Verteilung der Wuchsformen in trockenen Wäldern eher der Verteilung in gemäßigten Biomen, wenn nur weit verbreitete und funktionell häufige Arten berücksichtigt werden.
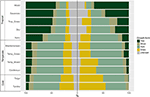
Abbildung 4. Verteilung der Wuchsformen in den einzelnen Biomen (links) unter Verwendung der Gesamtzahl der Arten und (rechts) unter Verwendung nur der Arten, die funktionell ähnlich und innerhalb des Bioms weit verbreitet sind (siehe Abbildung 3).
Paarweise Vergleiche der Artenzusammensetzung zwischen den Biomen zeigen drei Hauptcluster, die die tropischen, gemäßigten und polaren Klimazonen repräsentieren (Abbildung 5A), was die starke taxonomische Überschneidung innerhalb, aber nicht zwischen diesen Regionen widerspiegelt (Abbildung 1). Paarweise Vergleiche der Merkmalshypervolumina zwischen den Biomen zeigen eine weniger klare Clusterung der Klimazonen (Abbildung 5B). In diesem Fall überschneidet sich der Funktionsraum der trockenen Wälder erheblich mit dem der gemäßigten Biome. Diese Analyse zeigt auch die Überschneidung des Funktionsraums von Taigas mit gemäßigtem Grasland und Mischwäldern. Der paarweise Vergleich der Merkmalshypervolumina zwischen den Biomen, bei dem nur die Arten verwendet werden, die als funktionell häufig und weit verbreitet gelten, zeigt eine geringere Überlappung der Merkmalsräume zwischen und innerhalb der Klimazonen (Abbildung 5C). Obwohl xerische Wälder jetzt mit dem Rest der tropischen Biome geclustert sind, weisen diese Lebensräume zusammen mit tropischem Grasland eine große Überlappung im Funktionsraum mit gemäßigten Biomen wie mediterranen Wäldern und gemäßigtem Grasland auf.
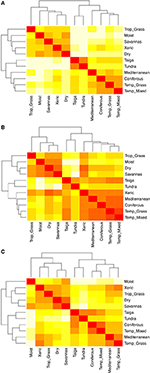
Abbildung 5. (A) Paarweise Unähnlichkeit in der Artenzusammensetzung zwischen den Biomen. (B) Paarweise Unähnlichkeit der Merkmalshypervolumen (1-Sørensen-Ähnlichkeit) zwischen den Biomen unter Verwendung der Gesamtzahl der Arten. (C) Paarweise Unähnlichkeit der Merkmals-Hypervolumina (1-Sørensen-Ähnlichkeit) zwischen den Biomen, wobei nur die Arten verwendet werden, die als funktionell ähnlich und weit verbreitet gelten. Je heller die Zelle, desto größer die Unähnlichkeit.
Diskussion
Unsere Analysen liefern drei wichtige Erkenntnisse für das Verständnis terrestrischer Biome durch eine funktionale Brille. Erstens zeigen wir, dass trotz der Fortschritte bei der Zusammenstellung und Synthese primärer Biodiversitätsdaten nach wie vor erhebliche Wissenslücken bestehen, die unsere Fähigkeit zur Quantifizierung der funktionalen Biodiversität von Biomen auf kontinentaler bis globaler Ebene einschränken könnten. Zweitens zeigen unsere Analysen der verfügbaren Daten, dass alle Biome in Nord- und Südamerika ein bemerkenswertes gemeinsames Muster aufweisen, bei dem die geografisch am weitesten verbreiteten Arten in jedem Biom dazu neigen, gemeinsame funktionelle Merkmale zu teilen, während die funktionell ausgeprägtesten Arten in ihrer Verbreitung ausnahmslos eingeschränkt sind. Drittens lassen sich Biome funktionell leichter unterscheiden, wenn nur die weit verbreiteten und funktionell häufigen Arten betrachtet werden, und die Muster der Unähnlichkeit zwischen Biomen scheinen eine Entsprechung zwischen Klima und funktionellem Nischenraum der Pflanzen widerzuspiegeln. Zusammengenommen deuten unsere Ergebnisse darauf hin, dass die Untersuchung der funktionalen Vielfalt von Biomen zwar noch in den Kinderschuhen steckt, die weitere Entwicklung des Feldes aber wahrscheinlich zu Erkenntnissen führen wird, die Evolution, Biogeografie, Gemeinschaftsbildung und Ökosystemfunktionen miteinander verbinden.
Wissenslücken
Die BIEN-Datenbank wurde speziell entwickelt, um Lücken in unserem Wissen über die biologische Vielfalt von Pflanzen zu schließen, doch wie Hortal et al. (2015) betonen, führen interagierende Wissenslücken zu Unsicherheiten bei der Quantifizierung der biologischen Vielfalt auf den größten Ebenen. So verfügten nicht nur weniger als 10 % unserer kartierten Arten sowohl über Merkmalsdaten als auch über phylogenetische Informationen, sondern diese fehlenden Merkmalsdaten (~66 % der Merkmalswerte der Arten) waren sowohl phylogenetisch als auch geografisch sehr strukturiert. Somit interagiert das Raunkiaersche Defizit an funktionalen Merkmalsdaten (im Sinne von Hortal et al., 2015) mit dem Wallace’schen Defizit an Verbreitungsinformationen und dem Darwinschen Defizit an phylogenetischem Verständnis. Und obwohl wir phylogenetisches Wissen nutzen können, um diese fehlenden Werte vernünftig zu ersetzen (Swenson et al., 2017), bleiben mehrere Aspekte der resultierenden Muster, die für die Klassifizierung von Biomen wichtig sind, unsicher. Zum Beispiel deuten die vorhandenen Daten zu den Wuchsformen darauf hin, dass holzige Arten in allen tropischen Biomen dominieren, während die proportionale Vielfalt krautiger Wuchsformen in gemäßigten und polaren Biomen viel höher ist (siehe auch Engemann et al., 2016; Zanne et al., 2018). Spiegelt dieser Anstieg der relativen Vielfalt der krautigen Pflanzen in den Breitengraden Verzerrungen bei der Probenahme und einen Mangel an taxonomischem Wissen über tropische krautige Pflanzen wider, oder spiegelt er die unterschiedliche evolutionäre und biogeografische Geschichte in der Nearktis und Neotropis wider? Dominante Wuchsformen sind eines der wichtigsten Unterscheidungsmerkmale von Biomen, so dass systematische Veränderungen bei den vielfältigsten Wuchsformen (ob dominant oder nicht) zwangsläufig unsere Vorhersagen darüber beeinflussen, wie sich die funktionelle Vielfalt in den verschiedenen Biomen verändern könnte und wie sich diese Veränderungen auf die Funktion und die Leistungen des Ökosystems auswirken werden.
Wir haben Karten des Artenspektrums als Eingabedaten verwendet, vor allem um das unbestreitbare Problem der Verzerrung bei der Probenahme zu überwinden, das für Datensätze charakteristisch ist, die aus mehreren Quellen zusammengestellt wurden (siehe ergänzende Abbildung 1). Verbreitungskarten, die aus Verbreitungsmodellen von Arten stammen, könnten jedoch ein zusätzliches Element der Unsicherheit in unseren Ergebnissen darstellen. In Anbetracht der geografischen Auflösung dieser Studie und der räumlichen Komplexität bestimmter Biome könnten diese Modelle beispielsweise die geografische Ausdehnung einiger Arten von Zellen eines einzigen Bioms auf Zellen benachbarter und ineinandergreifender Biome überschätzt haben. Die Verwendung von Daten über das Vorkommen änderte nichts an den allgemeinen Ergebnissen dieser Studie (siehe ergänzende Abbildungen 2-6); eine leichte Verringerung der funktionalen Überlappung zwischen den Biomen könnte jedoch in der Tat zu einer Überschätzung der Ausdehnung einiger Arten führen (siehe ergänzende Abbildungen 2, 5 und 6). Die Verwendung von Informationen über das Vorkommen veränderte auch die allgemeinen Beziehungen zwischen funktioneller Unterscheidbarkeit und Verbreitung in unseren Ergebnissen, was auf die relative Überbeprobung von gemäßigten gegenüber tropischen Regionen zurückzuführen ist (siehe ergänzende Abbildung 4). In diesem Fall ist unser Maß für die Verbreitung durch die extrem begrenzte Beprobung der meisten Arten in tropischen Biomen eingeschränkt. Da sich die Datensätze und die Probenahme verbessern, können diese Unsicherheiten in Zukunft wahrscheinlich verringert werden.
Eine weitere Datenlücke, die geschlossen werden muss, um die funktionelle Vielfalt der Biome zu verstehen, ist das Prestonsche Defizit an Informationen über die Abundanz. Die Abundanz ist bei Studien zur funktionellen Vielfalt besonders wichtig, da die Merkmale der dominanten Arten für den Aufbau der Gemeinschaft, das Funktionieren des Ökosystems und den biogeochemischen Kreislauf am wichtigsten sind. Da wir unsere Assemblagen auf Reichweitenkarten stützten, die aus Artenverteilungsmodellen abgeleitet wurden, konnten wir nur die geografische Komponente der Häufigkeit untersuchen, aber die positive Beziehung zwischen lokaler Häufigkeit und geografischer Reichweite, die sogenannte Besetzungs-Häufigkeits-Beziehung, deutet darauf hin, dass die am weitesten verbreiteten Arten in jedem Biom häufig auch zu den häufigeren gehören (Borregaard und Rahbek, 2010; Novosolov et al., 2017). Da Biome im Allgemeinen durch die vorherrschenden Wuchsformen in der Region charakterisiert werden, könnte die Integration von Informationen über die Häufigkeit dazu führen, dass Biome weniger funktionale Überschneidungen aufweisen. Doch auch wenn das BIEN umfangreiche Parzellendaten zusammengestellt hat, die Schätzungen der lokalen Abundanz ermöglichen, werden sinnvolle Vergleiche zwischen verschiedenen Regionen und Wuchsformen durch uneinheitliche Probenahmen, regionale Unterschiede in der Gamma-Diversität und nicht übereinstimmende Methoden zur Quantifizierung der Abundanz erschwert.
Gemeinsame Muster innerhalb der Biome
Trotz der anhaltenden Lücken in den verfügbaren Daten haben unsere Analysen eine bisher nicht dokumentierte Beziehung aufgedeckt, die allen Biomen der westlichen Hemisphäre gemeinsam ist: In jedem Biom neigen die am weitesten verbreiteten Arten dazu, auch eine geringe funktionelle Unterscheidbarkeit aufzuweisen, während die funktionell unterscheidbarsten Arten in ihrer Verbreitung fast ausnahmslos eingeschränkt sind (Abbildung 3). Diese “Belegungs-Redundanz”-Beziehung könnte darauf hindeuten, dass die in einem Biom vorherrschenden klimatischen Bedingungen eine Reihe gemeinsamer Merkmale fördern, wobei funktionell unterschiedlichere Arten auf eine seltenere Untergruppe von Lebensräumen innerhalb des Bioms beschränkt sind. Die allgemeine Prävalenz funktional ähnlicher Arten in allen Biomen und die Beziehung zwischen Besetzungsgrad und Redundanz stehen im Einklang mit einer kürzlich durchgeführten globalen Analyse der funktionalen Vielfalt auf Gemeinschaftsebene, die nahelegt, dass die Filterung von Lebensräumen zur Koexistenz funktional ähnlicher Arten führt (Li et al., 2018), sowie mit Studien, die zeigen, dass funktionale Redundanzen die Stabilität von Gemeinschaften erhöhen (z. B. Walker et al., 1999; Pillar et al., 2013). Zusammen mit dem hohen Maß an taxonomischer und funktioneller Überlappung zwischen den Biomen (Abbildungen 1 und 5) untermauert die Tatsache, dass weit verbreitete Arten funktionell ähnlich sind, die Vorstellung, dass Landpflanzen in einem breiten Spektrum von Umweltbedingungen gemeinsame Merkmale im Kernbereich des Spektrums funktioneller Eigenschaften aufweisen (Wright et al., 2004; Díaz et al., 2016). Im Gegensatz zu Umaña et al. (2017) zeigen unsere Ergebnisse, dass sich seltene, geografisch begrenzte Arten funktionell von weiter verbreiteten und häufigen Arten unterscheiden können oder auch nicht. Somit bleibt die Frage offen, ob funktionell ausgeprägtere Arten Spezialisten in bestimmten Umgebungen sind oder ob ihre Merkmalskombinationen zu demografischen oder physiologischen Kompromissen führen, die ihre geografische Verbreitung einschränken.
Vergleiche zwischen Biomen
Unser Vergleich der Merkmalshypervolumenverteilungen über Biome hinweg (Abbildung 2B) stimmt mit der Beobachtung überein, dass artenreichere Umgebungen auch funktionell vielfältiger sind (Swenson et al, 2012; Lamanna et al., 2014; Li et al., 2018; Šímová et al., 2018). Unsere Ergebnisse sind eher zweideutig in Bezug auf die Hypothese, dass saisonale und extreme klimatische Umgebungen die funktionale Vielfalt von Arten konsequent einschränken (de la Riva et al., 2018). Alle tropischen Biome weisen eine höhere durchschnittliche funktionelle Vielfalt auf als alle gemäßigten Biome, und die polaren Biome weisen die kleinsten Hypervolumina auf. Innerhalb jeder Gruppe weisen jedoch trockenere oder jahreszeitlich variablere Biome nicht immer kleinere Hypervolumina auf (z. B. Trockenwälder, xerische Wälder), wie wir nach der Toleranzhypothese von Currie et al. (2004) erwartet hätten, während optimale klimatische Bedingungen mehr Kombinationen physiologischer Parameter unterstützen. Anhand dieser Ergebnisse allein können wir nicht feststellen, ob gemäßigte und polare Biome aufgrund der Begrenzung des funktionalen Nischenraums weniger taxonomisch vielfältig sind oder ob ihre funktionalen Hypervolumina klein sind, weil sie nicht taxonomisch vielfältig sind. Null-Modellierungsansätze könnten möglicherweise dazu beitragen, taxonomische und funktionale Vielfalt zu entflechten (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018), aber eine solche Analyse würde den Rahmen dieser Studie sprengen. Wichtiger ist jedoch, dass unsere Ergebnisse die Bedeutung des Verständnisses dafür unterstreichen, wie die evolutionäre und biogeografische Geschichte die funktionale Vielfalt von Biomen prägt (Woodward et al., 2004; Pennington et al., 2006; Donoghue und Edwards, 2014; Moncrieff et al., 2016). Die weitreichende gemeinsame Nutzung von Arten (und höheren Abstammungslinien) über Biome hinweg innerhalb verschiedener biogeografischer Reiche, jedoch größtenteils nicht zwischen diesen, könnte dazu dienen, die funktionelle Vielfalt innerhalb der Reiche zu homogenisieren und Anhaltspunkte für die charakteristischen Merkmale zu liefern, für die bzw. gegen die in verschiedenen Umgebungen selektiert wird (Douma et al., 2012; Zanne et al., 2014, 2018).
Trotz erheblicher Überlappung des Hypervolumens zwischen allen Biomen (ergänzende Abbildung 2) scheinen tropische, gemäßigte und kalte Biome alle unterscheidbare Regionen des funktionalen Raums zu besetzen (Abbildungen 5B und C). Die wichtigsten Merkmale, die die Biome voneinander unterscheiden, scheinen Merkmale zu sein, die mit der Gesamtgröße der Pflanze zusammenhängen, einschließlich der reifen Höhe und der Samenmasse (ergänzende Abbildungen 7-10), und nicht die Merkmale der Blattökonomie, wie sie in eher lokalen, parzellenbasierten Analysen beobachtet wurden (z. B. Douma et al., 2012). Die Ausnahme ist der Blatt-P-Wert, der erhebliche Unterschiede zwischen tropischen und gemäßigten/polaren Biomen aufwies (ergänzende Abbildungen 7-10), ein Muster, das auch in anderen Analysen beobachtet wurde, die sowohl auf artspezifischen Werten als auch auf Messungen des gesamten Ökosystems basierten (Kerkhoff et al., 2005; Swenson et al., 2012). Da der Blatt-P-Wert die am spärlichsten untersuchte Eigenschaft war, könnten die Unterschiede zwischen tropischen und gemäßigten/polaren Gebieten durch das Imputationsverfahren verzerrt sein. Blatt-P weist jedoch ein signifikantes phylogenetisches Signal auf (Kerkhoff et al., 2006), was darauf hindeutet, dass die Imputationen unverzerrt sein sollten (Swenson et al., 2017). Der Blatt-P-Wert ist auch bei krautigen Wuchsformen signifikant höher (Kerkhoff et al., 2006), so dass die Breitenverschiebung von vorwiegend holziger zu krautiger Vielfalt (Abbildung 4) dieses Muster ebenfalls beeinflussen könnte.
Wenn wir die Hypervolumen-Analysen auf die am weitesten verbreiteten und funktionell häufigen Arten in jedem Biom beschränkten, überlappten sich die einzelnen Biome innerhalb jedes biogeografischen Bereichs weniger im Raum der funktionellen Merkmale (vgl. Abbildungen 5B und C), was darauf hindeutet, dass diese Arten möglicherweise Phänotypen widerspiegeln, die besser an bestimmte Umgebungen angepasst sind. In diesem Zusammenhang ist das xerische Waldbiom besonders interessant. Zum Teil aufgrund der Einbeziehung der Chaco-Ökoregion sind die xerischen Wälder taxonomisch mit den tropischen Biomen geclustert (Abbildung 5A). Betrachtet man jedoch die funktionalen Hypervolumina aller Arten, so zeigt sich eine viel stärkere Ähnlichkeit mit den gemäßigten Biomen (Abb. 5B). Werden schließlich nur die am weitesten verbreiteten und funktionell häufigen Arten analysiert, zeigen xerische Wälder erneut eine größere Ähnlichkeit mit tropischen Biomen, aber auch eine hohe Ähnlichkeit mit gemäßigten Grasland- und mediterranen Biomen (Abbildung 5C). Übergänge von warmen, mesischen Umgebungen zu kälteren, trockeneren und saisonaleren Umgebungen werden durch ähnliche Merkmale erleichtert, z. B. krautiger Habitus (Douma et al., 2012; Zanne et al., 2014, 2018), und wie kältere Umgebungen neigen auch Gemeinschaften in trockenen Umgebungen dazu, phylogenetisch stärker geclustert zu sein (Qian und Sandel, 2017). Die Lage der Trockengebiete an der Grenze der intertropischen Konvergenzzone macht sie zudem zu einem geografischen Übergang zwischen den Tropen und den gemäßigten Zonen. Die Tatsache, dass xerische Wälder sowohl funktionell als auch biogeografisch zwischen den Tropen und den gemäßigten Zonen liegen, unterstreicht die Idee, dass wir zum besseren Verständnis der funktionellen Vielfalt von Biomen ihre biogeografische und phylogenetische Geschichte berücksichtigen müssen (Pennington et al., 2006; Donoghue und Edwards, 2014; Moncrieff et al, 2016).
Schlussfolgerungen
Jede Klassifizierung terrestrischer Biome zwingt eine kleine Anzahl diskreter Kategorien auf kontinuierliche Gradienten im Klima und in der Artenverteilung auf und stellt somit eine grobe Vereinfachung der komplexen ökologischen Landschaft dar (Moncrieff et al., 2016, aber siehe Silva de Miranda et al., 2018). Doch trotz ihres Potenzials für eine zu starke Vereinfachung sind Biome nützliche Konstrukte für die Organisation und das Verständnis der biologischen Vielfalt und der Funktionsweise der wichtigsten terrestrischen Ökosysteme der Erde, und eigenschaftsbasierte Ansätze haben ein hohes Potenzial, bei der dynamischen Modellierung der globalen Vegetationsverteilung zu helfen.
In dieser Studie haben wir gezeigt, dass ein Großteil der taxonomischen Vielfalt aller Biome Arten repräsentiert, die sowohl eng verteilt als auch funktional ähnlich sind. Darüber hinaus sind innerhalb der Biome die Arten, die sich funktionell am stärksten unterscheiden, tendenziell auch geografisch selten, während weit verbreitete Arten einheitlich eine geringe funktionelle Besonderheit aufweisen. Trotz umfangreicher taxonomischer und funktioneller Überschneidungen zwischen den Biomen gruppieren sie sich in unterscheidbare, biogeografisch und klimatisch unterschiedliche Einheiten, insbesondere wenn die funktionelle Gruppierung auf den am weitesten verbreiteten und funktionell häufigen Arten in jedem Biom basiert. Für ein besseres funktionales Verständnis von Biomen ist jedoch nicht nur eine bessere Charakterisierung der Merkmalsvariation innerhalb und zwischen Vegetationstypen erforderlich, sondern auch Informationen über die biogeografische und phylogenetische Geschichte von Artengemeinschaften und die relative Häufigkeit von Arten innerhalb von Biomen.
Datenverfügbarkeit
Die für diese Studie analysierten Merkmalsdatensätze und Karten der Artenvielfalt können über das R-Paket BIEN (Maitner et al., 2018) heruntergeladen werden. Siehe http://bien.nceas.ucsb.edu/bien/ für weitere Details über die BIEN-Datenbank.
Beiträge der Autoren
SE-L, AK, BJE, DMN und CV entwarfen die Studie; SE-L und AK analysierten die Daten; SE-L und AK schrieben die erste Version des Manuskripts; CV, BB, NK, BSM, BM, RKP, BS, SS, J-CS und SKW trugen zur Zusammenstellung und Erstellung der Datenbank für Merkmale und Verbreitungskarten bei. Alle Autoren trugen zur Entwicklung und Abfassung des Manuskripts bei.
Finanzierung
SE-L, DMN und AK wurden durch ein gemeinsames Forschungsstipendium der US National Science Foundation (DEB-1556651) unterstützt. BJE wurde von der National Science Foundation mit DEB-1457812 und Macrosystems-1065861 unterstützt. CV wurde vom Europäischen Forschungsrat (Grant ERC-StG-2014-639706-CONSTRAINTS) und von der französischen Stiftung für die Erforschung der Biodiversität (FRB; www.fondationbiodiversite.fr) im Rahmen des CESAB-Projekts Causes and consequences of functional rarity from local to global scales unterstützt. J-CS betrachtet diese Arbeit als einen Beitrag zu seinem VILLUM-Forschungsprojekt Biodiversity Dynamics in a Changing World, das vom VILLUM FONDEN (Zuschuss 16549) finanziert wird. SKW wurde vom Strategic Science Investment Fund der Science and Innovation Group des neuseeländischen Ministeriums für Wirtschaft, Innovation und Beschäftigung unterstützt.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken Dan Griffith und zwei Gutachtern für ihre konstruktive Kritik, die dieses Manuskript erheblich verbessert hat. Wir danken auch allen BIEN-Datenlieferanten (siehe http://bien.nceas.ucsb.edu/bien/Datenlieferanten/ für eine vollständige Liste).
Ergänzendes Material
Das ergänzende Material zu diesem Artikel ist online zu finden unter: https://www.frontiersin.org/articles/10.3389/fevo.2018.00219/full#supplementary-material
Banda, R.K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D., et al. (2016). Muster der Pflanzendiversität in neotropischen Trockenwäldern und ihre Bedeutung für den Naturschutz. Science 353, 1383-1387. doi: 10.1126/science.aaf5080
PubMed Abstract | CrossRef Full Text | Google Scholar
Blonder, B., Lamanna, C., Violle, C., and Enquist, B. J. (2014). The n-dimensional hypervolume. Glob. Ecol. Biogeogr. 23, 595-609. doi: 10.1111/geb.12146
CrossRef Full Text | Google Scholar
Blonder, B., Morrow, C. B., Maitner, B., Harris, D. J., Lamanna, C., Violle, C., et al. (2018). New approaches for delineating n-dimensional hypervolumes. Methods Ecol. Evol. 9, 305-319. doi: 10.1111/2041-210X.12865
CrossRef Full Text | Google Scholar
Bonan, G. B., Oleson, K. W., Fisher, R. A., Lasslop, G., and Reichstein, M. (2012). Reconciling leaf physiological traits and canopy flux data: use of the TRY and FLUXNET databases in the Community Land Model version 4. J. Geophys. Res. Biogeosci. 117:G02026. doi: 10.1029/2011JG001913
CrossRef Full Text | Google Scholar
Borregaard, M. K., and Rahbek, C. (2010). Kausalität der Beziehung zwischen geografischer Verbreitung und Artenreichtum. Q. Rev. Biol. 85, 3-25. doi: 10.1086/650265
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruggeman, J., Heringa, J., and Brandt, B. W. (2009). PhyloPars: Schätzung von fehlenden Parameterwerten anhand der Phylogenie. Nucleic Acids Res. 37, W179-W184. doi: 10.1093/nar/gkp370
PubMed Abstract | CrossRef Full Text | Google Scholar
Cadotte, M. W., Carscadden, K., and Mirotchnick, N. (2011). Jenseits der Arten: funktionale Vielfalt und die Aufrechterhaltung ökologischer Prozesse und Dienstleistungen. J. Appl. Ecol. 48, 1079-1087. doi: 10.1111/j.1365-2664.2011.02048.x
CrossRef Full Text | Google Scholar
Cornwell, W. K., Cornelissen, J. H., Amatangelo, K., Dorrepaal, E., Eviner, V. T., Godoy, O., et al. (2008). Merkmale der Pflanzenarten sind der wichtigste Faktor für die Zersetzungsrate von Streu in Biomen weltweit. Ecol. Lett. 11, 1065-1071. doi: 10.1111/j.1461-0248.2008.01219.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Craine, J. M. (2009). Resource Strategies of Wild Plants. New Jersey, NJ: Princeton University Press. doi: 10.1515/9781400830640
CrossRef Full Text | Google Scholar
Currie, D. J., Mittelbach, G. G., Cornell, H. V., Field, R., Guégan, J. F., Hawkins, B. A., et al. (2004). Vorhersagen und Tests von klimabasierten Hypothesen über breit angelegte Variationen im taxonomischen Reichtum. Ecol. Lett. 12, 1121-1134. doi: 10.1111/j.1461-0248.2004.00671.x
CrossRef Full Text | Google Scholar
de la Riva, E. G., Violle, C., Pérez-Ramos, I. M., Marañón, T., Navarro-Fernández, C. M., Olmo, M., et al. (2018). Ein multidimensionaler Ansatz für funktionale Merkmale offenbart die Auswirkungen von Umweltstress in mediterranen Gehölzgemeinschaften. Ecosystems 21, 248-262. doi: 10.1007/s10021-017-0147-7
CrossRef Full Text | Google Scholar
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S., Dray, S., et al. (2016). Das globale Spektrum der Pflanzenform und -funktion. Nature 529, 167-171. doi: 10.1038/nature16489
PubMed Abstract | CrossRef Full Text | Google Scholar
Díaz, S., Lavorel, S., de Bello, F., Quétier, F., Grigulis, K., and Robson, T. M. (2007). Einbeziehung der Auswirkungen der funktionalen Vielfalt von Pflanzen in die Bewertung von Ökosystemleistungen. Proc. Natl. Acad. Sci. U.S.A 104, 20684-20689. doi: 10.1073/pnas.0704716104
PubMed Abstract | CrossRef Full Text | Google Scholar
Donoghue, M. J., and Edwards, E. J. (2014). Biomverschiebungen und Nischenevolution bei Pflanzen. Annu. Rev. Ecol. Evol. Syst. 45, 547-572. doi: 10.1146/annurev-ecolsys-120213-091905
CrossRef Full Text | Google Scholar
Douma, J. C., Aerts, R., Witte, J. P. M., Bekker, R. M., Kunzmann, D., Metselaar, K., et al. (2012). Eine Kombination von funktional unterschiedlichen Pflanzenmerkmalen ermöglicht die quantitative Vorhersage eines breiten Spektrums von Artengemeinschaften in NW-Europa. Ecography 35, 364-373. doi: 10.1111/j.1600-0587.2011.07068.x
CrossRef Full Text | Google Scholar
Engemann, K., Sandel, B., Enquist, B. J., Jørgensen, P. M., Kraft, N., Marcuse-Kubitza, A., et al. (2016). Muster und Triebkräfte der Dominanz funktioneller Pflanzengruppen in der westlichen Hemisphäre: eine makroökologische Neubewertung auf der Grundlage eines umfangreichen botanischen Datensatzes. Bot. J. Linn. Soc. 180, 141-160. doi: 10.1111/boj.12362
CrossRef Full Text | Google Scholar
Enquist, B. J., Condit, R., Peet, R., Thiers, B., and Schildhauer, M. (2016). The botanical information and ecology network (BIEN): cyberinfrastructure for an integrated botanical information network to investigate the ecological impacts of global climate change on plant biodiversity. PeerJ Prepr. 4:e2615v2. doi: 10.7287/peerj.preprints.2615v2
CrossRef Full Text | Google Scholar
Garnier, E., Cortez, J., Billès, G., Navas, M. L., Roumet, C., Debussche, M., et al. (2004). Funktionelle Pflanzenmarker erfassen Ökosystemeigenschaften während der sekundären Sukzession. Ecology 85, 2630-2637. doi: 10.1890/03-0799
CrossRef Full Text | Google Scholar
Goldsmith, G. R., Morueta-Holme, N., Sandel, B., Fitz, E. D., Fitz, S. D., Boyle, B., et al. (2016). Plant-O-Matic: ein dynamischer und mobiler Führer zu allen Pflanzen Amerikas. Methods Ecol. Evol. 7, 960-965. doi: 10.1111/2041-210X.12548
CrossRef Full Text | Google Scholar
Goolsby, E. W., Bruggeman, J., and Ané, C. (2017). Rphylopars: schnelle multivariate phylogenetische Vergleichsmethoden für fehlende Daten und innerartliche Variation. Methods Ecol. Evol. 8, 22-27. doi: 10.1111/2041-210X.12612
CrossRef Full Text | Google Scholar
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F., and Violle, C. (2017). funrar: an R package to characterize functional rarity. Divers. Distrib. 23, 1365-1371. doi: 10.1111/ddi.12629
CrossRef Full Text | Google Scholar
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., and Ladle, R. J. (2015). Sieben Defizite, die das Wissen über die biologische Vielfalt in großem Maßstab beeinträchtigen. Annu. Rev. Ecol. Evol. Syst. 46, 523-549. doi: 10.1146/annurev-ecolsys-112414-054400
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Enquist, B. J., Elser, J. J., and Fagan, W. F. (2005). Pflanzenallometrie, Stöchiometrie und die Temperaturabhängigkeit der Primärproduktivität. Glob. Ecol. Biogeogr. 14, 585-598. doi: 10.1111/j.1466-822X.2005.00187.x
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Fagan, W. F., Elser, J. J., und Enquist, B. J. (2006). Phylogenetische und wachstumsbedingte Variation in der Skalierung von Stickstoff und Phosphor in den Samenpflanzen. Am. Nat. 168, E103-E122. doi: 10.1086/507879
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraft, N. J., Valencia, R., and Ackerly, D. D. (2008). Funktionale Merkmale und Nischen-basierte Baumgemeinschaft Montage in einem Amazonas-Wald. Science 322, 580-582. doi: 10.1126/science.1160662
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamanna, C., Blonder, B., Violle, C., Kraft, N. J., Sandel, B., et al. (2014). Functional trait space and the latitudinal diversity gradient. Proc. Natl. Acad. Sci. U.S.A. 111, 13745-13750. doi: 10.1073/pnas.1317722111
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavorel, S., and Garnier, E. (2002). Vorhersage von Veränderungen in der Zusammensetzung von Lebensgemeinschaften und der Funktionsweise von Ökosystemen anhand von Pflanzenmerkmalen: ein neuer Versuch, den Heiligen Gral zu finden. Funct. Ecol. 16, 545-556. doi: 10.1046/j.1365-2435.2002.00664.x
CrossRef Full Text | Google Scholar
Lavorel, S., Grigulis, K., Lamarque, P., Colace, M.-P., Garden, D., Girel, J., et al. (2011). Verwendung von funktionellen Pflanzenmerkmalen zum Verständnis der landschaftlichen Verteilung mehrerer Ökosystemleistungen. J. Ecol. 99, 135-147. doi: 10.1111/j.1365-2745.2010.01753.x
CrossRef Full Text | Google Scholar
Li, Y., Shipley, B., Price, J. N., Dantas, V. de L., Tamme, R., Westoby, M., et al. (2018). Habitat-Filterung bestimmt die funktionale Nischenbesetzung von Pflanzengemeinschaften weltweit. J. Ecol. 106, 1001-1009. doi: 10.1111/1365-2745.12802
CrossRef Full Text | Google Scholar
Magallón, S., Gómez-Acevedo, S., Sánchez-Reyes, L. L., und Hernández-Hernández, T. (2015). Ein metakalibrierter Zeitbaum dokumentiert den frühen Anstieg der phylogenetischen Vielfalt von Blütenpflanzen. New Phytol. 207, 437-453. doi: 10.1111/nph.13264
PubMed Abstract | CrossRef Full Text | Google Scholar
Maitner, B. S., Boyle, B., Casler, N., Condit, R., Donoghue, J., Durán, S. M., et al. (2018). The BIEN R package: a tool to access the botanical information and ecology network (BIEN) database. Methods Ecol. Evol. 9, 373-379. doi: 10.1111/2041-210X.12861
CrossRef Full Text | Google Scholar
Moncrieff, G. R., Bond, W. J., and Higgins, S. I. (2016). Überarbeitung des Biome-Konzepts zum Verständnis und zur Vorhersage der Auswirkungen des globalen Wandels. J. Biogeogr. 43, 863-873. doi: 10.1111/jbi.12701
CrossRef Full Text | Google Scholar
Novosolov, M., Rodda, G. H., North, A. C., Butchart, S. H. M., Tallowin, O. J. S., Gainsbury, A. M., et al. (2017). Population density-range size relationship revisited. Glob. Ecol. Biogeogr. 26, 1088-1097. doi: 10.1111/geb.12617
CrossRef Full Text | Google Scholar
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C., et al. (2001). Terrestrial Ecoregions of the world: a new map of life on earth: eine neue globale Karte der terrestrischen Ökoregionen bietet ein innovatives Instrument zur Erhaltung der biologischen Vielfalt. Bioscience 51, 933-938.doi: 10.1641/0006-3568(2001)0512.0.CO;2
CrossRef Full Text | Google Scholar
Pennington, R. T., Prado, D. E., and Pendry, C. A. (2000). Neotropische saisonale Trockenwälder und quartäre Vegetationsveränderungen. J. Biogeogr. 27, 261-273. doi: 10.1046/j.1365-2699.2000.00397.x
CrossRef Full Text | Google Scholar
Pennington, R. T., Richardson, J. E., und Lavin, M. (2006). Einblicke in den historischen Aufbau artenreicher Biome aus datierten Pflanzenphylogenien, neutraler ökologischer Theorie und phylogenetischer Gemeinschaftsstruktur. New Phytol. 172, 605-616. doi: 10.1111/j.1469-8137.2006.01902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Penone, C., Davidson, A. D., Shoemaker, K. T., Di Marco, M., Rondinini, C., Brooks, T. M., et al. (2014). Imputation fehlender Daten in Datensätzen mit lebensgeschichtlichen Merkmalen: Welcher Ansatz ist der beste? Methods Ecol. Evol. 5, 961-970. doi: 10.1111/2041-210X.12232
CrossRef Full Text | Google Scholar
Pillar, V. D., Blanco, C. C., Müller, S. C., Sosinski, E. E., Joner, F., und Duarte, L. D. S. (2013). Funktionale Redundanz und Stabilität in Pflanzengemeinschaften. J. Veg. Sci. 24, 963-974. doi: 10.1111/jvs.12047
CrossRef Full Text | Google Scholar
Prado, D. E., and Gibbs, P. E. (1993). Muster der Artenverteilungen in den trockenen saisonalen Wäldern Südamerikas. Ann. Mo. Bot. Gard. 80, 902-927. doi: 10.2307/2399937
CrossRef Full Text | Google Scholar
Qian, H., and Sandel, B. (2017). Phylogenetische Struktur regionaler Angiospermen-Assemblagen über Breitengrad- und Klimagradienten in Nordamerika. Glob. Ecol. Biogeogr. 26, 1258-1269. doi: 10.1111/geb.12634
CrossRef Full Text | Google Scholar
Reich, P. B., Wright, I. J., Cavender-Bares, J., Craine, J. M., Oleksyn, J., Westoby, M., et al. (2003). Die Evolution der funktionellen Variation von Pflanzen: Merkmale, Spektren und Strategien. Int. J. Plant Sci. 164, S143-S164. doi: 10.1086/374368
CrossRef Full Text | Google Scholar
Silva de Miranda, P. L., Oliveira-Filho, A., Pennington, R. T., Neves, D. M., Baker, T. R., and Dexter, K. G. (2018). Verwendung von Baumarteninventaren zur Kartierung von Biomen und zur Bewertung ihrer klimatischen Überlappungen im tropischen Tiefland Südamerikas. Glob. Ecol. Biogeogr. 27, 899-912. doi: 10.1111/geb.12749
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Kraft, N. J. B., Storch, D., Svenning, J.-C., Boyle, B., et al. (2015). Shifts in trait means and variances in North American tree assemblages: species richness patterns are loosely related to the functional space. Ecography 38, 649-658. doi: 10.1111/ecog.00867
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Svenning, J.-C., Kattge, J., Engemann, K., Sandel, B., et al. (2018). Räumliche Muster und klimatische Beziehungen wichtiger Pflanzeneigenschaften in der Neuen Welt unterscheiden sich zwischen holzigen und krautigen Arten. J. Biogeogr. 45, 895-916. doi: 10.1111/jbi.13171
CrossRef Full Text | Google Scholar
Smith, S. A., and Beaulieu, J. M. (2009). Life history influences rates of climatic niche evolution in flowering plants. Proc. Biol. Sci. 276, 4345-4352. doi: 10.1098/rspb.2009.1176
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., and Brown, J. W. (2018). Constructing a broadly inclusive seed plant phylogeny. Am. J. Bot. 105, 302-314. doi: 10.1002/ajb2.1019
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., and Donoghue, M. J. (2008). Molekulare Evolutionsraten sind mit der Lebensgeschichte blühender Pflanzen verbunden. Science 322, 86-89. doi: 10.1126/science.1163197
PubMed Abstract | CrossRef Full Text | Google Scholar
Swenson, N. G. (2014). Phylogenetic imputation of plant functional trait databases.Ecography 37, 105-110. doi: 10.1111/j.1600-0587.2013.00528.x
CrossRef Full Text
Swenson, N. G., Enquist, B. J., Pither, J., Kerkhoff, A. J., Boyle, B., Weiser, M. D., et al. (2012). Die Biogeographie und Filterung der funktionellen Vielfalt von Gehölzen in Nord- und Südamerika. Glob. Ecol. Biogeogr. 21, 798-808. doi: 10.1111/j.1466-8238.2011.00727.x
CrossRef Full Text | Google Scholar
Swenson, N. G., Weiser, M. D., Mao, L., Araújo, M. B., Diniz-Filho, J. A. F., Kollmann, J., et al. (2017). Phylogenie und die Vorhersage der funktionalen Vielfalt von Bäumen in neuen kontinentalen Umgebungen. Glob. Ecol. Biogeogr. 26, 553-562. doi: 10.1111/geb.12559
CrossRef Full Text | Google Scholar
Umaña, M. N., Mi, X., Cao, M., Enquist, B. J., Hao, Z., Howe, R., et al. (2017). Die Rolle von funktionaler Einzigartigkeit und räumlicher Aggregation bei der Erklärung von Seltenheit bei Bäumen. Glob. Ecol. Biogeogr. 26, 777-786. doi: 10.1111/geb.12583
CrossRef Full Text | Google Scholar
van Bodegom, P. M., Douma, J. C., and Verheijen, L. M. (2014). A fully traits-based approach to modelling global vegetation distribution. Proc. Natl. Acad. Sci. U.S.A. 111, 13733-13738. doi: 10.1073/pnas.1304551110
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Reich, P. B., Pacala, S. W., Enquist, B. J., and Kattge, J. (2014). Die Entstehung und das Versprechen der funktionalen Biogeographie. Proc. Natl. Acad. Sci. U.S.A. 111, 13690-13696. doi: 10.1073/pnas.1415442111
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W., et al. (2017). Funktionale Seltenheit: die Ökologie der Ausreißer. Trends Ecol. Evol. 32, 356-367. doi: 10.1016/j.tree.2017.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, B., Kinzig, A., and Langridge, J. (1999). Diversität von Pflanzenmerkmalen, Widerstandsfähigkeit und Funktion von Ökosystemen: Art und Bedeutung von dominanten und weniger wichtigen Arten. Ecosystems 2, 95-113. doi: 10.1007/s100219900062
CrossRef Full Text | Google Scholar
Westoby, M. (1998). Ein Blatt-Höhe-Samen (LHS) Pflanzenökologie-Strategie-Schema. Plant Soil 199, 213-227. doi: 10.1023/A:1004327224729
CrossRef Full Text | Google Scholar
Woodward, F. I., Lomas, M. R., and Kelly, C. K. (2004). Das globale Klima und die Verteilung der Pflanzenbiome. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 359, 1465-1476. doi: 10.1098/rstb.2004.1525
PubMed Abstract | CrossRef Full Text | Google Scholar
Wright, I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Baruch, Z., Bongers, F., et al. (2004). Das weltweite Spektrum der Blattökonomie. Nature 428, 821-827. doi: 10.1038/nature02403
PubMed Abstract | CrossRef Full Text | Google Scholar
Xia, J., Niu, S., Ciais, P., Janssens, I. A., Chen, J., Ammann, C., et al. (2015). Gemeinsame Kontrolle der terrestrischen Bruttoprimärproduktivität durch die Phänologie und Physiologie von Pflanzen. Proc. Natl. Acad. Sci. U.S.A. 112, 2788-2793. doi: 10.1073/pnas.1413090112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Pearse, W. D., Cornwell, W. K., McGlinn, D. J., Wright, I. J., and Uyeda, J. C. (2018). Funktionale Biogeographie der Angiospermen: Leben in den Extremen. New Phytol. 218, 1697-1709. doi: 10.1111/nph.15114
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Tank, D. C., Cornwell, W. K., Eastman, J. M., Smith, S. A., FitzJohn, R. G., et al. (2014). Drei Schlüssel zur Ausbreitung von Angiospermen in eisigen Umgebungen. Nature 506, 89-92. doi: 10.1038/nature12872
PubMed Abstract | CrossRef Full Text | Google Scholar