Introduction
Amyotrophe Lateralsklerose (ALS) ist eine fortschreitende Erkrankung, die durch die Beteiligung der oberen und unteren Motoneuronen (UMNs und LMNs) gekennzeichnet ist. Bei ALS betrifft der Muskelschwund vorzugsweise den Abductor pollicis brevis (APB) und den ersten dorsalen Interossus, während der Abductor digiti minimi (ADM) relativ gut erhalten bleibt. Dieses spezifische Merkmal der ALS wurde als “Split-Hand”-Zeichen bezeichnet (Wilbourn, 2000). Im Allgemeinen ist das Ausmaß des Verlustes an motorischen Einheiten bei ALS-Patienten in der APB deutlich größer als in der ADM (Kuwabara et al., 1999). Es wird angenommen, dass sowohl kortikale als auch periphere Mechanismen dem unterschiedlichen Ausmaß der Atrophie der kleinen Handmuskeln bei ALS zugrunde liegen (Weber et al., 2000; Shibuya et al., 2013). Die Ergebnisse von Studien zur transkraniellen Magnetstimulation haben gezeigt, dass der kortikomotoneuronale Input zu den spinalen Motoneuronen, die den Thenar-Komplex innervieren, bei normalen Teilnehmern umfangreicher ist (Macdonell et al., 1999; Menon et al., 2014). Ein solcher Unterschied im Input könnte dazu führen, dass diese spinalen Motoneuronen bei ALS durch einen transsynaptischen anterograden exzitotoxischen Mechanismus bevorzugt degenerieren. Kortikomotoneuronale Projektionen zum Thenarkomplex sind bei ALS bevorzugt betroffen, was darauf hindeutet, dass eine kortikomotoneuronale Dysfunktion zum Split-Hand-Zeichen bei ALS beiträgt (Weber et al., 2000). Studien zur Erregbarkeit peripherer Nerven haben ergeben, dass die Motoneuronen-Axone, die die APB innervieren, bei ALS übererregbar und anfällig für Degeneration sind (Vucic und Kiernan, 2010; Shibuya et al., 2013). Bislang gibt es jedoch nur wenige Studien, die die Dysfunktion oder Erregbarkeit von Motoneuronen, die die APB und ADM innervieren, direkt verglichen haben. Die F-Welle ist eine späte Antwort mit geringer Amplitude, die die antidromische Aktivierung von Motoneuronen widerspiegelt (Pastore-Olmedo et al., 2009). F-Wellen können ein unabhängiges Maß für die segmentale Motoneuronenerregbarkeit darstellen (Fisher, 1992; Milanov, 1992; Hachisuka et al., 2015). Das primäre Ziel dieser Studie war es, die Unterschiede in der Dysfunktion zwischen spinalen Motoneuronen, die die APB und ADM bei ALS innervieren, mit Hilfe von F-Wellen zu untersuchen.
Materialien und Methoden
Teilnehmer
Wir untersuchten 40 Patienten mit sporadischer ALS und 20 alters- und geschlechtsgematchte normale Teilnehmer. Alle Patienten wurden zwischen August 2013 und Juni 2014 in der Abteilung für Neurologie des Peking Union Medical College Hospital untersucht. Die ALS-Patienten, die die modifizierten El-Escorial-Kriterien für definitive, wahrscheinliche oder wahrscheinliche laborgestützte ALS (Brooks et al., 2000) erfüllten, wurden nacheinander in die Studie aufgenommen. Bei diesen Patienten wurden verschiedene elektrophysiologische Untersuchungen und klinische Merkmale, wie z. B. das Alter bei der Aufnahme in die Studie und die Zeit seit dem Auftreten der Symptome, analysiert. Bei keinem der ALS-Patienten wurde eine genetische Mutation festgestellt. Eine UMN-Beteiligung in den oberen Gliedmaßen wurde durch das Vorhandensein von Klonus, erhöhtem Tonus, lebhaften Sehnenreflexen und positiven Hoffman-Zeichen nahegelegt. Die ALS-Patienten wurden auf der Grundlage ihrer körperlichen Symptome zwei Gruppen zugeteilt. Die Patienten der Gruppe 1 (20 ALS-Patienten) wiesen einen Schwund und eine Schwäche der intrinsischen Handmuskeln auf. Die Patienten der Gruppe 2 (20 ALS-Patienten) wiesen keinen Schwund oder keine Schwäche der intrinsischen Handmuskulatur auf und zeigten entweder keine oder eine leichte Beeinträchtigung der einzelnen Fingerbewegungen. Bei den ALS-Patienten der Gruppe 1 wurden die Daten für die stärker beeinträchtigte Hand analysiert, bei den ALS-Patienten der Gruppe 2 die Daten für die intaktere Hand. Die Daten für die linke Hand wurden für die normalen Kontrollen (NCs) analysiert. Die ALS-Patienten wurden anhand der ALS functional rating scale-revised (ALSFRS-R; Cedarbaum et al., 1999) klinisch eingestuft und nach dem Ort des Krankheitsbeginns kategorisiert. Die elektrodiagnostischen Merkmale aller ALS-Patienten stimmten mit einer diffusen und fortschreitenden Degeneration der Vorderhornzellen überein. Zum Zeitpunkt der Untersuchung nahm keiner der Patienten Riluzol oder andere Antispastika ein. Teilnehmer mit einem zufälligen Karpaltunnel- oder Kubitaltunnelsyndrom wurden aufgrund der klinischen Untersuchung und der Nervenleitfähigkeitsstudien ausgeschlossen. Alle Probanden gaben ihre schriftliche Einwilligung zur Teilnahme an der Untersuchung. Die Studie wurde von der Ethikkommission für klinische Forschung des Peking Union Medical College Hospital (Peking, China) genehmigt, und alle Verfahren wurden in Übereinstimmung mit der Deklaration von Helsinki durchgeführt.
Nervenleitungsstudie
Die elektrophysiologischen Tests wurden mit einem Viking IV Elektromyographie (EEG) System (Nicolet Biomedical, Madison, WI, USA) durchgeführt. Compound muscle action potentials (CMAPs) wurden von den APB- und ADM-Muskeln nach Stimulation des Nervus medianus oder ulnaris am Handgelenk aufgezeichnet. Die Hauttemperatur an den untersuchten Gliedmaßen wurde auf >32°C gehalten. Gemessen wurden die distale motorische Latenz (DML), die Peak-to-Peak-CMAP-Amplitude, die motorische Leitungsgeschwindigkeit (MCV) und das ADM/APB-CMAP-Amplitudenverhältnis.
F-Wellen-Studie
Alle Probanden befanden sich während der Versuche in Rückenlage und waren entspannt. Die F-Wellen der Median- und Ulnarisnerven wurden mit Oberflächenelektroden aufgezeichnet, die über den APB- und ADM-Muskeln auf der Haut angebracht wurden. Die untersuchten Nerven wurden stimuliert, indem 100 supramaximale Reize mit einer Frequenz von 1 Hz an einer Stelle abgegeben wurden, die 7 cm proximal zur aktiven Aufzeichnungselektrode lag, wobei die Kathode proximal zur Anode lag. Insgesamt 100 Stimuli wurden als angemessen angesehen, um das gesamte Potenzial der F-Wellen zu erforschen (Fisher et al., 1994). Die Filtereinstellungen betrugen 20 Hz bis 10 kHz, die Sweep-Geschwindigkeit betrug 5 ms pro Teilung und die Verstärkung des Verstärkers 0,5 mV pro Teilung. A-Wellen, die als identische späte Antworten mit konstanten Latenzen definiert waren und in mindestens 8 von 20 Spuren auftraten, wurden von der F-Wellen-Studie ausgeschlossen (Puksa et al., 2003). Die folgenden F-Wellen-Parameter wurden analysiert: minimale Latenz, mittlere Latenz, maximale Latenz, Persistenz der F-Wellen, mittlere Amplitude, mittleres F/M-Amplitudenverhältnis und Anzahl der F-Wellen-Wiederholungen. Die Peak-to-Peak-Amplitude einer F-Welle wurde gemessen, wenn die Amplitude mindestens 40 μV betrug. Das mittlere F/M-Amplitudenverhältnis wurde berechnet, indem die mittlere F-Wellen-Amplitude durch die entsprechende maximale CMAP-Amplitude geteilt wurde. Ein repetierendes Neuron (RN) war ein Neuron, das eine Reihe von F-Wellen mit identischen Latenzen, Amplituden und Formen erzeugte, und diese F-Wellen wurden als repetierende F-Wellen definiert. RNs und Repeater-F-Wellen wurden durch visuelle Inspektion erkannt und manuell mit den anderen Repeater-F-Wellen überlagert. Die Wiederholer-F-Wellen wurden mit den folgenden Indizes gemessen: Index RN = 100 × Anzahl der RN/Anzahl der Spuren mit unterschiedlichen F-Wellenformen in einer Serie von 100 Stimuli; Index Wiederholer-F-Wellen (Freps) = 100 × Anzahl der Wiederholer-F-Wellen/Gesamtzahl der Spuren mit F-Wellen im selben Nerv (Chroni et al., 2012).
Statistische Analysen
Der Shapiro-Wilk-Test wurde zur Beurteilung der Normalität der Daten verwendet. Wenn der P-Wert in der Varianzanalyse Signifikanz erreichte, wurde der Student-Newman-Keuls-Test durchgeführt. Der t-Test für unabhängige Stichproben wurde zur Bewertung der Unterschiede zwischen zwei Gruppen verwendet. Bei nicht-parametrischen Daten wurden Vergleiche zwischen Gruppen mit dem Kruskal-Wallis-H-Test durchgeführt. Sobald die Nullhypothese verworfen wurde, wurden paarweise Vergleiche der Gruppen mit dem Mann-Whitney-U-Test und Bonferroni-Korrektur mit einem Signifikanzniveau von P < 0,017 getestet. Die Unterschiede bei kategorialen Variablen wurden mit dem Chi-Quadrat-Test untersucht. Die statistische Signifikanz wurde auf P < 0,05 festgelegt. Zur Durchführung der statistischen Analysen wurde SPSS für Windows, Version 21.0 (SPSS, Inc., Chicago, IL, USA), verwendet.
Ergebnisse
Die klinischen Profile der ALS-Patienten und der NC-Teilnehmer sind in Tabelle 1 zusammengefasst. Alle ALS-Patienten waren klinisch LMN-prädominant. Das Alter bei der Untersuchung, das Geschlechterverhältnis und die Körpergröße waren in den drei Gruppen vergleichbar. Unter den ALS-Patienten machte die Erkrankung der oberen Gliedmaßen 70 % der Patienten in Gruppe 1 und 25 % der Patienten in Gruppe 2 aus. 11 ALS-Patienten in Gruppe 1 und 10 in Gruppe 2 hatten zwei betroffene Körperregionen, und es gab 9 generalisierte Patienten in Gruppe 1 und 10 in Gruppe 2. Die Krankheitsdauer und die ALSFRS-R-Scores unterschieden sich nicht signifikant zwischen den ALS-Patienten in den Gruppen 1 und 2.

Tabelle 1. Klinische Profile der Teilnehmer.
Tabelle 2 zeigt die Ergebnisse der Nervenleitfähigkeitsstudie für die ALS-Patienten und die NCs. Das ADM/APB CMAP-Amplitudenverhältnis war bei den ALS-Patienten in Gruppe 1 im Vergleich zur NC-Gruppe signifikant erhöht, was konsistent mit dem Split-Hand-Zeichen bei ALS-Patienten beobachtet wurde (Kuwabara et al., 2008). Die Ergebnisse der F-Wellen-Studie für die ALS-Patienten und NCs sind in Tabelle 3 dargestellt. Die mittlere F-Wellen-Amplitude für die APB war in Gruppe 1 signifikant niedriger als in Gruppe 2, wobei die Amplituden von Gruppe 2 und den NCs vergleichbar waren. Die mittleren F-Wellen-Amplituden der ADM in den Gruppen 1 und 2 waren im Vergleich zu denen der NKS signifikant erhöht. Die F/M-Amplitudenverhältnisse von APB und ADM waren in Gruppe 1 signifikant höher als in Gruppe 2 und den NCs, während Gruppe 2 und NCs ähnliche F/M-Amplitudenverhältnisse aufwiesen. Die F-Wellen-Persistenz der APB, die bei den ALS-Patienten signifikant niedriger war als bei den NCs, war in den Gruppen 1 und 2 vergleichbar. Die F-Wellen-Persistenz der ADM war in Gruppe 1 signifikant geringer als in Gruppe 2 und den NCs, während die F-Wellen-Persistenz der ADM in Gruppe 2 und den NCs ähnlich war. Der Index RN und der Index Freps der APB waren in den Gruppen 1 und 2 im Vergleich zu den NCs signifikant erhöht, aber diese Indizes waren zwischen den Gruppen 1 und 2 vergleichbar. Der Index RN und der Index Freps des ADM war in Gruppe 1 signifikant höher als in Gruppe 2 und den NCs, während Gruppe 2 und NCs ähnliche Werte für diese Indizes aufwiesen. Abbildung 1 zeigt repräsentative Beispiele von F-Wellen-Kurven für den Median- und den Ulnarisnerv, die von ALS-Patienten der Gruppen 1, 2 und NCs aufgezeichnet wurden.

Tabelle 2. Ergebnisse der Nervenleitfähigkeitsstudie.

Table 3. F-Wellen-Studie bei den ALS-Patienten und den normalen Kontrollen.

Abbildung 1. Repräsentative Beispiele von F-Wellen, die von Patienten mit amyotropher Lateralsklerose (ALS) und normalen Kontrollpersonen aufgezeichnet wurden (NCs). (A) F-Wellen, die von einer Hand eines ALS-Patienten aufgezeichnet wurden, die Schwund und Schwäche zeigt. Bei den F-Wellen, die sowohl vom Median- als auch vom Ulnarisnerv aufgezeichnet wurden, wurden eine verringerte F-Wellen-Persistenz und eine erhöhte Anzahl von F-Wellen-Wiederholungen beobachtet. (B) F-Wellen, die von einer Hand eines ALS-Patienten ohne nachweisbaren Schwund oder Schwäche aufgezeichnet wurden. Die F-Wellen-Persistenz war reduziert und die Anzahl der F-Wellen-Wiederholungen am Nervus medianus erhöht, während die Parameter der vom Nervus ulnaris aufgezeichneten F-Wellen relativ normal waren. (C) F-Wellen, die bei einer gesunden Person an der linken oberen Extremität aufgezeichnet wurden. F-Wellen-Amplituden, -Latenzen und -Wellenformen waren variabel, und die F-Wellen-Persistenz war sowohl am Nervus medianus als auch am Nervus ulnaris normal. Die Buchstaben auf der rechten Seite der Aufzeichnung kennzeichnen die F-Wellen-Wiederholungen auf der Grundlage von Amplitude, Latenz und Wellenform. Die Kalibrierungen sind 0,5 mV und 5 ms für die Aufzeichnung der F-Welle.
Tabelle 4 zeigt die diagnostische Leistung der F-Welle bei ALS im Vergleich zu NCs. Die F-Welle könnte zur Unterscheidung von ALS-Patienten und NCs verwendet werden. Der Index RN und der Index Freps der APB schienen zuverlässige Variablen für die Unterscheidung von ALS-Patienten und NCs zu sein, da die Fläche unter der Kurve (AUC) für den Index RN (0,998, 95% Konfidenzintervall (CI) 0,937-1,000) und den Index Freps (1,000, 95% CI 0,940-1,000) einen “sehr guten” diagnostischen Nutzen zeigte. Die übrigen F-Wellen-Variablen wiesen niedrigere AUC-Werte auf als der Index RN und der Index Freps des APB und zeigten daher einen geringeren diagnostischen Nutzen. Das ADM/APB CMAP-Amplitudenverhältnis zeigte eine AUC von 0,766 (95% CI 0,638-0,865, P < 0,001) und konnte ALS-Patienten mäßig von NCs unterscheiden. Die Verwendung eines Cut-off-Werts von ADM/APB > 1,7 (Kim et al., 2015) zur Diagnose von ALS ergab eine mäßige Sensitivität (52,5 %) und eine hohe Spezifität (85,0 %) im Vergleich zu Kontrollen. Die F-Wellen-Persistenz (P = 0,002), der Index RN (P < 0,001) und der Index Freps (P < 0,001) im APB schienen ALS-Patienten robuster von NCs zu unterscheiden als das ADM/APB-CMAP-Amplitudenverhältnis.
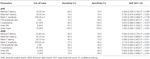
Tabelle 4. Diagnostische Leistung der F-Welle bei amyotropher Lateralsklerose (ALS) im Vergleich zu normalen Kontrollen (NCs).
Diskussion
Das primäre Ziel dieser Studie war es, F-Wellen-Messungen zu verwenden, um die Unterschiede in der Dysfunktion zwischen APB- und ADM-Motoneuronen bei Patienten mit ALS festzustellen. Nach einem vorgeschlagenen Staging-System für ALS (Roche et al., 2012) waren die Krankheitsstadien zwischen den Gruppen 1 und 2 vergleichbar. Der Unterschied im Prozentsatz des Auftretens der oberen Gliedmaßen zwischen den Gruppen 1 und 2 könnte auf ein unterschiedliches Muster des Krankheitsverlaufs zwischen den beiden Gruppen zurückzuführen sein. Die geschätzte Anzahl der motorischen Einheiten und die CMAP-Amplituden sind nützliche Parameter für die Bewertung des Verlusts von Motoneuronen, während die F-Welle ein direkter Indikator für eine Funktionsstörung oder Instabilität der vorderen Hornzellen sein kann (Hachisuka et al., 2015). Die Persistenz der F-Welle hängt mit der Anzahl der LMNs und der Erregbarkeit der Motoneuronen zusammen (Schiller und Stalberg, 1978; de Carvalho et al., 2002; Argyriou et al., 2006). Die vorgeschlagenen Mechanismen, die den wiederholten F-Wellen zugrunde liegen, sind eine erhöhte Erregbarkeit in bestimmten vorderen Hornzellen, eine verringerte Erregbarkeit in einigen Motoneuronen oder der Verlust von Motoneuronen (Schiller und Stalberg, 1978; Petajan, 1985; Peioglou-Harmoussi et al., 1987; Hachisuka et al., 2015). Wenn Motoneuronen verloren gehen, können wiederholte F-Wellen von einzelnen Motoneuronen leichter erkannt werden; es wurde jedoch argumentiert, dass die geringe Häufigkeit des Backfiring einzelner Motoneuronen diesen Mechanismus eher unwahrscheinlich macht (Chroni et al., 2012). Physiologisch gesehen gab es signifikante Unterschiede in der F-Wellen-Persistenz und der Anzahl der wiederholten F-Wellen zwischen APB und ADM. Diese Befunde könnten mit einer geringeren Anzahl funktioneller Motoneuronen, die die APB innervieren (Gooch et al., 2014), oder einer verstärkten kortikalen inhibitorischen Modulation der APB (Menon et al., 2014) zusammenhängen.
Bei ALS entwickelt sich die Dysfunktion der spinalen Motoneuronen allmählich vor dem Auftreten offener Symptome (Bradley, 1987). In der vorliegenden Studie zeigten die ALS-Patienten, die keine nachweisbare Auszehrung oder Schwäche in den Händen aufwiesen, eine signifikant reduzierte F-Wellen-Persistenz und höhere Werte für den Index RN und den Index Freps für die APB im Vergleich zu den NCs. Außerdem zeigten diese ALS-Patienten relativ normale F-Wellen-Werte im ADM. Diese Daten stehen im Einklang mit einer bevorzugten Dysfunktion der spinalen Motoneuronen, die die APB bei ALS innervieren (Baumann et al., 2012). Bei ALS können die spinalen Motoneuronen, die die APB innervieren, jedoch aktiver sein als diejenigen, die die ADM innervieren, und die CMAP-Amplitude ist möglicherweise nicht empfindlich genug, um den Verlust von Motoneuronen zu erkennen, da die verbleibenden Motoneuronen eine kompensatorische kollaterale Reinnervation denervierter Muskelfasern bieten können (van Dijk et al., 2010). Die Analyse der F-Wellen, insbesondere der F-Wellen in den Median-Nerven, könnte dazu beitragen, subtile Veränderungen der Vorderhornzellen auch bei ALS-Patienten ohne klinische Symptome zu erkennen, und somit einen hilfreichen Ansatz für die Bewertung des Krankheitsverlaufs darstellen.
LMN-Schäden reduzieren nachweislich die Amplitude der F-Wellen (Fisher, 1992). Muskelatrophie kann zu einer schwächeren Muskelreaktion führen, indem sie die Hyperexzitabilität des Motoneuronenpools teilweise neutralisiert (Drory et al., 1993). In der vorliegenden Studie zeigten die ALS-Patienten, die das Split-Hand-Zeichen aufwiesen, signifikant reduzierte F-Wellen-Amplituden, reduzierte F-Wellen-Persistenz und eine erhöhte Anzahl von F-Wellen-Wiederholungen in der APB im Vergleich zur ADM, was wahrscheinlich eine schwerere Schädigung der spinalen Motoneuronen widerspiegelt, die die APB innervieren. Die Bildung großer motorischer Einheiten nach der Reinnervation könnte zu einem Anstieg der F-Wellen-Amplitude beitragen (Drory et al., 2001). Eine signifikant erhöhte F-Wellen-Amplitude in der ADM im Vergleich zur APB bei den ALS-Patienten steht im Einklang mit einem langsameren Motoneuronenverlust im ADM-Motoneuronenpool (Baumann et al., 2012). Das F/M-Amplitudenverhältnis quantifiziert den Anteil des Motoneuronenpools, der während einer Serie von F-Wellen aktiviert wird (Drory et al., 2001). Das signifikant erhöhte F/M-Amplitudenverhältnis in der APB im Vergleich zur ADM von ALS-Patienten spiegelt eine erhöhte Tendenz der Motoneuronen wider, die die APB innervieren, F-Wellen zu erzeugen. Umgekehrt unterstreicht die Kombination aus der verringerten mittleren F-Wellen-Amplitude und dem erhöhten F/M-Amplitudenverhältnis in der APB die bevorzugte Beteiligung der APB bei ALS. Wiederholte F-Wellen weisen auf pathologische Veränderungen in motorischen Einheiten hin (Hachisuka et al., 2015). Die signifikante Zunahme der Anzahl von Repeater-F-Wellen in der APB kann auf eine größere Übererregbarkeit der spinalen Motoneuronen hindeuten, die die APB innervieren (Fang et al., 2015).
Interessanterweise zeigten ALS-Patienten, die keine nachweisbare Handmuskelatrophie aufwiesen, eine mittlere F-Wellen-Amplitude für die APB, die signifikant höher war als die der ALS-Patienten, die das Split-Hand-Zeichen zeigten. Die mittlere F-Wellen-Amplitude für die ADM war jedoch zwischen den beiden ALS-Patientengruppen vergleichbar, unabhängig von der Handmuskelatrophie, aber bei den ALS-Patienten signifikant höher als bei den NCs. Die Unterschiede in den F-Wellen-Charakteristika zwischen APB und ADM können auf die konkurrierenden Effekte von Degeneration und Regeneration innerhalb der motorischen Einheit zurückgeführt werden. Die Degeneration der Motoneuronen wird durch die überlebenden Motoneuronen kompensiert, indem sie die denervierten Muskelfasern durch axonale Sprossung reinnervieren (Ibrahim und el-Abd, 1997). Bei ALS beginnt der Denervierungsprozess möglicherweise früher und schreitet in der Thenarregion schneller voran. Die Degenerationsrate war bei den Motoneuronen, die die ADM innervieren, langsamer als bei denen, die die APB innervieren. Weitere Studien sind notwendig, um die Mechanismen bei ALS zu klären, die zu den Unterschieden in der Motoneuronen-Dysfunktion zwischen den Motoneuronen, die die APB und die ADM innervieren, beitragen. Wir vermuteten, dass kortikale Mechanismen, periphere axonale Mechanismen oder eine segmentale Dysfunktion der Wirbelsäule, insbesondere in den spinalen inhibitorischen Schaltkreisen, zur bevorzugten Degeneration der spinalen Motoneuronen, die die APB innervieren, beitragen könnten (Turner und Kiernan, 2012; Ramírez-Jarquín et al., 2014).
Vorangegangene Forschungen haben gezeigt, dass das Split-Hand-Zeichen bei ALS häufiger zu beobachten ist und das erhöhte ADM/APB-CMAP-Amplitudenverhältnis nahezu spezifisch für ALS ist. Die vorliegende Studie zeigte, dass das neurophysiologische Kriterium für ADM/APB, ein CMAP-Amplitudenverhältnis >1,7 (Kuwabara et al., 2008), eine mäßige Sensitivität und eine hohe Spezifität bei der Unterscheidung von ALS und NCs aufweist, was mit früheren Studien übereinstimmt (Kim et al., 2015). In dieser Studie konnten die F-Wellen-Parameter dazu beitragen, ALS-Patienten zuverlässig von normalen Teilnehmern zu unterscheiden. Darüber hinaus konnten die F-Wellen-Persistenz, der Index RN und der Index Freps in der APB ALS-Patienten zuverlässig von den NCs unterscheiden, da diese Maße größere AUC-Werte aufwiesen als das ADM/APB CMAP-Amplitudenverhältnis.
Unsere Analyse hat mehrere Einschränkungen. Es handelt sich um eine Querschnittsstudie, in die eine relativ kleine Anzahl von Teilnehmern einbezogen wurde. Eine Folgestudie mit einer größeren Population ist notwendig, um das Ausmaß der mit dem Split-Hand-Zeichen verbundenen Wirbelsäulenfunktionsstörung bei ALS genau zu bestimmen. Eine weitere potenzielle Einschränkung ist das Fehlen einer Patienten-Kontrollgruppe, die aus Patienten mit Syndromen besteht, die die ALS nachahmen. Eine solche Gruppe wäre nützlich, um den klinischen Wert der F-Welle bei der Unterscheidung von ALS und ALS-ähnlichen Erkrankungen zu beurteilen. Darüber hinaus sollten an denselben Patientengruppen weitere elektrophysiologische Studien durchgeführt werden, die Methoden zur Bewertung der UMN-Dysfunktion sowie der Erregbarkeit der motorischen Axone verwenden, um mehr Licht auf die Pathophysiologie dieses Phänomens zu werfen.
Zusammenfassend lässt sich sagen, dass unsere Ergebnisse Unterschiede in den F-Wellen-Charakteristika zwischen APB und ADM bei Patienten mit ALS zeigen. Diese Veränderungen in den F-Wellen sind charakteristisch für ALS-Patienten und könnten hilfreich sein, um ALS von bestimmten Erkrankungen zu unterscheiden, die ALS imitieren. Die Aufklärung der pathophysiologischen Mechanismen, die dem unterschiedlichen Ausmaß der Atrophie in den kleinen Handmuskeln zugrunde liegen, würde Licht auf die Pathogenese der ALS werfen.
Beiträge der Autoren
JF und LC: haben die Experimente konzipiert, durchgeführt und geplant. JF, LC, ML und YG: analysierten die Daten. ML, YG, XL, DL, BC, DS und QD: stellten Reagenzien/Materialien/Analysewerkzeuge zur Verfügung. JF und LC: trugen zum Verfassen des Manuskripts bei.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir möchten den ALS-Patienten und den gesunden Freiwilligen danken, die an dieser Studie teilgenommen haben.
Argyriou, A. A., Polychronopoulos, P., Talelli, P., und Chroni, E. (2006). F-Wellen-Studie bei amyotropher Lateralsklerose: Bewertung des Gleichgewichts zwischen der Beteiligung der oberen und unteren Motoneuronen. Clin. Neurophysiol. 117, 1260-1265. doi: 10.1016/j.clinph.2006.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baumann, F., Henderson, R. D., Gareth Ridall, P., Pettitt, A. N., and McCombe, P. A. (2012). Quantitative Studien zur Degeneration der unteren Motoneuronen bei amyotropher Lateralsklerose: Hinweise auf einen exponentiellen Verfall der Anzahl der motorischen Einheiten und die größte Verlustrate am Ort des Ausbruchs. Clin. Neurophysiol. 123, 2092-2098. doi: 10.1016/j.clinph.2012.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bradley, W. G. (1987). Neuere Ansichten zur amyotrophen Lateralsklerose mit Schwerpunkt auf elektrophysiologischen Studien. Muscle Nerve 10, 490-502. doi: 10.1002/mus.880100603
PubMed Abstract | CrossRef Full Text | Google Scholar
Brooks, B. R., Miller, R. G., Swash, M., und Munsat, T. L. (2000). El Escorial revisited – Überarbeitete Kriterien für die Diagnose der amyotrophen Lateralsklerose. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 1, 293-299. doi: 10.1080/146608200300079536
PubMed Abstract |Ref Full Text | Google Scholar
Cedarbaum, J. M., Stambler, N., Malta, E., Fuller, C., Hilt, D., Thurmond, B., et al. (1999). Die ALSFRS-R – eine überarbeitete ALS-Funktionsbewertungsskala, die die Bewertung der Atemfunktion einschließt. J. Neurol. Sci. 169, 13-21. doi: 10.1016/s0022-510x(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Chroni, E., Tendero, I. S., Punga, A. R., und Stålberg, E. (2012). Nützlichkeit der Bewertung von Wiederholungs-F-Wellen in Routinestudien. Muscle Nerve 45, 477-485. doi: 10.1002/mus.22333
PubMed Abstract | CrossRef Full Text | Google Scholar
de Carvalho, M., Scotto, M., Lopes, A., and Swash, M. (2002). F-Wellen und die kortikospinale Läsion bei amyotropher Lateralsklerose. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 3, 131-136. doi: 10.1080/146608202760834139
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Kovach, I., and Groozman, G. B. (2001). Elektrophysiologische Bewertung der Beteiligung der oberen Motoneuronen bei amyotropher Lateralsklerose. Amyotroph. Lateral Scler. Other Motor Neuron Disord. 2, 147-152. doi: 10.1080/146608201753275616
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Neufeld, M. Y., and Korczyn, A. D. (1993). F-Wellen-Charakteristika nach akuten und chronischen Läsionen der oberen Motoneuronen. Electromyogr. Clin. Neurophysiol. 33, 441-446.
PubMed Abstract | Google Scholar
Fang, J., Cui, L.-Y., Liu, M.-S., Guan, Y.-Z., Li, X.-G., Cui, B., et al. (2015). F-Wellen-Studie bei amyotropher Lateralsklerose: Bewertung der segmentalen motoneuronalen Dysfunktion. Chin. Med. J. 128, 1738-1742. doi: 10.4103/0366-6999.159346
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A. (1992). H-Reflexe und F-Wellen: Physiologie und klinische Indikationen. Muscle Nerve 15, 1223-1233. doi: 10.1002/mus.880151102
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A., Hoffen, B., and Hultman, C. (1994). Normative F-Wellen-Werte und die Anzahl der aufgezeichneten F-Wellen. Muscle Nerve 17, 1185-1189. doi: 10.1002/mus.880171009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gooch, C. L., Doherty, T. J., Chan, K. M., Bromberg, M. B., Lewis, R. A., Stashuk, D. W., et al. (2014). Motor unit number estimation: a technology and literature review. Muscle Nerve 50, 884-893. doi: 10.1002/mus.24442
PubMed Abstract | CrossRef Full Text | Google Scholar
Hachisuka, A., Komori, T., Abe, T., and Hachisuka, K. (2015). Repeater F-waves are signs of motor unit pathology in polio survivors. Muscle Nerve 51, 680-685. doi: 10.1002/mus.24428
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahim, I. K., and el-Abd, M. A. (1997). Giant repeater F-wave in patients with anterior horn cell disorders. Role of motor unit size. Am. J. Phys. Med. Rehabil. 76, 281-287. doi: 10.1097/00002060-199707000-00006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J.-E., Hong, Y.-H., Lee, J.-H., Ahn, S.-W., Kim, S.-M., Park, K.-S., et al. (2015). Musterunterschiede der dissoziierten Handmuskelatrophie bei amyotropher Lateralsklerose und Varianten. Muscle Nerve 51, 333-337. doi: 10.1002/mus.24323
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Mizobuchi, K., Ogawara, K., and Hattori, T. (1999). Dissoziierte Beteiligung der kleinen Handmuskeln bei amyotropher Lateralsklerose, festgestellt durch Schätzung der Anzahl der motorischen Einheiten. Muscle Nerve 22, 870-873. doi: 10.1002/(sici)1097-4598(199907)22:7<870::aid-mus9>3.0.co;2-o
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Sonoo, M., Komori, T., Shimizu, T., Hirashima, F., Inaba, A., et al. (2008). Dissoziierte Muskelatrophie der kleinen Hand bei amyotropher Lateralsklerose: Häufigkeit, Ausmaß und Spezifität. Muscle Nerve 37, 426-430. doi: 10.1002/mus.20949
PubMed Abstract | CrossRef Full Text | Google Scholar
Macdonell, R. A. L., Jackson, G. D., Curatolo, J. M., Abbott, D. F., Berkovic, S. F., Carey, L. M., et al. (1999). Lokalisierung des motorischen Kortex mittels funktioneller MRT und transkranieller Magnetstimulation. Neurology 53, 1462-1467. doi: 10.1212/wnl.53.7.1462
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, P., Kiernan, M. C., and Vucic, S. (2014). Kortikale Erregbarkeitsunterschiede in Handmuskeln folgen einem Split-Hand-Muster bei gesunden Kontrollen. Muscle Nerve 49, 836-844. doi: 10.1002/mus.24072
PubMed Abstract | CrossRef Full Text | Google Scholar
Milanov, I. G. (1992). Die F-Welle zur Beurteilung der segmentalen Motoneuronenerregbarkeit. Electromyogr. Clin. Neurophysiol. 32, 11-15.
PubMed Abstract | Google Scholar
Pastore-Olmedo, C., Gonzáez, O., and Geijo-Barrientosc, E. (2009). Eine Studie der F-Wellen bei Patienten mit einseitiger lumbosakraler Radikulopathie. Eur. J. Neurol. 16, 1233-1239. doi: 10.1111/j.1468-1331.2009.02764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Peioglou-Harmoussi, S., Fawcett, P. R. W., Howel, D., und Barwick, D. D. (1987). F-Antwort-Häufigkeit bei Motoneuron-Krankheit und zervikaler Spondylose. J. Neurol. Neurosurg. Psychiatry 50, 593-599. doi: 10.1136/jnnp.50.5.593
PubMed Abstract | CrossRef Full Text | Google Scholar
Petajan, J. H. (1985). F-waves in neurogenic atrophy. Muscle Nerve 8, 690-696. doi: 10.1002/mus.880080811
PubMed Abstract | CrossRef Full Text | Google Scholar
Puksa, L., Stålberg, E., and Falck, B. (2003). Das Auftreten von A-Wellen in F-Wellen-Studien gesunder Nerven. Muscle Nerve 28, 626-629. doi: 10.1002/mus.10448
PubMed Abstract |Ref Full Text | Google Scholar
Ramírez-Jarquín, U. N., Lazo-Gómez, R., Tovar-y-Romo, L. B., and Tapia, R. (2014). Spinale inhibitorische Schaltkreise und ihre Rolle bei der Degeneration von Motoneuronen. Neuropharmacology 82, 101-107. doi: 10.1016/j.neuropharm.2013.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Roche, J. C., Rojas-Garcia, R., Scott, K. M., Scotton, W., Ellis, C. E., Burman, R., et al. (2012). Ein vorgeschlagenes Staging-System für amyotrophe Lateralsklerose. Brain 135, 847-852. doi: 10.1093/brain/awr351
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, H. H., and Stalberg, E. (1978). F-Antworten untersucht mit Einzelfaser-EMG bei Normalpersonen und spastischen Patienten. J. Neurol. Neurosurg. Psychiatry 41, 45-53. doi: 10.1136/jnnp.41.1.45
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibuya, K., Misawa, S., Nasu, S., Sekiguchi, Y., Mitsuma, S., Beppu, M., et al. (2013). Split hand syndrome in amyotrophic lateral sclerosis: different excitability changes in the thenar and hypothenar motor axons. J. Neurol. Neurosurg. Psychiatry 84, 969-972. doi: 10.1136/jnnp-2012-304109
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, M. R., and Kiernan, M. C. (2012). Trägt interneuronale Dysfunktion zur Neurodegeneration bei amyotropher Lateralsklerose bei. Amyotroph. Lateral Scler. 13, 245-250. doi: 10.3109/17482968.2011.636050
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dijk, J. P., Schelhaas, H. J., Van Schaik, I. N., Janssen, H. M. H. A., Stegeman, D. F., and Zwarts, M. J. (2010). Überwachung des Krankheitsverlaufs durch Schätzung der Anzahl motorischer Einheiten mit hoher Dichte bei amyotropher Lateralsklerose. Muscle Nerve 42, 239-244. doi: 10.1002/mus.21680
PubMed Abstract | CrossRef Full Text | Google Scholar
Vucic, S., and Kiernan, M. C. (2010). Hochregulierung der persistierenden Natriumleitfähigkeit bei familiärer ALS. J. Neurol. Neurosurg. Psychiatry 81, 222-227. doi: 10.1136/jnnp.2009.183079
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, M., Eisen, A., Stewart, H., und Hirota, N. (2000). Die gespaltene Hand bei ALS hat eine kortikale Grundlage. J. Neurol. Sci. 180, 66-70. doi: 10.1016/s0022-510x(00)00430-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilbourn, A. J. (2000). The split hand syndrome. Muscle Nerve 23:138. doi: 10.1002/(sici)1097-4598(200001)23:1<138::aid-mus22>3.0.co;2-7
PubMed Abstract | CrossRef Full Text | Google Scholar