Bewertung | Biopsychologie | Vergleichend | Kognitiv | Entwicklungspsychologie | Sprache | Individuelle Unterschiede | Persönlichkeit | Philosophie | Soziales |
Methoden | Statistik | Klinisch | Pädagogisch | Industriell | Beruflich |Weltpsychologie |
Biologisch:Verhaltensgenetik – Evolutionspsychologie – Neuroanatomie – Neurochemie – Neuroendokrinologie -Neurowissenschaften – Psychoneuroimmunologie – Physiologische Psychologie – Psychopharmakologie(Index, Übersicht)
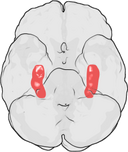
Die Lage des Hippocampus im menschlichen Gehirn.
Zur gleichnamigen Fachzeitschrift siehe Hippocampus (Fachzeitschrift)
Der Hippocampus ist ein Teil des Vorderhirns und befindet sich im medialen Temporallappen. Er gehört zum limbischen System und spielt eine wichtige Rolle für das Langzeitgedächtnis und die räumliche Navigation. Der Mensch und andere Säugetiere haben zwei Hippocampi, einen auf jeder Seite des Gehirns. Bei Nagetieren, wo er am ausführlichsten untersucht wurde, hat der Hippocampus die Form einer Banane. Beim Menschen hat er eine gekrümmte und verschlungene Form, die die frühen Anatomen an ein Seepferdchen erinnerte. Der Name leitet sich tatsächlich vom griechischen Wort für Seepferdchen ab (griechisch: hippos = Pferd, campos = Meer).
Bei der Alzheimer-Krankheit ist der Hippocampus eine der ersten Hirnregionen, die geschädigt werden; Gedächtnisprobleme und Desorientierung gehören zu den ersten Symptomen. Eine Schädigung des Hippocampus kann auch durch Sauerstoffmangel (Anoxie), Enzephalitis oder Epilepsie des mesialen Temporallappens verursacht werden. Menschen mit ausgedehnten Hippocampus-Schäden können eine Amnesie erleiden, d. h. die Unfähigkeit, neue Erinnerungen zu bilden oder zu behalten.
- Funktionen des Hippocampus
- Rolle im Gedächtnis
- Rolle im räumlichen Gedächtnis und in der Navigation
- Hippocampus und Depression
- Geschichte
- Anatomie
- Physiologie
- Der Theta-Rhythmus
- Scharfe Wellen
- Evolution
- Siehe auch
- Referenzen & Bibliographie
- Schlüsseltexte
- Bücher
- Papers
- Zusatzmaterial
- Aufsätze
- Zusätzliche Bilder
Funktionen des Hippocampus
Vielleicht war die früheste Idee, dass der Hippocampus am Geruchssinn beteiligt ist: Dies scheint vor allem durch seine Lage im Gehirn neben dem Geruchskortex nahegelegt worden zu sein. Es besteht weiterhin ein gewisses Interesse an den Geruchsreaktionen des Hippocampus, aber fast niemand glaubt mehr, dass die primäre Funktion des Hippocampus der Geruchssinn ist.
Im Laufe der Jahre haben drei Hauptvorstellungen über die Funktion des Hippocampus die Literatur beherrscht: Hemmung, Gedächtnis und Raum. Die Theorie der Verhaltenshemmung (die von O’Keefe und Nadel als “Tritt auf die Bremse!” karikiert wurde) war bis in die 1960er Jahre sehr beliebt. Sie stützte sich im Wesentlichen auf zwei Beobachtungen: Erstens neigen Tiere mit Hippocampus-Schäden dazu, hyperaktiv zu sein; zweitens haben Tiere mit Hippocampus-Schäden oft Schwierigkeiten, zu lernen, Reaktionen zu unterdrücken, die ihnen zuvor beigebracht wurden. Jeffrey Gray entwickelte diesen Gedankengang zu einer vollwertigen Theorie über die Rolle des Hippocampus bei Angstzuständen. Die Inhibitionstheorie ist jedoch derzeit nicht sehr populär.
Die zweite wichtige Denkrichtung bezieht den Hippocampus auf das Gedächtnis. Obwohl es Vorläufer gab, erhielt diese Idee ihre Hauptkraft aus einem sehr bekannten Bericht von Scoville und Milner über die Ergebnisse einer chirurgischen Zerstörung des Hippocampus (in einem Versuch, epileptische Anfälle zu lindern) bei einem Patienten namens H.M. Das unerwartete Ergebnis war eine schwere Amnesie: H.M. war nicht in der Lage, sich bewusst an Ereignisse zu erinnern, die nach seiner Operation oder für mehrere Jahre davor stattfanden. Dieser Fall erregte so großes Interesse, dass H.M. heute als der am intensivsten untersuchte medizinische Fall der Geschichte gilt. In den darauffolgenden Jahren wurden auch andere Patienten mit ähnlichen Schädigungen des Hippocampus und Amnesie (durch Unfall oder Krankheit) untersucht, und in buchstäblich Tausenden von Experimenten wurde die Physiologie der neuronalen Plastizität im Hippocampus untersucht. Man ist sich inzwischen fast einig, dass der Hippocampus eine wichtige Rolle für das Gedächtnis spielt; die genaue Art dieser Rolle ist jedoch nach wie vor sehr umstritten.
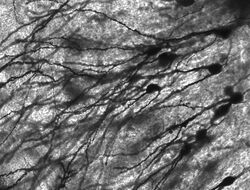
Golgi-gefärbte Neuronen im Hippocampus von Nagetieren.
Rolle im Gedächtnis
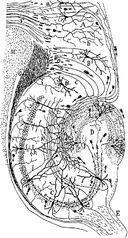
Zeichnung der neuronalen Schaltkreise des Hippocampus von Nagetieren. S. Ramón y Cajal, 1911.
Psychologen und Neurowissenschaftler streiten über die genaue Rolle des Hippocampus, sind sich aber im Allgemeinen einig, dass er eine wesentliche Rolle bei der Bildung neuer Erinnerungen an persönlich erlebte Ereignisse (episodisches oder autobiografisches Gedächtnis) spielt. Einige Forscher ziehen es vor, den Hippocampus als Teil eines größeren Gedächtnissystems im medialen Temporallappen zu betrachten, das für das allgemeine deklarative Gedächtnis verantwortlich ist (Erinnerungen, die explizit verbalisiert werden können – dazu würde beispielsweise neben dem episodischen Gedächtnis auch das Gedächtnis für Fakten gehören).
Hauptartikel: Rolle des Hippocampus im Gedächtnis
Es gibt Hinweise darauf, dass der Hippocampus bei der Speicherung und Verarbeitung räumlicher Informationen eine Rolle spielt. Studien an Ratten haben gezeigt, dass Neuronen im Hippocampus räumliche Feuerfelder haben. Diese Zellen werden als Ortszellen bezeichnet. Einige Zellen feuern, wenn sich das Tier an einem bestimmten Ort befindet, unabhängig von der Bewegungsrichtung, während die meisten zumindest teilweise auf die Richtung des Kopfes und die Bewegungsrichtung reagieren.
Hauptartikel: Rolle des Hippocampus im räumlichen Gedächtnis und in der Navigation
Hippocampus und Depression
- Ein Volumenverlust des Hippocampus, der möglicherweise die Auswirkungen übermäßiger Glucocorticoide auf die
Neurogenese widerspiegelt, wurde bei Gruppen depressiver Menschen im Vergleich zu Kontrollpersonen festgestellt.
Hauptartikel: Depression und der Hippocampus
Geschichte
Der Anatom Giulio Cesare Aranzi (um 1564) benutzte erstmals den Begriff Hippocampus, um das Hirnorgan zu beschreiben, weil es optisch einem Seepferdchen ähnelt. Dieses Organ wurde zunächst mit dem Geruchssinn in Verbindung gebracht und nicht mit seiner bekannten Funktion beim Gedächtniserwerb. Der Russe Wladimir Bechterew wies um 1900 auf die Rolle des Hippocampus für das Gedächtnis hin, wobei er sich auf die Beobachtungen eines Patienten mit tiefgreifenden Gedächtnisstörungen stützte. Viele Jahre lang herrschte jedoch die Meinung vor, dass der Hippocampus wie der Rest des limbischen Systems für Emotionen zuständig sei.
Die Bedeutung des Hippocampus für das Gedächtnis wurde den Forschern durch den Patienten HM vor Augen geführt. HM litt unter einer Reihe von anterograden und zeitlich abgestuften retrograden Gedächtnisstörungen (solche Beeinträchtigungen sind Gegenstand des Films Memento), nachdem ihm zur Linderung häufiger epileptischer Anfälle beidseitig verschiedene Strukturen des medial-temporalen Lappens entfernt worden waren (einschließlich der beidseitigen Ablation seiner Hippocampi). Von besonderer Bedeutung ist, dass HM immer noch in der Lage war, prozedurale Aufgaben zu lernen (die mit dem Striatum in Verbindung stehen) und einen überdurchschnittlichen IQ hatte. HM zeigte eine auffällige Einzeldissoziation zwischen Intelligenz und deklarativem Gedächtnis. Die relative Größe der Hippocampus-Formation im Verhältnis zum Gesamtvolumen des Gehirns ist bei den meisten Säugetierarten erhalten geblieben. Es wurde jedoch festgestellt, dass diese Bereiche bei Walen relativ hypotroph sind.
Anatomie
Hauptartikel: Anatomie des Hippocampus
Human hippocampus.
Nissl-gefärbter Koronalschnitt des Gehirns eines Makaken-Affen, der den Hippocampus (eingekreist) zeigt. Quelle: brainmaps.org
Anatomisch gesehen ist der Hippocampus eine Ausprägung des Randes des Kortex. Er kann als eine Zone unterschieden werden, in der sich der Kortex zu einer einzigen Schicht sehr dicht gepackter Neuronen verengt, die sich zu einer engen S-Form zusammenrollen. Die Strukturen, die den Rand des Kortex säumen, bilden das so genannte limbische System (lat. limbus = Grenze): Dazu gehören der Hippocampus, der cinguläre Kortex, der olfaktorische Kortex und die Amygdala. Paul MacLean schlug einst im Rahmen seiner Theorie des dreieinigen Gehirns vor, dass die limbischen Strukturen die neuronale Grundlage der Emotionen bilden. Die meisten Neurowissenschaftler glauben jedoch nicht mehr an die Gültigkeit des Konzepts eines einheitlichen “limbischen Systems”.
Der Hippocampus als Ganzes sieht aus wie eine gekrümmte Röhre, die mit einem Seepferdchen, einem Widderhorn (Cornu Ammonis) oder einer Banane verglichen wird.
Dieser allgemeine Aufbau gilt für alle Säugetierarten, vom Igel bis zum Menschen, obwohl die Details variieren. Bei der Ratte sehen die beiden Hippocampi verblüffend aus wie ein Paar Bananen, die am Stiel zusammenhängen. Im Gehirn von Menschen oder Affen ist der untere Teil des Hippocampus in der Nähe der Basis des Schläfenlappens viel breiter als der obere Teil. Eine der Folgen dieser komplexen Geometrie ist, dass Querschnitte durch den Hippocampus je nach Winkel und Lage des Schnitts eine verwirrende Vielfalt an Formen aufweisen können.
Die stärksten Verbindungen des Hippocampus bestehen mit dem entorhinalen Kortex (EC), der im Schläfenlappen neben ihm liegt. Die oberflächlichen Schichten des EC liefern die meisten Inputs für den Hippocampus, und die tiefen Schichten des EC erhalten die meisten Outputs. Der Hippocampus wiederum ist mit vielen anderen Teilen des Kortex eng und wechselseitig verbunden. Der Hippocampus erhält auch eine sehr wichtige Projektion aus dem medialen Septalbereich. Die Zerstörung des Septalbereichs hebt den Theta-Rhythmus des Hippocampus auf und beeinträchtigt bestimmte Arten des Gedächtnisses erheblich. (Es wird angenommen, dass die so genannten “Date-Rape”-Drogen ihre amnestischen Wirkungen zumindest teilweise durch Antagonisierung der cholinergen Projektion vom medialen Septum zum Hippocampus ausüben.)
Physiologie
Beispiele für das EEG des Hippocampus der Ratte und die neuronale Aktivität des CA1 im Theta-Modus (wach/verhaltend) und im LIA-Modus (Langsamschlaf). Jedes Diagramm zeigt 20 Sekunden an Daten, mit einer EEG-Spur des Hippocampus oben, Spike-Rastern von 40 gleichzeitig aufgezeichneten CA1-Pyramidenzellen in der Mitte (jede Rasterlinie steht für eine andere Zelle) und einer Darstellung der Laufgeschwindigkeit unten. Die obere Grafik stellt einen Zeitraum dar, in dem die Ratte aktiv nach verstreuten Futterpellets suchte. Die untere Darstellung zeigt, dass die Ratte schlief.
Der Hippocampus weist zwei Hauptaktivitätsmodi auf, die jeweils mit einem bestimmten Muster von EEG-Wellen und neuronaler Populationsaktivität verbunden sind und nach den ihnen zugeordneten EEG-Mustern benannt sind: Theta und Large Irregular Activity (LIA). Hier sind einige ihrer Hauptmerkmale bei der Ratte, dem Tier, das am ausführlichsten untersucht wurde:
Der Theta-Modus tritt bei aktivem, wachem Verhalten (vor allem bei der Fortbewegung) und auch während des REM-Schlafs (Träumen) auf. Im Theta-Modus wird das EEG von großen regelmäßigen Wellen mit einer Frequenz von 6-9 Hz dominiert, und die Hauptgruppen der Hippocampus-Neuronen (Pyramidenzellen und Körnerzellen) zeigen eine spärliche Populationsaktivität, was bedeutet, dass in jedem kurzen Zeitintervall die große Mehrheit der Zellen still ist, während die kleine verbleibende Fraktion mit relativ hohen Raten feuert, bis zu 50 Spikes in einer Sekunde bei den aktivsten von ihnen. Eine aktive Zelle bleibt in der Regel eine halbe Sekunde bis einige Sekunden lang aktiv. Im Laufe des Verhaltens der Ratte verstummen die aktiven Zellen und neue Zellen werden aktiv, aber der Gesamtanteil der aktiven Zellen bleibt mehr oder weniger konstant. In vielen Situationen wird die Zellaktivität weitgehend durch die räumliche Lage des Tieres bestimmt, aber auch andere Verhaltensvariablen haben einen deutlichen Einfluss auf sie.
Der LIA-Modus tritt während des Slow-Wave-Schlafs (ohne Träumen) auf, aber auch während Zuständen wacher Unbeweglichkeit, wie z. B. beim Ruhen oder Essen. Im LIA-Modus wird das EEG von scharfen Wellen dominiert, d. h. von großen Ausschlägen des EEG-Signals in zufälligen Zeitabständen, die 200-300 ms dauern. Diese scharfen Wellen bestimmen auch die Muster der neuronalen Aktivität der Bevölkerung. Dazwischen sind die Pyramidenzellen und die Körnerzellen sehr leise (aber nicht stumm). Während einer scharfen Welle können bis zu 5-10 % der Population in einem Zeitraum von 50 ms Aktionspotentiale aussenden; viele dieser Zellen senden nicht nur eine, sondern eine ganze Reihe von Spikes aus.
Diese beiden Aktivitätsmodi des Hippocampus können sowohl bei Primaten als auch bei Ratten beobachtet werden, mit der wichtigen Ausnahme, dass es schwierig war, eine robuste Theta-Rhythmik im Hippocampus von Primaten zu erkennen. Es gibt jedoch qualitativ ähnliche scharfe Wellen und ähnliche zustandsabhängige Veränderungen der neuronalen Populationsaktivität.
Der Theta-Rhythmus
Aufgrund seiner dicht gepackten neuronalen Schichten erzeugt der Hippocampus einige der größten EEG-Signale aller Gehirnstrukturen. In manchen Situationen wird das EEG von regelmäßigen Wellen dominiert, die oft mehrere Sekunden lang anhalten. Dieses EEG-Muster ist als Thetarhythmus bekannt. Es war eines der frühesten EEG-Phänomene, die entdeckt wurden: Die erste Beschreibung stammt von Jung und Kornmüller aus dem Jahr 1938. Vielleicht vor allem deshalb, weil sie den Theta-Rhythmus mit der Erregung in Verbindung brachten, die damals ein heißes Thema war, löste ihr Artikel eine Flut von Folgestudien aus, die dazu führten, dass in den 1950er und 1960er Jahren buchstäblich Hunderte von Studien über die Physiologie und Pharmakologie des Theta-Rhythmus veröffentlicht wurden. Trotz dieser recht umfangreichen Arbeiten blieben viele Fragen unbeantwortet, insbesondere die Frage nach der Funktion. Auch heute ist diese kritischste aller Fragen noch nicht überzeugend beantwortet.
Die Theta-Rhythmik ist bei Kaninchen und Nagetieren sehr deutlich, und auch bei Katzen und Hunden ist sie klar vorhanden. Ob Theta auch bei Primaten zu sehen ist, ist eine schwierige Frage. Green und Arduini berichteten nur über sehr kurze Ausbrüche einer eher unregelmäßigen Rhythmik bei Affen, und in den meisten späteren Studien wurde kaum mehr beobachtet. Aufgrund der unterschiedlichen Methodik ist es jedoch schwierig, eindeutige Schlussfolgerungen zu ziehen.
Bei Ratten (den Tieren, die bei weitem am ausführlichsten untersucht wurden) tritt Theta hauptsächlich unter zwei Bedingungen auf: erstens, wenn ein Tier läuft oder auf andere Weise aktiv mit seiner Umgebung interagiert; zweitens während des REM-Schlafs. Die Frequenz nimmt in Abhängigkeit von der Laufgeschwindigkeit zu, beginnend bei etwa 6,5 Hz im unteren Bereich und ansteigend auf etwa 9 Hz im oberen Bereich, obwohl bei dramatischen Bewegungen wie Sprüngen über große Lücken manchmal höhere Frequenzen zu beobachten sind. Bei anderen, größeren Tierarten sind die Theta-Frequenzen im Allgemeinen etwas niedriger. Auch die Verhaltensabhängigkeit scheint von Tierart zu Tierart zu variieren: Bei Katzen und Kaninchen wird Theta häufig in bewegungslosen Wachzuständen beobachtet. Dies wurde auch bei Ratten beobachtet, allerdings nur, wenn sie stark verängstigt sind.
Theta ist nicht nur auf den Hippocampus beschränkt. Bei Ratten kann es in vielen Teilen des Gehirns beobachtet werden, darunter in fast allen Bereichen, die stark mit dem Hippocampus interagieren. Man nimmt an, dass der Schrittmacher für den Rhythmus im medialen Septalbereich liegt: Dieser Bereich projiziert in alle Regionen, die Theta-Rhythmik zeigen, und seine Zerstörung eliminiert Theta im gesamten Gehirn. (Eine Ausnahme bildet ein kleiner Bereich im Hypothalamus, der so genannte supramamillarynucleus, der in manchen Situationen in der Lage zu sein scheint, Theta unabhängig vom Septum aufrechtzuerhalten.)
Die Funktion von Theta, vorausgesetzt, es hat eine, ist noch nicht überzeugend erklärt worden, obwohl zahlreiche Theorien vorgeschlagen wurden.Es ist erwiesen, dass Läsionen des medialen Septums – des zentralen Knotens des Thetasystems – zu schweren Gedächtnisstörungen führen, aber das mittlere Septum ist nicht nur der Controller des Thetasystems, sondern auch die Hauptquelle der cholinergen Projektionen zum Hippocampus. Es ist nicht erwiesen, dass Läsionen des Septums ihre Wirkung speziell durch die Eliminierung von Theta entfalten.
Scharfe Wellen
Im Schlaf oder im Wachzustand, wenn ein Tier ruht oder anderweitig nicht mit seiner Umgebung beschäftigt ist, zeigt das EEG des Hippocampus ein Muster unregelmäßiger langsamer Wellen, die in ihrer Amplitude etwas größer sind als Thetawellen. Dieses Muster wird gelegentlich durch große Wellen unterbrochen, die als scharfe Wellen bezeichnet werden. Diese Ereignisse stehen in Verbindung mit 50-100 ms dauernden Spike-Aktivitätsstößen in den Pyramidenzellen von CA3 und CA1. Sie sind auch mit kurzzeitigen hochfrequenten EEG-Schwingungen, den so genannten “Ripples”, verbunden. Ripples, deren Frequenzen bei Ratten im Bereich von 150-200 Hz liegen, können in der Regel nur von Elektroden erfasst werden, die sich entweder innerhalb oder in unmittelbarer Nähe der CA1-Zellkörperschicht befinden. Im Gegensatz dazu können Elektroden, die sich irgendwo im Hippocampus oder sogar in benachbarten Hirnstrukturen befinden, oft scharfe Wellen als große, langsame EEG-Auslenkungen mit einer Dauer von 200-400 ms erfassen.
Bei Ratten sind scharfe Wellen während des Schlafs am stärksten ausgeprägt, wenn sie mit einer durchschnittlichen Rate von etwa 1 pro Sekunde, aber in einem sehr unregelmäßigen zeitlichen Muster auftreten. Scharfe Wellen treten auch während inaktiver Wachphasen auf, sind dann aber weniger häufig und in der Regel kleiner. Scharfe Wellen wurden auch im menschlichen Schläfenlappen und im Hippocampus von Affen beobachtet, die zwar recht robust sind, aber nicht annähernd so häufig auftreten wie Ratten.
Einer der interessantesten Aspekte von scharfen Wellen ist, dass sie mit dem Gedächtnis in Verbindung zu stehen scheinen. Wilson und McNaughton 1994 und zahlreiche spätere Studien berichteten, dass Hippocampus-Ortszellen, die überlappende räumliche Feuerungsfelder haben (und daher oft nahezu gleichzeitig feuern), dazu neigen, während des Schlafs nach der Verhaltenssitzung korrelierte Aktivität zu zeigen. Diese Verstärkung der Korrelation, die gemeinhin als Reaktivierung bezeichnet wird, ist nachweislich hauptsächlich auf scharfe Wellen beschränkt. Es wurde vorgeschlagen, dass es sich bei den scharfen Wellen tatsächlich um Reaktivierungen von neuronalen Aktivitätsmustern handelt, die während des Verhaltens gespeichert wurden und durch die Stärkung synaptischer Verbindungen innerhalb des Hippocampus ausgelöst werden. Diese Idee bildet eine Schlüsselkomponente der von Buzsaki und anderen vertretenen Theorie des “zweistufigen Gedächtnisses”, die besagt, dass Erinnerungen während des Verhaltens im Hippocampus gespeichert und später während des Schlafs in den Neokortex übertragen werden: Es wird angenommen, dass scharfe Wellen hebbsche synaptische Veränderungen in den neokortikalen Zielen der hippocampalen Ausgabewege bewirken.
Evolution
Der Hippocampus sieht bei allen Säugetierarten im Allgemeinen ähnlich aus, von den basalen Arten wie dem Igel bis zu den “fortgeschrittensten” Arten wie dem Menschen.Das Verhältnis von Hippocampusgröße zu Körpergröße nimmt allgemein zu und ist bei Primaten etwa doppelt so groß wie beim Igel. Daher nimmt der Hippocampus bei Nagetieren ein viel größeres Volumen des Kortikalismantels ein als bei Primaten.
Es gibt auch eine allgemeine Beziehung zwischen der Größe des Hippocampus und dem räumlichen Gedächtnis: Wenn man Vergleiche zwischen ähnlichen Spezies anstellt, haben diejenigen, die eine größere Kapazität für das räumliche Gedächtnis haben, tendenziell ein größeres Hippocampusvolumen. Diese Beziehung erstreckt sich auch auf Geschlechtsunterschiede: Bei Arten, bei denen Männchen und Weibchen starke Unterschiede in der Fähigkeit des räumlichen Gedächtnisses aufweisen, zeigen sich auch entsprechende Unterschiede im Hippocampus-Volumen
Nicht-Säugetierarten haben keine Gehirnstruktur, die dem Hippocampus der Säugetiere ähnelt, aber sie haben eine, die als homolog zu ihm gilt. Der Hippocampus ist, wie bereits erwähnt, im Wesentlichen der mediale Rand des Kortex. Nur Säugetiere haben einen voll entwickelten Kortex, aber die Struktur, aus der er sich entwickelt hat, das so genannte Pallium, ist bei allen Wirbeltieren vorhanden, selbst bei den primitivsten wie dem Neunauge oder dem Schleimaal. Das Pallium wird in der Regel in drei Zonen unterteilt: medial, lateral und dorsal. Das mediale Pallium bildet den Vorläufer des Hippocampus. Optisch ähnelt es dem Hippocampus nicht, da die Schichten nicht S-förmig gekrümmt oder vom Gyrus dentatus umhüllt sind, aber die Homologie zeigt sich in starken chemischen und funktionellen Ähnlichkeiten. Es gibt inzwischen Hinweise darauf, dass diese hippocampusähnlichen Strukturen bei Vögeln, Reptilien und Fischen an der räumlichen Wahrnehmung beteiligt sind.
Bei Vögeln ist die Übereinstimmung so gut belegt, dass die meisten Anatomen die mediale Pallialzone als “Vogelhippocampus” bezeichnen. Zahlreiche Vogelarten verfügen über ein ausgeprägtes räumliches Vorstellungsvermögen, vor allem diejenigen, die Nahrung verstecken. Es gibt Belege dafür, dass Vögel, die Nahrung cachen, einen größeren Hippocampus haben als andere Vogelarten und dass eine Schädigung des Hippocampus zu Beeinträchtigungen des räumlichen Gedächtnisses führt.
Die Geschichte der Fische ist komplexer. Bei Teleostfischen (die die große Mehrheit der existierenden Arten ausmachen) ist das Vorderhirn im Vergleich zu anderen Wirbeltierarten seltsam verzerrt. Die meisten Neuroanatomen gehen davon aus, dass das Vorderhirn der Teleosteer im Wesentlichen umgekehrt ist, wie eine umgedrehte Socke, so dass Strukturen, die bei den meisten Wirbeltieren im Inneren neben den Ventrikeln liegen, bei den Teleosteern außen zu finden sind und andersherum. Dies hat unter anderem zur Folge, dass man annimmt, dass das mediale Pallium (“hippocampale” Zone) eines typischen Wirbeltiers dem lateralen Pallium eines typischen Fisches entspricht. Bei mehreren Fischarten (insbesondere Goldfischen) wurde experimentell nachgewiesen, dass sie über ein ausgeprägtes räumliches Erinnerungsvermögen verfügen und sogar “kognitive Karten” der von ihnen bewohnten Gebiete erstellen können. Es gibt Belege dafür, dass eine Schädigung des lateralen Palliums das räumliche Gedächtnis beeinträchtigt. (Die Navigation über große Entfernungen, wie z. B. die Heimkehr von Lachsen, scheint jedoch auf anderen Mechanismen zu beruhen.)
Die Rolle der Hippocampusregion bei der Navigation scheint also weit zurück in der Evolution der Wirbeltiere zu liegen, noch vor den Abspaltungen, die vor Hunderten von Millionen Jahren stattfanden. Es ist noch nicht bekannt, ob das mediale Pallium eine ähnliche Rolle bei noch primitiveren Wirbeltieren wie Haien und Rochen oder sogar Neunaugen und Schleimaalen spielt. Einige Insektenarten und Weichtiere wie der Tintenfisch verfügen ebenfalls über ausgeprägte räumliche Lern- und Navigationsfähigkeiten, aber diese scheinen anders zu funktionieren als das räumliche System der Säugetiere, so dass es bisher keinen guten Grund gibt, von einem gemeinsamen evolutionären Ursprung auszugehen; auch gibt es keine ausreichende Ähnlichkeit in der Hirnstruktur, um bei diesen Arten etwas Ähnliches wie einen “Hippocampus” zu erkennen.
Siehe auch
- Amygdalohippokampektomie
- Medianes Vorderhirnbündel
- Septale Kerne
Referenzen & Bibliographie
Schlüsseltexte
Bücher
- Aboitiz, F, Morales D, Montiel J (2003). Der evolutionäre Ursprung des Säugetier-Isocortex: Towards an integrated developmental and functional approach. Behav. Brain Sciences 26: 535-552.
- Amaral, D; Lavenex P (2006). “Ch 3. Hippocampal Neuroanatomy” Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J The Hippocampus Book, Oxford University Press.
- Broglio, C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). Merkmale eines gemeinsamen Vorderhirns der Wirbeltiere: Spezialisierte Palliativareale für räumliches, zeitliches und emotionales Gedächtnis bei Fischen der Gattung Actinopterygia. Brain Res. Bull. 57: 397-399.
- Buzsáki, G (2002). Theta-Oszillationen im Hippocampus. Neuron 33: 325-340.
- Buzsáki, G (2006). Rhythms of the Brain.
- Cantero, JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (2003). Schlafabhängige Theta-Oszillationen im menschlichen Hippocampus und Neocortex. J. Neurosci. 23: 10897-10903.
- Colombo, M, Broadbent N (2000). Is the avian hippocampus a functional homologue of the mammalian hippocampus? Neurosci. Biobehav. Rev. 24: 465-484.
- Eichnbaum, H; Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System, MIT Press.
- Ekstrom, AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). Zelluläre Netzwerke, die der menschlichen räumlichen Navigation zugrunde liegen. Nature 425: 184-188.
- Gray, JA; McNaughton N (2000). The Neuropsychology of Anxiety: An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press.
- Green, JD, Arduini AA (1954). Hippocampal electrical activity in arousal. J. Neurophysiol. 17: 533-557.
- Jacobs, LF, Gaulin SJ, Sherry DF, Hoffman GE (1990). Evolution der räumlichen Kognition: Geschlechtsspezifische Muster des räumlichen Verhaltens sagen die Größe des Hippocampus voraus. PNAS 87: 6349-6352.
- Jacobs, LF (2003). The Evolution of the Cognitive Map. Brain Behav. Evol. 62: 128-139.
- Kirk, IJ, McNaughton N (1991). Supramammilläre Zellfeuerung und langsame rhythmische Aktivität im Hippocampus. Neuroreport 11: 723-725.
- Maguire, EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). Navigationsbezogene Strukturveränderungen im Hippocampus von Taxifahrern. PNAS 97: 4398-4403.
- McNaughton, BL, Battaglia FP, Jensen O, Moser EI, Moser MB (2006). Pfadintegration und die neuronale Basis der “kognitiven Karte”. Nat. Rev. Neurosci. 7: 663-678.
- Moser, EI, Kropf E, Moser M-B (2008). Place Cells, Grid Cells, and the Brain’s Spatial Representation System. Ann. Rev. Neurosci. 31.
- Nieuwenhuys, R (1982). Ein Überblick über die Organisation des Gehirns von Actinopterygischen Fischen. Am. Zool. 22: 287-310.
- O’Kane, G, Kensinger EA, Corkin S (2004). Beweise für semantisches Lernen bei tiefgreifender Amnesie: An investigation with patient H.M.. Hippocampus 14: 417-425.
- O’Keefe, J; Nadel L (1978). The Hippocampus as a Cognitive Map, Oxford University Press.
- Portavella, M, Vargas JP, Torres B, Salas C (2002). Die Auswirkungen von telencephalen Pallialäsionen auf räumliches, zeitliches und emotionales Lernen bei Goldfischen. Brain Res. Bull. 57: 397-399.
- Rodríguez, F, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C (2002). Das räumliche Gedächtnis und das Hippocampus-Pallium in der Evolution der Wirbeltiere: Erkenntnisse von Reptilien und Teleostfischen. Brain Res. Bull. 57: 499-503.
- Sainsbury, RS, Heynen A, Montoya CP (1987). Verhaltenskorrelate der hippocampalen Typ-2-Theta bei der Ratte. Physiol. Behav. 39: 513-519.
- Scoville, WB, Milner B (1957). Verlust des Kurzzeitgedächtnisses nach bilateralen Hippocampusläsionen. J. Neurol. Neurosurg. Psych. 20: 11-21.
- Shettleworth, SJ (2003). Memory and Hippocampal Specialization in Food-Storing Birds: Challenges for Research on Comparative Cognition. Brain Behav. Evol. 62: 108-116.
- Skaggs, WE, McNaughton BL, Wilson MA, Barnes CA (1996). Theta-Phasenpräzession in neuronalen Populationen des Hippocampus und die Kompression von zeitlichen Sequenzen. Hippocampus 6: 149-176.
- Squire, LR (1992). Gedächtnis und Hippocampus: eine Synthese aus Befunden an Ratten, Affen und Menschen. Psych. Rev. 99: 195-231.
- Squire, LR; Schacter DL (2002). The Neuropsychology of Memory, Guilford Press.
- Vanderwolf, CH (1969). Elektrische Aktivität des Hippocampus und freiwillige Bewegung bei der Ratte. EEG & Clin. Neurophysiol. 26: 407-418.
- Vargas, JP, Bingman VP, Portavella M, López JC (2006). Telencephalon und geometrischer Raum bei Goldfischen. Eur. J. Neurosci. 24: 2870-2878.
- West, MJ (1990). Stereologische Untersuchungen des Hippocampus: ein Vergleich der hippocampalen Unterteilungen verschiedener Spezies, einschließlich Igel, Labornager, Wildmäuse und Menschen. Prog. Brain Res. 83: 13-36.
Papers
- Amaral DG and Cowan WM. 1980. Subkortikale Afferenzen zur Hippocampusformation beim Affen. Journal of Comparative Neurology. Feb 15; 189(4):573-91.
- Duvernoy, H. (2005) The Human Hippocampus, 3rd ed. Berlin: Springer-Verlag.
Zusatzmaterial
Aufsätze
- Google Scholar
- http://www.psycheducation.org/emotion/hippocampus.htm Tolle Gehirnführungen!!!
- BrainMaps at UCDavis hippocampus
- Artificial Hippocampus
- BrainInfo at the University of Washington hier-164
- John O’Keefe & Lynn Nadel (1978) The Hippocampus as a Cognitive Map , Oxford University Press. Volltext
Zusätzliche Bilder
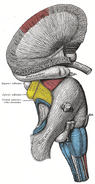
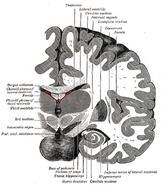
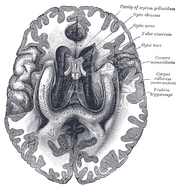
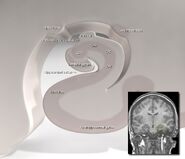
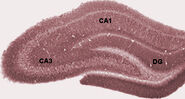
Foto zu dieser Galerie hinzufügen
Humanes Gehirn: Limbisches System
Amygdala – Gyrus Cinguli – Gyrus Fornicatus – Hippocampus – Hypothalamus – Mammillarkörper – Nucleus accumbens – Orbitofrontaler Kortex – Gyrus Parahippocampus
|
v-d-e
Human brain: Vorderhirn (Großhirn – Großhirnrinde – Großhirnhemisphären, graue Substanz) (TA A14.1.09.002-240, 301-320, GA 9.818-826) |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Frontallappen |
|
||||||||||||||||
| Parietallappen |
|
Superolateral
|
Medial/inferior
|
Beide
|
|||||||||||||
| Okzipitallappen |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Temporallappen |
|
Superolateral
|
Medialer/unterer
|
||||||||||||||
| Interlobar sulci/fissures |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Limbischer Lappen |
|
Sonstiges
|
|||||||||||||||
| Insularlappen |
Langer Gyrus der Insula – Kurze Gyri der Insula – Zirkulärer Sulcus der Insula |
||||||||||||||||
| Allgemein |
Operculum – Pole der Großhirnhemisphären |
||||||||||||||||
Einige Kategorisierungen sind Näherungen, und einige Brodmann-Areale überspannen Gyri.
|
|||||||||||||||||
Diese Seite verwendet Creative Commons lizenzierten Inhalt von Wikipedia (Autoren anzeigen).