Abstract
Die Diagnose einer Halsmasse kann eine Herausforderung darstellen. Bei Erwachsenen ist die häufigste Diagnose ein Malignom, wobei sowohl primäre als auch metastatische Tumore in Betracht gezogen werden sollten. Andere häufige Optionen sind infektiöse Prozesse. Wir stellen den Fall einer 88-jährigen Patientin mit einer submandibulären Masse mit Entzündungszeichen vor, die auf eine Antibiotikatherapie nicht ansprach und deren Feinnadelaspirationsbiopsie eine entzündliche Läsion ergab. Die Masse entwickelte sich über einen Monat hinweg mit begleitender Anorexie, was zur Einweisung zur Diagnose mit offener Biopsie führte. Nach der Einweisung wurde ein invasives Karzinom der rechten Brust diagnostiziert, und die Mykobakterienkultur der Biopsie der submandibulären Masse war positiv für Mycobacterium tuberculosis. Die Immunoseneszenz älterer Menschen trägt zur Anfälligkeit für Krebserkrankungen, aber auch für Infektionen bei, die sich atypisch darstellen und somit zu einer verzögerten Diagnose führen können.
Einleitung
Die Differentialdiagnose von Halsmassen ist äußerst schwierig, da mehrere Faktoren berücksichtigt werden müssen. Die Hauptdiagnose bei Erwachsenen ist Malignität, entweder primär, metastasiert von Tumoren der oberen Atemwege oder des Verdauungstrakts, oder Lymphom . Auch gutartige Neubildungen wie Lipome, Fibrome und Hämangiome können gefunden werden.
Fünfundsiebzig Prozent der Halsgeschwülste bei Patienten über 40 Jahren sind bösartig, und das Risiko steigt mit dem Alter. Die Größe der Läsion und die Dauer der Symptome sind weitere wichtige Prädiktoren für das Risiko einer Bösartigkeit, ebenso wie chronische Sonneneinstrahlung, Rauchen, Alkoholkonsum, schlechtes Gebiss, Umwelteinflüsse und die Familienanamnese.
Die physikalischen Merkmale der Masse sind ebenfalls wichtig für die Differentialdiagnose. Feste, harte oder fixierte Massen mit unregelmäßigen Grenzen deuten auf solide Malignome hin; multiple weiche und gummiartige Massen deuten auf ein Lymphom hin; Massen mit Entzündungszeichen deuten auf infektiöse Ursachen hin.
Entzündete Massen können durch eine Entzündung der Lymphknoten (zervikale Adenitis) entstehen, die in der Regel selbstbegrenzt sind und spontan abklingen. Eine chronische Entzündung der Submandibular- oder Parotisdrüsen mit chronischer Sialadenitis ist ebenfalls möglich.
Infektiöse Ursachen können viraler, bakterieller oder pilzlicher Natur sein. Virale Infektionen wie Cytomegalovirus (CMV), Epstein-Barrvirus (EBV), Masern, Adenovirus, Echovirus, Rhinovirus und Respiratory Syncitial Virus (RSV) zeigen in der Regel multiple Lymphknoten mit zervikaler Adenitis. Bakterielle Infektionen können Nekrosen mit Abszessbildung, spontaner Drainage und sogar chronischer Fistelbildung verursachen. Auch andere Erreger sollten in Betracht gezogen werden, nämlich Mykobakterien , Katzenkratzkrankheit durch Bartonella , Aktinomykose , Toxoplasma gondii .
Andere, weniger häufige Ursachen sind Gicht , entzündlicher Pseudotumor , Morbus Kimura , Morbus Castleman und Sarkoidose .
Die Diagnose wird in der Regel durch Feinnadelaspirationszytologie gestellt, die eine schnelle und empfindliche Methode ist . Wenn die Diagnose unklar bleibt, kann eine offene Biopsie erforderlich sein. Die Laboruntersuchungen variieren je nach Krankheitsbild, sollten aber Entzündungsparameter wie Leukozytenzahl, Erythrozytensenkungsgeschwindigkeit (ESR), C-reaktives Protein (CRP), virale und bakterielle Serologie entsprechend der klinischen Vorgeschichte und Untersuchung sowie einen Tuberkulin-Hauttest umfassen. Die Charakterisierung der Masse kann mit Ultraschall erfolgen, der anhand von Kriterien wie Größe und Vaskularisierung zwischen zystischen Läsionen, Speicheldrüsentumoren, reaktiven oder bösartigen Lymphknoten unterscheidet. Die Computertomographie (CT) und die Magnetresonanztomographie (MRT) helfen ebenfalls bei der Charakterisierung der Massen anhand von Größe und morphologischen Anomalien (zentrale Nekrose, Fettstränge und Heterogenität). Die Positronen-Emissions-Tomographie kann zur Untersuchung von Halsmassen eingesetzt werden, da sie einen erhöhten Stoffwechsel nachweist. Sie wird jedoch nicht als eigenständiger Test empfohlen, da sie nicht zwischen entzündlichen und neoplastischen Läsionen unterscheidet. Bei Verdacht auf eine bösartige Erkrankung sollten weitere Untersuchungen durchgeführt werden, einschließlich einer Ganzkörper-CT und endoskopischer Untersuchungen der oberen Atemwege und des Verdauungstrakts.
Fallbericht
Wir stellen den Fall einer 88-jährigen gebrechlichen Frau vor, die in einem Pflegeheim lebt und sich in der Notaufnahme vorstellte, weil sie seit 3 bis 4 Wochen unter Abmagerung, Anorexie und einer submandibulären Masse rechts mit Entzündungszeichen litt. Sie wurde von der Abteilung für Kiefer- und Gesichtschirurgie untersucht, die eine Feinnadelaspirationszytologie der Masse durchgeführt hatte, bei der Entzündungszellen festgestellt wurden, die negativ für neoplastische Zellen waren. Außerdem war sie bereits mit oraler Amoxicillin-Clavulansäure (875 mg/125 mg 3id für 7 Tage) behandelt worden, ohne dass eine Besserung eingetreten war.
Zu ihrer Krankengeschichte gehörten essentielle Hypertonie, Sinusbradykardie, periphere arterielle Verschlusskrankheit, leichte kognitive Beeinträchtigung und Depression. Sie wurde mit Aspirin, Olmesartan, Pentoxifyllin, Paroxetin und Alprazolam polymediziert.
Bei der Untersuchung war sie fettleibig und wies eine 3 × 3 cm große, feste, aber gummiartige, nicht schmerzhafte submandibuläre Masse mit Entzündungszeichen ohne Exsudat auf (Abbildung 1). Sie blieb fieberfrei und hatte keine anderen relevanten klinischen Anzeichen.
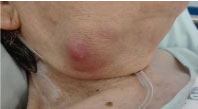 Abbildung 1: Foto der rechten submandibulären Masse. Abbildung 1
Abbildung 1: Foto der rechten submandibulären Masse. Abbildung 1
Angesichts des Fortschreitens der Erkrankung wurde die Patientin für weitere Untersuchungen, einschließlich einer offenen Biopsie der Masse, eingewiesen und mit einer empirischen Behandlung mit intravenöser Amoxicillin-Clavulansäure (1000 mg/200 mg für 9 weitere Tage) und Clindamycin (600 mg 4id für 7 Tage) begonnen, ebenfalls ohne klinische Verbesserung.
Die Blutuntersuchungen zeigten nur eine mikrozytäre hypochrome Anämie mit Eisenmangel und negativen Entzündungsparametern (Tabelle 1).
Tabelle 1: Blutbild der Patientin.Tabelle 1
Eine Ganzkörper-Computertomographie (CT) ergab mehrere nekrotische Halslymphknoten, den größten in der linken supraklavikulären Fossa und einen Knoten in der rechten Brustdrüse, unregelmäßig mit hyperattenuierenden Zeichen, die auf eine Vaskularisierung hindeuten (Abbildung 2 und Abbildung 3).
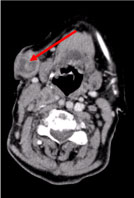 Abbildung 2: Hals-CT-Scan: Mehrere nekrotische zervikale Lymphknoten, der größte subkutan, 27 mm im Durchmesser (Pfeil). Abbildung 2
Abbildung 2: Hals-CT-Scan: Mehrere nekrotische zervikale Lymphknoten, der größte subkutan, 27 mm im Durchmesser (Pfeil). Abbildung 2
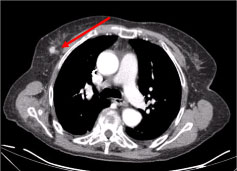 Abbildung 3: Thorax-CT-Scan: 10 mm große Läsion auf der rechten Brustdrüse, knotig-unregelmäßig, mit einem hyperschwächenden Zeichen, das auf eine Gefäßbildung hindeutet (Pfeil). Siehe Abbildung 3
Abbildung 3: Thorax-CT-Scan: 10 mm große Läsion auf der rechten Brustdrüse, knotig-unregelmäßig, mit einem hyperschwächenden Zeichen, das auf eine Gefäßbildung hindeutet (Pfeil). Siehe Abbildung 3
Eine offene Biopsie wurde durchgeführt, die eine Weichteilinfiltration durch polymorphe nukleäre Leukozyten und Histiozyten sowie eine Vaskulitis zeigte. Gram-, Grocott-, Ziehl-Neelsen- und PAS-Färbungen waren negativ; der auf der Polymerase-Kettenreaktion (PCR) basierende Test zum Nachweis von Mycobacterium tuberculosis im Gewebe war ebenfalls negativ.
Die Patientin wurde entlassen und in den Kliniken für Brust- und Kieferchirurgie weiterbehandelt.
In der Klinik für Brustchirurgie wurde eine ultraschallgesteuerte Kernnadelbiopsie der Brustläsion durchgeführt. Es wurde ein invasives Mammakarzinom NOS, Grad 1, diagnostiziert. Der Tumor war ER-positiv (90 %), PR-positiv (90 %), HER2 2+ durch Immunhistochemie, ISH negativ, mit einem Proliferationsindex (Ki67) von 10 % (molekularer Subtyp Luminal A) (Abbildung 4). Es wurde als cT1N0M0 eingestuft. Zu diesem Zeitpunkt begann die Patientin mit der Einnahme von Tamoxifen.
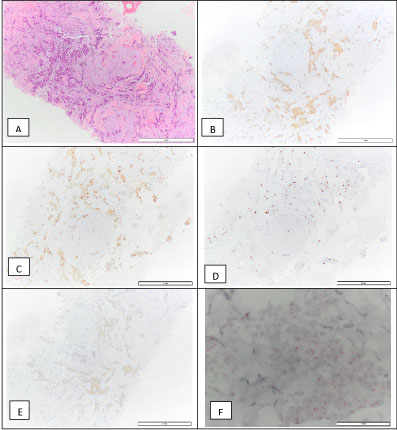 Abbildung 4: Biopsie des invasiven Mammakarzinoms: H&E (A), positiv für den Östrogenrezeptor – 90 % (B), positiv für den Progesteronrezeptor – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E) und eine negative D-ISH HER2-Amplifikation (F), was mit einem molekularen Subtyp Luminal A vereinbar ist. Abbildung 4
Abbildung 4: Biopsie des invasiven Mammakarzinoms: H&E (A), positiv für den Östrogenrezeptor – 90 % (B), positiv für den Progesteronrezeptor – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E) und eine negative D-ISH HER2-Amplifikation (F), was mit einem molekularen Subtyp Luminal A vereinbar ist. Abbildung 4
Zwei Monate später war die Mykobakterienkultur der offenen Biopsie positiv für Mycobacterium tuberculosis complex, empfindlich gegen alle Erstlinienantibiotika. Der Patient begann eine Therapie mit Erstlinien-Antituberkulostatika (300 mg Isoniazid, 600 mg Rifampicin, 1500 mg Pyrazinamid und 1200 mg Ethambutol für 2 Monate, gefolgt von 4 Monaten 300 mg Isoniazid und 600 mg Rifampicin) und wurde zur Nachsorge in die Tuberkuloseklinik überwiesen.
Der Patient starb 1 Jahr nach der Erstdiagnose.
Diskussion
Wie bereits erwähnt, wird die Diagnose einer Halsmasse von mehreren Faktoren beeinflusst. Alter und Gebrechlichkeit sind wichtige Faktoren, die berücksichtigt werden müssen.
Das Altern ist mit einer Abnahme der Immunantwort verbunden, die oft als Immunoseneszenz bezeichnet wird. Sie betrifft sowohl das adaptive als auch das angeborene System, und zwar auf unterschiedliche Weise. Das adaptive Immunsystem ist häufig in seiner Funktion eingeschränkt, in der Regel durch eine Abnahme der T-Zellen-Aktivität. Andererseits wird das angeborene Immunsystem als übermäßig stark beschrieben, da es an Regulationsfähigkeit verliert, was zu einem entzündungsfördernden Zustand führen kann, der ebenfalls nachteilig ist. Die Immunoseneszenz wird mit einer Zunahme der Häufigkeit und Schwere von Infektionen, einer geringeren Immunüberwachung bösartiger Zellen und einer verminderten Wirksamkeit von Impfungen in Verbindung gebracht.
Die Immunoseneszenz trägt also dazu bei, dass bei älteren Menschen häufiger Krebs diagnostiziert wird, wobei das Durchschnittsalter bei der Diagnose bei 70 Jahren liegt. Andere Faktoren spielen eine Rolle, wie z. B. die längere Zeit, die ältere Zellen der Krebsentstehung ausgesetzt sind, oder die höhere Anfälligkeit älterer Zellen für die Krebsentstehung, aber auch die verstärkte paradoxe Entzündungsreaktion.
Infektionen treten bei älteren Menschen häufiger auf, insbesondere Infektionen der Atemwege, die mit einer hohen Sterblichkeit verbunden sind. Tuberkulose ist ein wichtiges Problem für die öffentliche Gesundheit, von dem weltweit 9,6 Millionen Menschen betroffen sind und das in der Bevölkerung über 65 Jahren zunimmt. Es wurde vermutet, dass die Tuberkulose bei älteren Menschen häufig auf die Reaktivierung einer latenten Tuberkulose zurückzuführen ist, da die zelluläre Immunantwort nachlässt. Sie kann jedoch auch durch eine Primärinfektion oder eine Reinfektion bei einem zuvor behandelten Patienten verursacht werden. Andere Faktoren erhöhen das Tuberkuloserisiko bei älteren Menschen, wie z. B. der Aufenthalt in einem Pflegeheim, der das Risiko um das 2-3fache erhöht. Einige Komorbiditäten wie Diabetes mellitus, chronisch obstruktive Lungenerkrankung, Lebererkrankung, Malignität und kardiovaskuläre Erkrankungen, immunsuppressive Therapien mit Kortikoiden und Anti-TNF und Unterernährung.
Tuberkulose bei älteren Menschen hat ein atypisches klinisches Erscheinungsbild. In 75 % der Fälle ist die Hauptpräsentation pulmonal, aber extrapulmonale Stellen sind häufiger. Organspezifische Symptome sind seltener, und die Patienten weisen eher vage Symptome wie Asthenie und kognitive Beeinträchtigung auf. Die Diagnose ist auch schwieriger, da ältere Menschen häufig chronische Anomalien aufweisen, wie z. B. abnorme Leberenzyme, Hypoalbuminämie, Hyponatriämie, Hypokaliämie und Anämie. Röntgenologisch sind weniger chronische Veränderungen festzustellen. Der Tuberkulin-Hauttest ist aufgrund einer Anergie oft unbestimmt, und es besteht die Notwendigkeit einer Wiederholung unter Ausnutzung des Boost-Effekts. Probenkulturen können negativ sein. Die Behandlung ist auch bei älteren Menschen eine Herausforderung, da die Compliance schlechter ist und die Polypharmazie mit einem erhöhten Risiko für Toxizität, insbesondere Hepatotoxizität, einhergeht. Auch die Sterblichkeitsrate ist deutlich höher, nämlich bis zum 10-fachen.
Dieser Fallbericht veranschaulicht die Herausforderungen bei der Diagnose einer Halsmasse bei älteren Menschen. Lokale Entzündungszeichen deuteten auf eine Infektion hin, aber die systemischen Symptome ließen den Verdacht auf ein malignes Geschehen aufkommen. Im Nachhinein können wir argumentieren, dass mehrere Anzeichen und Labortests auf eine Tuberkulose hindeuten könnten, z. B. Entzündungszeichen, Antibiotikaresistenz, Anämie und Hyponatriämie. Die gleichzeitige Diagnose eines invasiven Mammakarzinoms war ein Zufallsbefund. Es kann jedoch davon ausgegangen werden, dass die Krebserkrankung zur Immunoseneszenz beigetragen und die Reaktivierung einer latenten Tuberkulose begünstigt hat.
Finanzielle Unterstützung
Es gab keine finanzielle Unterstützung.
Beitrag der Autoren
Alle Autoren trugen gleichermaßen bei.
- Gleeson M, Herbert A, Richards A (2000) Management of lateral neck masses in adults. BMJ 320: 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66: 831-838.
- Armstrong WB, Giglio MF (1998) Is this lump in the neck anything to worry about? Postgrad Med 104.
- Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.
- Barnes L (1996) Pathology of the head and neck: General considerations. (3rd edn), In: Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1: 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana, and B. bacilliformis: historical pathogens of emerging significance. Microbes Infect 2: 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 9: 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33: 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Inflammatory pseudotumor of the parapharyngeal space: case report and review of the literature. Head Neck 14: 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimura’s disease: two case reports and a literature review. Ann Otol Rhinol Laryngol 107: 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castleman’s disease): a report of five cases. Otolaryngol Head Neck Surg 113: 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologic manifestations of sarcoidosis: presentation and diagnosis. Laryngoscope 107: 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8: 91-97.
- Ponnappan S, Ponnappan U (2011) Aging and immune function: molecular mechanisms to interventions. Antioxid Redox Signal 14: 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Immunosenescence of aging. J Pathol 211: 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) The aging immune system and its relationship with cancer. Aging health 7: 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Effects of aging on human leukocytes (part I): immunophenotyping of innate immune cells. Age (Dordr) 37: 92.
- Mcelhaney JE, Effros RB (2009) Immunosenescence: what does it mean to health outcomes in older adults? Curr Opin Immunol 21: 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) Cancer survival and incidence from the Surveillance, Epidemiology, and End Results (SEER) program. Oncologist 8: 541-552.
- Finkel T, Serrano M, Blasco MA (2007) Die gemeinsame Biologie von Krebs und Alterung. Nature 448: 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, aging and cancer. Mech Ageing Dev 130: 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2: 801-810.
- Bellmann-Weiler R, Weiss G (2009) Pitfalls in the diagnosis and therapy of infections in elderly patients–a mini-review. Gerontology 55: 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) The strategic framework of tuberculosis control and prevention in the elderly: a scoping review towards End TB targets. Infect Dis Poverty 6: 70.
- Byng-Maddick R, Noursadeghi M (2016) Does tuberculosis threaten our ageing populations? BMC Infect Dis 16: 119.
- Negin J, Abimbola S, Marais BJ (2015) Tuberculosis among older adults–time to take notice. Int J Infect Dis 32: 135-137.
- Rajagopalan S (2001) Tuberculosis and aging: a global health problem. Clin Infect Dis 33: 1034-1039.
- Rajagopalan S (2016) Tuberculosis in Older Adults. Clin Geriatr Med 32: 479-491.
- Chan E (2006) Tuberculosis in the elderly: Keep a high index of suspicion. Journal of Respiratory Diseases 27: 307-315.
- Jeon CY, Murray MB (2008) Diabetes mellitus erhöht das Risiko einer aktiven Tuberkulose: eine systematische Überprüfung von 13 Beobachtungsstudien. PLoS Med 5: e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, et al. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5: e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, et al. (2015) Increased risk of mycobacterial infections associated with anti-rheumatic medications. Thorax 70: 677-682.
- Morris CD (1990) Pulmonale Tuberkulose bei älteren Menschen: eine andere Krankheit? Thorax 45: 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) Does aging modify pulmonary tuberculosis?: A meta-analytical review. Chest 116: 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77: 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberculosis in the geriatric patient. J Am Geriatr Soc 31: 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Clinical characteristics and treatment outcomes of tuberculosis in the elderly: a case control study. BMC Infect Dis 13: 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119: 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Mortality among tuberculosis patients in The Netherlands in the period 1993-1995. Eur Respir J 11: 816-820.
Citation
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) A Submandibular Mass in an Elderly Patient. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064