Sublimation ist der Prozess, bei dem ein Material von einem gefrorenen Feststoff in ein Gas übergeht, ohne den flüssigen Zwischenzustand zu durchlaufen.
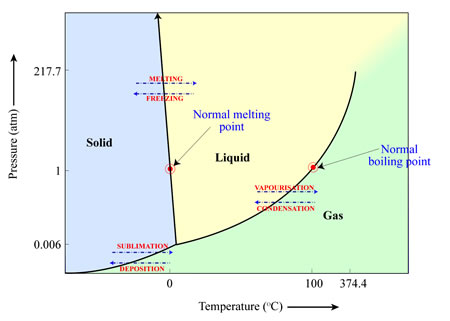
Ob ein Material sublimiert (von einem Feststoff in ein Gas), schmilzt (von einem Feststoff in eine Flüssigkeit) oder verdampft (von einer Flüssigkeit in ein Gas), hängt von der Temperatur und dem Druck der Umgebung ab, in der es sich befindet. Dies kann in einem “Phasendiagramm” wie dem folgenden für Wasser veranschaulicht werden. In diesem Fall und bei den auf der Erde üblichen Drücken (1 Atmosphäre) und Temperaturen (25 Grad Celsius) schmilzt das Wassereis und bildet flüssiges Wasser, das dann zu Wasserdampf verdampft. Wenn jedoch der Druck niedrig genug ist (z. B. der Druck, den wir anderswo im Sonnensystem vorfinden), verwandelt sich das Wassereis bei steigender Temperatur direkt in Wasserdampf und umgeht das Stadium des flüssigen Wassers.
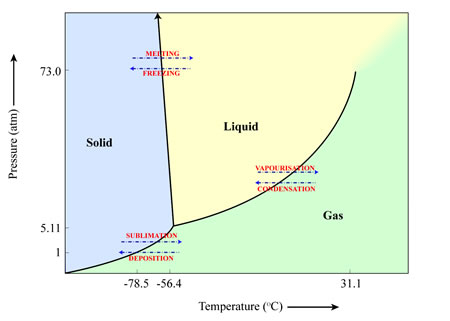
Sublimation kommt an vielen Orten im Sonnensystem vor. Zwei Beispiele sind:
- Die Sublimation von Wasser aus Kometenkernen bei der Annäherung des Kometen an die Sonne’
- Die Sublimation der Polkappen auf dem Mars während des Marssommers.
Ein Beispiel für ein Material, das hier auf der Erde sublimiert, ist gefrorenes Kohlendioxid (CO2) – besser bekannt als “Trockeneis”. Wenn es bei Raumtemperatur und einem Druck von 1 Atmosphäre der Luft ausgesetzt wird, verwandelt sich das gefrorene CO2 direkt in gasförmiges CO2.