Dies ist ein kurzer Überblick über die Informationen im Zusammenhang mit der FDA-Zulassung für die Vermarktung dieses Produkts. Weitere vollständige Informationen über dieses Produkt, seine Anwendungsgebiete und die Grundlage für die FDA-Zulassung finden Sie unter den nachstehenden Links zur Zusammenfassung der Sicherheits- und Wirksamkeitsdaten (SSED) und zur Produktkennzeichnung.
Produktname: Axonics Sacral Neuromodulation System
PMA Antragsteller: Axonics Modulation Technologies, Inc.
Adresse: 26 Technology Drive, Irvine, CA 92618
Zulassungsdatum: November 13, 2019
Genehmigungsschreiben: Approval Order
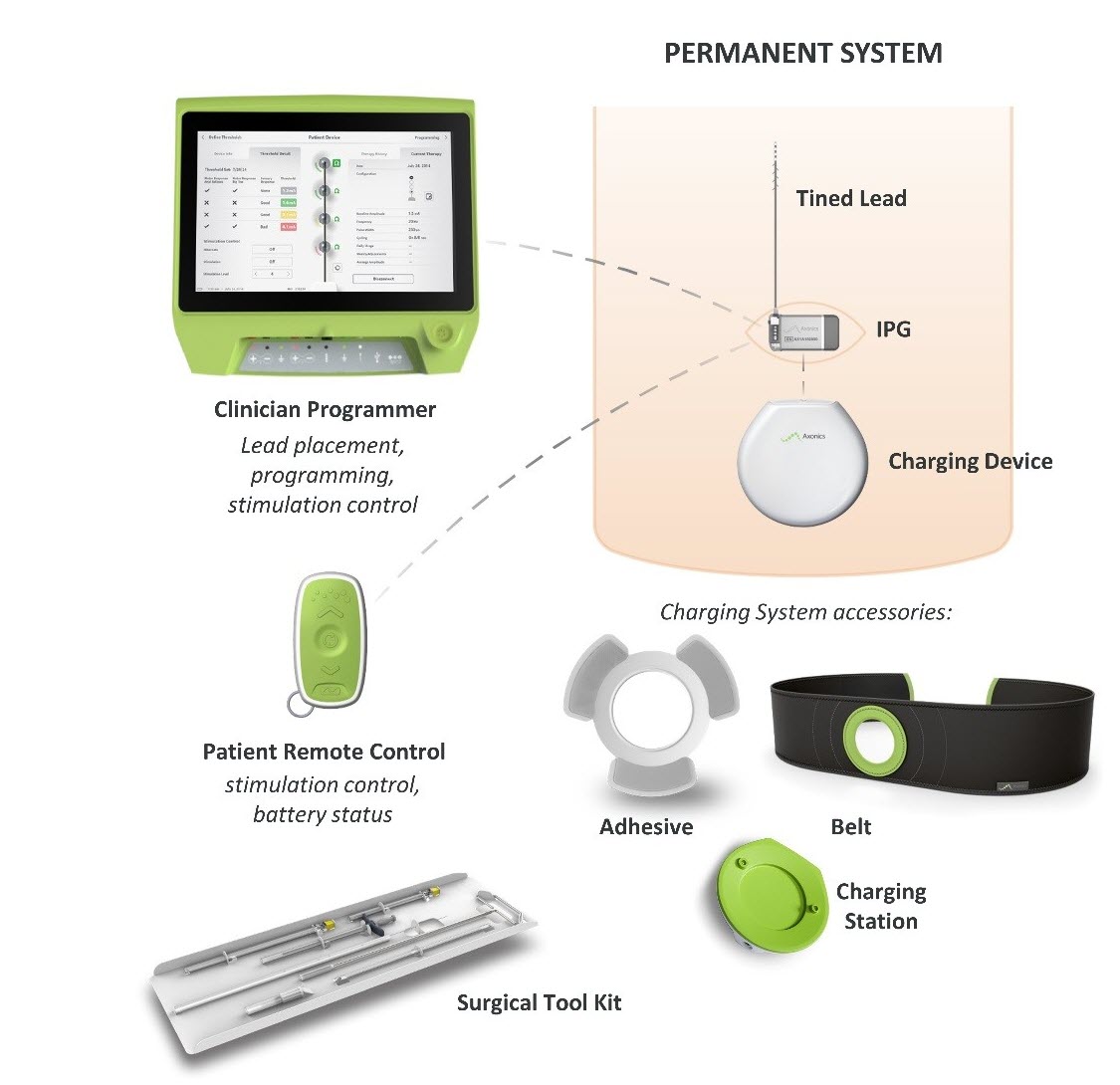
Was ist das? Das Axonics System zur sakralen Neuromodulation (SNM) ist ein System zur sakralen Nervenstimulation (SNS), das zur Behandlung des Harnverhalts und der Symptome einer überaktiven Blase bestimmt ist. Es verwendet einen implantierten Stimulator, der elektrische Impulse über einen Leitungsdraht an Elektroden in der Nähe des Sakralnervs abgibt.
Wie funktioniert es? Ein implantierbarer Impulsgenerator (IPG) wird chirurgisch unter der Haut im oberen Gesäßbereich platziert und mit einem Leitungsdraht verbunden, der zwischen den Hüftknochen des Beckens verläuft und am Sakralnerv endet. Das IPG sendet elektrische Impulse durch den Leitungsdraht an den Sakralnerv, der vom Rückenmark zur Blase verläuft, um die Harnkontrolle zu verbessern.
Wann wird es eingesetzt? Das Axonics SNM-System zur Harnkontrolle wird zur Behandlung von Harnverhalt und den Symptomen einer überaktiven Blase bei Patienten eingesetzt, bei denen andere Behandlungen wie Lebensstiländerungen, Beckenbodentraining oder Medikamente versagt haben oder nicht vertragen wurden. Unbehandelt können Harnverhalt und überaktive Blase die Lebensqualität der Patienten einschränken und zu erheblichen Schwierigkeiten bei der Aufrechterhaltung der Aktivitäten des täglichen Lebens führen.
Was wird es bewirken? Die Ergebnisse einer klinischen Studie zum Axonics SNM-System in Verbindung mit zusätzlichen klinischen Daten, die aus einer systematischen Überprüfung der für ein ähnliches SNM-Gerät verfügbaren Literatur zusammengetragen wurden, zeigen, dass die meisten Patienten mit Harnverhalt und den Symptomen einer überaktiven Blase, bei denen andere Behandlungen versagt haben oder nicht vertragen wurden, davon profitieren können. In der klinischen Axonics-Studie an Patienten mit Drangharninkontinenz erreichten 90 % (116/129) der Patienten mit dem implantierten SNM-System nach sechs Monaten eine mindestens 50 %ige Verringerung der Zahl der Harnverluste im Vergleich zu der Zahl der Harnverluste ohne das SNM-System. In einer längerfristigen Studie (van Kerrebroeck, 2007) wurden 152 Patienten, denen ein ähnliches SNM-System implantiert wurde, 5 Jahre lang beobachtet. Nach 5 Jahren hatten 58 % (56/96) der Patienten mit Dranginkontinenz eine mindestens 50-prozentige Verbesserung (gemessen an der Anzahl der Leckagen pro Tag). Darüber hinaus hatten nach 5 Jahren 40 % (10/25) der Patienten mit Dranghäufigkeit eine mindestens 50-prozentige Verbesserung (gemessen an der Anzahl der Entleerungen pro Tag), und 58 % (18/31) der Patienten mit Harnverhalt hatten eine mindestens 50-prozentige Verbesserung (gemessen an der Anzahl der Katheterisierungen pro Tag). In Anbetracht der Ähnlichkeiten in Bezug auf Design, Technologie, Leistung, Anwendungsindikationen, Leistungsmerkmale und die zu behandelnde Patientenpopulation ist die FDA der Ansicht, dass das Axonics SNM System eine ähnliche Leistung wie das in den veröffentlichten Studien untersuchte kommerziell erhältliche SNM System aufweist.
Wann sollte es nicht verwendet werden? Das Axonics SNM System sollte nicht angewendet werden bei:
- Patienten, die keine angemessene Reaktion auf die Teststimulation gezeigt haben; oder
- Patienten, die nicht in der Lage sind, das Axonics SNM System zu bedienen
Zusätzliche Informationen (einschließlich Warnhinweise, Vorsichtsmaßnahmen und unerwünschte Ereignisse):
- Zusammenfassung der Daten zur Sicherheit und Wirksamkeit
- Patientenkennzeichnung
- Arztkennzeichnung
- PMA-Datenbankeintrag