Relations entre pression, volume et température dans les gaz réels
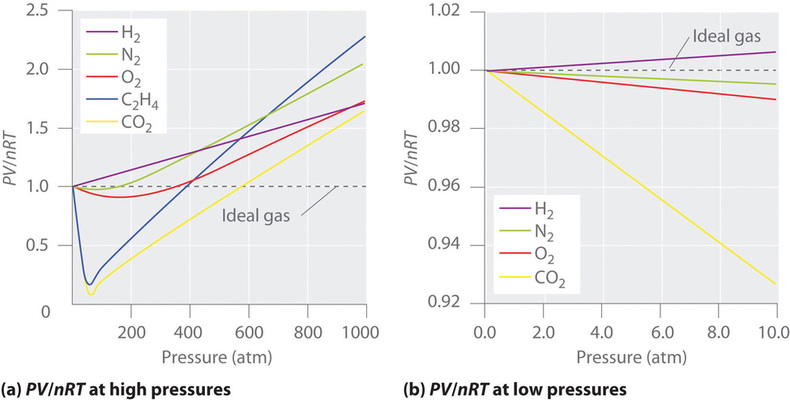
Pour un gaz idéal, un tracé de \(PV/nRT\) en fonction de \(P\) donne une ligne horizontale avec une interception de 1 sur l’axe \(PV/nRT\). Les gaz réels présentent toutefois des écarts significatifs par rapport au comportement attendu d’un gaz idéal, en particulier à des pressions élevées (figure \(\PageIndex{1a}\)). Ce n’est qu’à des pressions relativement basses (inférieures à 1 atm) que les gaz réels se rapprochent du comportement du gaz idéal (figure \(\PageIndex{1b}\)).
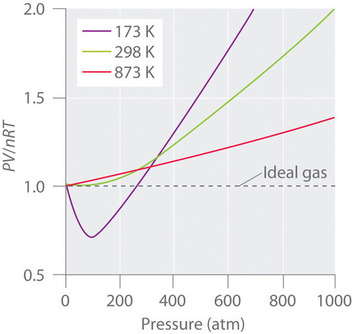
Les gaz réels se rapprochent également plus du comportement des gaz idéaux à des températures plus élevées, comme le montre la figure \(\PageIndex{2}\) pour \(N_2\). Pourquoi les gaz réels se comportent-ils si différemment des gaz idéaux à haute pression et basse température ? Dans ces conditions, les deux hypothèses de base de la loi des gaz idéaux, à savoir que les molécules de gaz ont un volume négligeable et que les interactions intermoléculaires sont négligeables, ne sont plus valables.
Parce que les molécules d’un gaz idéal sont supposées avoir un volume nul, le volume dont elles disposent pour se déplacer est toujours le même que le volume du récipient. En revanche, les molécules d’un gaz réel ont des volumes petits mais mesurables. À basse pression, les molécules gazeuses sont relativement éloignées les unes des autres, mais à mesure que la pression du gaz augmente, les distances intermoléculaires deviennent de plus en plus petites (figure \(\PageIndex{3}\)). Par conséquent, le volume occupé par les molécules devient important par rapport au volume du récipient. Par conséquent, le volume total occupé par le gaz est supérieur au volume prédit par la loi des gaz idéaux. Ainsi, à des pressions très élevées, la valeur de PV/nRT mesurée expérimentalement est supérieure à la valeur prédite par la loi des gaz idéaux.
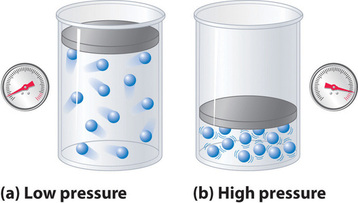
De plus, toutes les molécules sont attirées les unes vers les autres par une combinaison de forces. Ces forces deviennent particulièrement importantes pour les gaz à basse température et à haute pression, où les distances intermoléculaires sont plus courtes. Les attractions entre molécules réduisent le nombre de collisions avec la paroi du récipient, un effet qui s’accentue à mesure que le nombre d’interactions attractives augmente. Comme la distance moyenne entre les molécules diminue, la pression exercée par le gaz sur la paroi du récipient diminue, et la pression observée est inférieure à celle attendue (figure \(\PageIndex{4}\)). Ainsi, comme le montre la figure \(\PageIndex{2}\), à basse température, le rapport de \(PV/nRT\) est inférieur à celui prédit pour un gaz idéal, un effet qui devient particulièrement évident pour les gaz complexes et pour les gaz simples à basse température. À très haute pression, l’effet du volume moléculaire non nul prédomine. La compétition entre ces effets est responsable du minimum observé dans le tracé \(PV/nRT\) en fonction de \(P\) pour de nombreux gaz.
Le volume moléculaire non nul rend le volume réel plus grand que prévu à des pressions élevées ; les attractions intermoléculaires rendent la pression inférieure à celle prévue.
A des températures élevées, les molécules ont une énergie cinétique suffisante pour surmonter les forces d’attraction intermoléculaires, et les effets du volume moléculaire non nul prédominent. À l’inverse, lorsque la température est abaissée, l’énergie cinétique des molécules de gaz diminue. Finalement, on atteint un point où les molécules ne peuvent plus surmonter les forces d’attraction intermoléculaires, et le gaz se liquéfie (se condense en liquide).