- Qu’est-ce qu’une liaison covalente polaire ?
- Propriétés des liaisons covalentes polaires
- Exemples de liaisons covalentes polaires
- Eau (H2O)
- Chlorure d’hydrogène (HCl)
- Ammonia (NH3)
- Bromure d’hydrogène (HBr)
- Différence entre les liaisons covalentes polaires et non polaires
- La liaison covalente polaire vs. Liaison Covalente Non Polaire
Qu’est-ce qu’une liaison covalente polaire ?
Une liaison covalente est formée lorsque deux atomes partagent des électrons entre eux. La liaison covalente est susceptible d’être polaire lorsque les électrons sont partagés de manière inégale. L’asymétrie est due à la différence entre les électronégativités des deux atomes. L’électronégativité est une mesure de la tendance d’un atome à attirer une paire d’électrons de liaison. Elle est mesurée à l’aide d’une échelle connue sous le nom d’échelle de Pauling et varie de 0,7 à 4. Le tableau suivant explique le type de liaison chimique formé en raison de cette différence d’électronégativité .
| Type de liaison chimique | Différence d’électronégativité |
|---|---|
| Covalent non polaire | 0 |
| Covalent légèrement polaire | 0.1 à 0,4 |
| Covalent polaire | 0,5 à 2 |
| Ionique | > 2 |
Plus la différence d’électronégativité est importante, plus la polarité et la force de la liaison sont grandes. Par conséquent, les liaisons covalentes polaires ont une force de liaison intermédiaire.
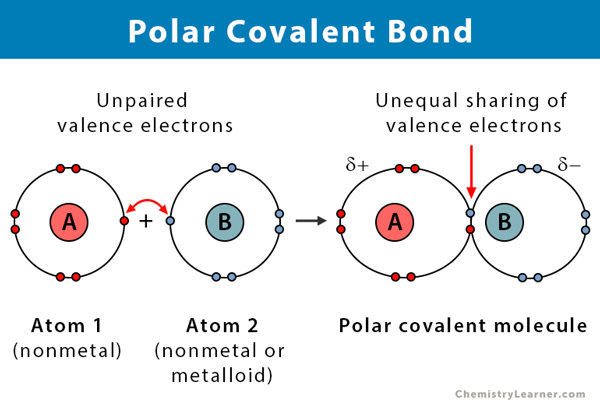
Propriétés des liaisons covalentes polaires
Voici quelques faits sur les liaisons covalentes polaires.
- A lieu entre deux non-métaux ou entre un non-métal et un métalloïde
- Partage inégal des électrons dans un composé
- La différence d’électronégativité entre les atomes est comprise entre 0.1 et 2
- Une extrémité de la liaison est chargée positivement, et l’autre extrémité est chargée négativement
- Les composés polaires se dissolvent dans un solvant polaire
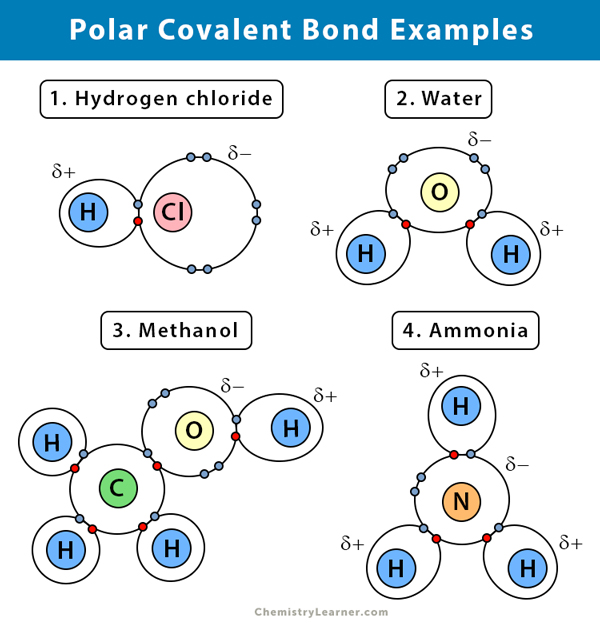
Exemples de liaisons covalentes polaires
Voici quelques exemples de liaison covalente polaire avec la différence d’électronégativité entre les deux atomes de liaison :
| Nom du composé | Formule moléculaire | Liaison | Electronégativité. différence |
|---|---|---|---|
|
Eau |
H2O |
O-H |
|
| Fluorure d’hydrogène | HF | H-F | 1.9 |
| Chlorure d’hydrogène | HCl |
H-Cl |
0.9 |
|
Bromure d’hydrogène |
HBr |
H-Br |
|
|
Ammonia |
NH3 |
N-H |
|
|
Dioxyde de soufre |
SO2 | S=O | 1 |
| Sulfure d’hydrogène | H2S | H-S | 0.4 |
| Méthanol | CH3OH | O-H | 1,4 |
Une explication de la liaison covalente polaire dans certains composés est donnée ci-dessous.
Eau (H2O)
L’eau est un solvant polaire. Une liaison covalente polaire est créée lorsque l’atome d’oxygène (O), étant plus électronégatif que l’hydrogène, tire les électrons partagés vers lui. Par conséquent, l’atome d’oxygène est associé à une charge négative partielle. Les hydrogènes (H), quant à eux, sont essentiellement des protons et ont une charge positive partielle qui leur est associée.
Chlorure d’hydrogène (HCl)
Le chlorure d’hydrogène est un composé covalent polaire car l’atome de chlore (Cl) est plus électronégatif que l’atome d’hydrogène (H). Ainsi, le chlore porte une charge négative partielle, tandis que l’hydrogène porte une charge positive partielle.
Ammonia (NH3)
L’ammoniaque est une molécule polaire. L’atome central, l’azote (N), est lié à trois atomes d’hydrogène (H). Comme N est plus électronégatif que H, les électrons auront tendance à s’accrocher autour de l’atome de N.
Bromure d’hydrogène (HBr)
La différence d’électronégativité entre l’hydrogène (H) et le brome (Br) n’est pas trop élevée. Par conséquent, le gaz HBr a une liaison covalente polarisée, et l’atome d’hydrogène a une légère charge positive, et le brome a une légère charge négative. Par conséquent, le couple d’électrons est attiré par le brome.
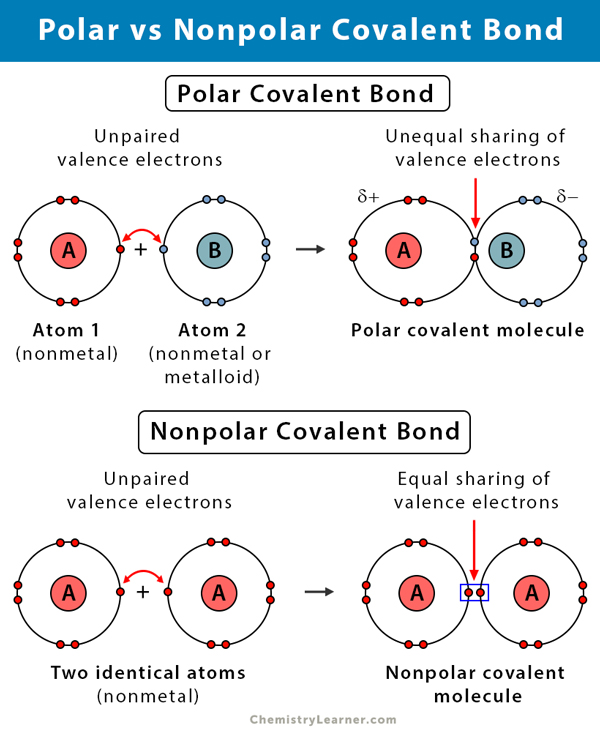
Différence entre les liaisons covalentes polaires et non polaires
Le tableau suivant compare et oppose les liaisons covalentes polaires et non polaires.
La liaison covalente polaire vs. Liaison Covalente Non Polaire |
||
| Polaire | Non polaire | |
|---|---|---|
|
Types d’atomes |
Entre deux non-métaux ayant des électronégativités différentes |
Entre deux non-métaux de mêmes électronégativités |
|
Différence d’électronégativité |
0.1 – 2 |
|
|
Répartition des électrons |
Asymétrique. Partage inégal. |
Symétrique. Partage égal. |
|
Déplacement des électrons partagés |
Vers l’atome le plus électronégatif, rendant cette partie négative |
Pas de déplacement. Électriquement neutre. |
|
Moment dipolaire |
Non-zéro |
Zéro |
|
Présence d’autres types de liaisons dans les composés |
Liaison hydrogène |
Liaison Van der Waals |
|
Affinité pour l’eau |
Hydrophile |
Hydrophobe |
|
Propriétés physiques des composés |
Points de fusion et d’ébullition élevés |
Points de fusion et d’ébullition bas |
|
Volatilité des liquides |
Faible volatilité |
Haute volatilité |
|
Solubilité des composés |
Soluble dans les solvants polaires |
Soluble dans les solvants non polaires |
|
Exemples |
Eau (H2O), ammoniac (NH3) et chlorure d’hydrogène (HCl) |
Hydrogène (H2), oxygène (O2) et azote (N2) |
.