- Qu’est-ce que l’aluminium
- Où peut-on le trouver
- Histoire
- Classification, propriétés et caractéristiques de l’aluminium
- Propriétés générales
- Propriétés physiques
- Propriétés chimiques
- Données atomiques de l’aluminium
- À quoi sert couramment l’aluminium
- L’élément a-t-il des effets toxiques
- Faits intéressants
- Prix de l’aluminium
Qu’est-ce que l’aluminium
L’aluminium (prononcé comme ah-LOO-men-em) est un métal mou et léger, représenté par le produit chimique Al. Il existe sous la forme de plusieurs composés minéraux, ayant un large éventail d’utilisations commerciales en raison de sa nature non toxique et de sa grande résistance à la corrosion. Il possède 15 isotopes avec des numéros de masse allant de 22 à 35 dont seul l’Al-26 est radioactif avec une demi-vie de 7,17×105 ans et l’Al-27 existe à l’état naturel.

Où peut-on le trouver
L’élément constitue environ 8,1% de la croûte terrestre ce qui en fait l’un des métaux les plus abondants. On peut le trouver combiné à d’autres métaux sous forme de minéraux silicatés comme la cryolite et la bauxite. Sa production à l’échelle commerciale se fait par un procédé chimique coûteux appelé procédé Hall-Heroult qui implique une grande quantité d’énergie.
Histoire
Origine de son nom : Son nom est dérivé du mot latin pour alun appelé “alumen” qui signifie sel amer .
Qui l’a découvert : Hans Oersted
Quand, où et comment a-t-il été découvert
On croyait au cours du 3e siècle en Chine que la tombe d’un chef militaire appelé Chou-Chu contenait environ 85% d’aluminium. Dans les années 1700, la présence de l’oxyde du métal a également été inventée, mais aucune analyse plus poussée n’a pu être faite. En fait, le chimiste cornouaillais Henry Davy a essayé d’extraire le sodium et le potassium de leurs oxydes respectifs, mais l’Al n’a pu être obtenu.
Ce n’est qu’en 1825 qu’Oersted, à Copenhague, au Danemark, a chauffé du chlorure d’aluminium avec du potassium et a extrait une forme impure du métal. En 1827, Friedrich Wohler, le chimiste allemand, a finalement répété la méthode en utilisant du sodium et a obtenu un échantillon pur .

Classification, propriétés et caractéristiques de l’aluminium
Propriétés générales |
|
| Masse atomique relative/moyenne | 26.982 |
| Masse atomique/poids | 26,982 unités de masse atomique |
| Masse molaire/poids moléculaire | 26.982 g/mol |
| Nombre de masse | 27 |
Propriétés physiques |
|
| Couleur/aspect physique | Blanc argenté |
| Point de fusion/point de congélation | 660.323°C (1220,581°F) |
| Point d’ébullition | 2519°C (4566°F) |
| Densité | 2.70 g/cm3 |
| Norme/Etat physique de la matière à température ambiante normale (solide/liquide/gaz) | Solide |
| Ductilité | Oui |
| Malléabilité | Oui |
| Dureté | 2.9 Mohs |
| Conductivité électrique | 37.6676 x 106 Sm-1 |
| Conductivité thermique | 237 Wm-1K-1 |
| Capacité thermique spécifique | 0.90 Jg-1K-1 |
| Gravité spécifique | 2,8 |
| Résistivité | 2.65 x10-8ρ (ohm m) |
| Résistance à la traction | 90 Mpa |
| Coefficient de température | 0.00393 α/°C |
| La limite d’élasticité à la traction | 276 Mpa |
| Coefficient de dilatation thermique linéaire/transfert de chaleur | 23,1 10-6K-1 |
| Coefficient de friction | 1.35 |
Propriétés chimiques |
|
| Inflammabilité | Inflammable |
| États d’oxydation (nombres) | 3 |
Données atomiques de l’aluminium
| Électrons de valence | 1 | ||||||
| Configuration des électrons (configuration des gaz rares) | 3s23p1 | ||||||
| Structure cristalline | Face-cubique centrée | ||||||
| Constante du réseau/paramètre | 0.405 nm | ||||||
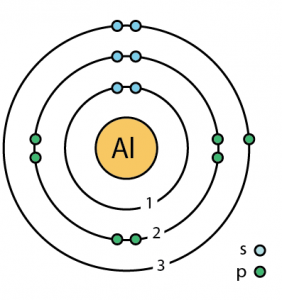
| Niveaux d’énergie | |||||||
| Premier niveau d’énergie | 2 | ||||||
| Deuxième niveau d’énergie | 8 | ||||||
| Troisième niveau d’énergie | 3 | ||||||
| Structure atomique | |||||||
| – Nombre d’électrons | 13 | ||||||
| – Nombre de neutrons | 14 | ||||||
| – Nombre de protons | 13 | ||||||
| Radius de l’atome | |||||||
| – Rayon atomique | 1.84 Å | ||||||
| – Rayon covalent | 1.24 Å | ||||||
| Electronégativité | 1.61 | ||||||
| Charge ionique | +1 | ||||||
| Énergie d’ionisation
(kJmol-1) |
1e | 2e | 3e | 4e | 5e | 6e | 7e |
| 577.539 | 1816.679 | 2744.781 | 11577.469 | 14841.857 | 18379.49 | 23326.3 | |
À quoi sert couramment l’aluminium
- Il est utilisé dans la vaste gamme de produits comme les panneaux de clôture, les revêtements, les canettes, les tubes, les tuyaux, les fils, les feuilles, les toitures, les fritures, les poêles, les rampes, les revêtements, les couvertures de patio, les roues, les baguettes de brasage, les portes moustiquaires, les radiateurs, les réservoirs de carburant de gaz et les poteaux .
- Bon conducteur d’électricité, l’Al constitue un substitut idéal du cuivre en termes de coût et de poids pour fabriquer des lignes de transmission électrique .
- L’aluminium est allié à d’autres métaux comme le cuivre, le magnésium, le silicium et le manganèse pour fabriquer des roulements à billes, des pièces automobiles, des fusées et des avions .
- Le métal est souvent utilisé comme revêtement réfléchissant sur les miroirs des télescopes, les jouets, les emballages et les papiers décoratifs pour protéger de la lumière et de la chaleur .
- En tant qu’alternative aux batteries coûteuses et aux carburants liquides, les piles à air/accumulateurs ioniques à combustible en aluminium sont plus pratiques et portables à utiliser .

L’élément a-t-il des effets toxiques
L’inhalation de poussières ou de fumées contenant de l’Al affecte le système respiratoire, provoquant de la toux et d’autres troubles liés aux poumons. L’ingestion prolongée du métal sous la forme de certains produits oraux peut être dommageable pour les reins ainsi qu’augmenter la possibilité de la maladie d’Alzheimer .

Faits intéressants
- Avant la découverte du procédé Hall-Heroult, l’Al pur était plus cher que l’or et donc appelé le “roi des métaux” .
- Le métal peut être recyclé plusieurs fois sans compromettre sa qualité .

Prix de l’aluminium
Le coût de l’aluminium pur peut varier quelque part entre 0,9 et 1 $.
- http://www.rsc.org/periodic-table/element/13/aluminium
- https://education.jlab.org/itselemental/ele013.html
- https://pubchem.ncbi.nlm.nih.gov/compound/aluminum#section=Computed-Properties
- https://www.chemicool.com/elements/aluminum.html
- http://hyperphysics.phy-astr.gsu.edu/hbase/Tables/rstiv.html
- https://www.tedpella.com/company_html/hardness.htm
- http://asm.matweb.com/search/SpecificMaterial.asp?bassnum=ma6061t6
- https://study.com/academy/answer/how-many-valence-electrons-does-aluminum-have.html
- http://www.chemicalelements.com/elements/al.html
- https://www.sciencedirect.com/science/article/pii/S0378775307002236
- https://www.atsdr.cdc.gov/phs/phs.asp?id=1076&tid=34