- Introduction
- Méthodes
- Données de distribution et classification des biomes
- Composition des espèces parmi les biomes
- Données sur les traits
- Mesure des hypervolumes de traits
- Distinction fonctionnelle et généralité
- Espace fonctionnel et similarité des biomes
- Résultats
- Discussion
- Défauts de connaissances
- Modèles communs au sein des biomes
- Comparaisons entre les biomes
- Conclusions
- Data Availability
- Contributions des auteurs
- Funding
- Déclaration de conflit d’intérêts
- Remerciements
- Matériel supplémentaire
Introduction
Les écologistes et les biogéographes organisent la biodiversité des plantes terrestres en biomes déterminés par le climat, dont les physionomies sont caractérisées par les formes de croissance et les traits fonctionnels des espèces dominantes (Moncrieff et al., 2016). En effet, le concept de biome a une longue histoire qui remonte à Carl Ludwig Willdenow et Alexander von Humboldt. Willdenow a reconnu que des climats similaires supportent des formes de végétation similaires, et Humboldt a observé l’association généralisée entre la distribution des plantes, leur physionomie et les facteurs environnementaux. Globalement, le concept de biome reflète l’hypothèse selon laquelle des pressions environnementales similaires sélectionnent des espèces ayant des attributs fonctionnels similaires, indépendamment de leur histoire évolutive. Dans le même temps, les biomes existants sur Terre sont, dans une certaine mesure, phylogénétiquement distincts, de nombreuses ou la plupart des espèces caractéristiques étant issues de lignées spécifiques présentant des adaptations clés non seulement à la sélection climatique mais aussi à des pressions supplémentaires telles que le feu ou les mégaherbivores (Woodward et al., 2004 ; Pennington et al., 2006 ; Donoghue et Edwards, 2014). Parce que les biomes représentent des régularités à grande échelle dans la végétation de la Terre, la compréhension des différences fonctionnelles entre les biomes est d’une importance critique pour modéliser le cycle global du carbone et le fonctionnement du système terrestre, y compris les réponses au changement global anthropique (Bonan et al, 2012 ; van Bodegom et al., 2014 ; Xia et al., 2015).
Les deux dernières décennies ont vu une croissance rapide de la compréhension de la dimension fonctionnelle de la biodiversité végétale à l’échelle continentale (Swenson et al., 2012 ; Lamanna et al., 2014 ; Šímová et al., 2018). De vastes efforts de synthèse et d’analyse des données ont permis de définir un espace limité de traits fonctionnels intégrant la variation de la taille globale de la plante, de l’économie foliaire et de l’hydraulique, connu sous le nom de spectres de traits fonctionnels (Wright et al., 2004 ; Díaz et al., 2016). Les spectres de traits fonctionnels définissent les compromis physiologiques et écologiques qui déterminent les stratégies d’histoire de vie des plantes (Westoby, 1998 ; Reich et al., 2003 ; Craine, 2009) et leur influence sur l’assemblage des communautés (Kraft et al., 2008), la fonction des écosystèmes (Lavorel et Garnier, 2002 ; Garnier et al., 2004 ; Kerkhoff et al., 2005 ; Cornwell et al., 2008), et même les taux d’évolution (Smith et Donoghue, 2008 ; Smith et Beaulieu, 2009). La généralité et l’utilité des spectres de traits fonctionnels des plantes ont accéléré leur intégration dans les modèles de distribution globale de la végétation (van Bodegom et al., 2014), du cycle biogéochimique (Bonan et al., 2012) et des services écosystémiques (Díaz et al., 2007 ; Cadotte et al., 2011 ; Lavorel et al., 2011). Cependant, peu d’études ont examiné des mesures complètes de la diversité fonctionnelle à l’échelle du biome pour les espèces et les formes de vie dominantes et subordonnées.
Il existe deux ensembles contrastés de prédictions sur la façon dont la diversité fonctionnelle varie entre des biomes climatiquement et physionomiquement distincts. D’une part, si la biodiversité des biomes reflète la variation de l’espace de niche écologique disponible, les biomes moins diversifiés sur le plan taxonomique devraient représenter un sous-ensemble plus petit et largement imbriqué de l’espace fonctionnel occupé par les biomes plus diversifiés. D’autre part, en raison de la nature globale des compromis fondamentaux dans la structure et la fonction des plantes, et des pressions de sélection similaires agissant de la même manière sur les espèces, les assemblages occupant des environnements différents peuvent en fait partager des zones similaires de l’espace des traits (Reich et al., 2003 ; Wright et al., 2004 ; Díaz et al., 2016). Des études récentes confirment que les relations entre le climat et la diversité fonctionnelle et taxonomique (c’est-à-dire la richesse en espèces) sont complexes et dépendent de l’échelle. Dans certains cas, la diversité fonctionnelle suit de près les gradients climatiques, avec une diversité fonctionnelle plus faible dans des conditions plus variables et extrêmes (Swenson et al., 2012 ; de la Riva et al., 2018), et le volume de l’espace fonctionnel dans les assemblages locaux s’étend avec l’augmentation de la richesse taxonomique (Lamanna et al., 2014 ; Li et al., 2018). Cependant, les analyses des pools d’espèces à l’échelle régionale suggèrent que de grands changements dans la richesse des espèces peuvent être associés à des impacts minimes sur la diversité fonctionnelle (Lamanna et al., 2014 ; Šímová et al., 2015). En outre, les réponses de la diversité taxonomique et fonctionnelle au climat peuvent différer entre les principales formes de croissance des plantes (Šímová et al., 2018), et la diversité relative des différentes formes de croissance peut changer de manière substantielle le long des gradients climatiques qui définissent les différents biomes (Engemann et al., 2016).
Les progrès dans l’analyse de la diversité fonctionnelle à l’échelle continentale à mondiale ont été limités en partie par les lacunes des données dans le catalogage des aspects taxonomiques, distributionnels, phylogénétiques et fonctionnels de la biodiversité (Hortal et al., 2015). En outre, même en tenant compte des données limitées disponibles, des défis informatiques importants sont associés à la normalisation et à l’intégration de grands ensembles de données disparates décrivant les distributions géographiques, les traits fonctionnels et les relations phylogénétiques des espèces (Violle et al., 2014). Ici, nous examinons la distribution de la diversité fonctionnelle des espèces végétales à travers les biomes de l’Amérique du Nord et du Sud en utilisant la base de données du réseau d’information botanique et d’écologie (BIEN ; Enquist et al., 2016 ; Maitner et al., 2018), qui rassemble des informations sur la distribution et les traits fonctionnels sur >100 000 espèces de plantes terrestres. Plus précisément, nous examinons la variation de la diversité fonctionnelle et du caractère distinctif des biomes, sur la base de cartes de distribution des espèces de plantes terrestres à une échelle de cellules de grille de 100 × 100 km et d’un ensemble de données complet de six traits fonctionnels qui reflètent les principaux axes de variation des stratégies écologiques.
Nos objectifs dans cette étude sont triples. Premièrement, afin de mettre en évidence les manques de données persistants, nous documentons l’étendue des données disponibles caractérisant la diversité fonctionnelle et le caractère distinctif des biomes. Deuxièmement, compte tenu des données disponibles, nous caractérisons la distribution de la diversité fonctionnelle au sein des biomes pour les formes de croissance dominantes et subordonnées. Ces analyses nous permettent de mieux quantifier le caractère distinctif fonctionnel d’un biome en identifiant les stratégies fonctionnelles les plus courantes des espèces les plus répandues au sein de celui-ci. Troisièmement, nous nous demandons si les biomes sont en fait caractérisés par des collections d’espèces fonctionnellement distinctes, sur la base du chevauchement des hypervolumes multidimensionnels dans l’espace des traits fonctionnels.
Méthodes
Données de distribution et classification des biomes
Pour réduire les effets du biais d’échantillonnage caractéristique des ensembles de données d’occurrence compilés à partir de plusieurs ressources, nous avons utilisé les cartes d’aire de répartition BIEN 2.0 pour 88 417 des espèces végétales distribuées en Amérique du Nord et du Sud (Goldsmith et al, 2016). La base de données BIEN intègre des observations végétales standardisées issues de spécimens d’herbiers et d’inventaires de parcelles de végétation. Les cartes de l’aire de répartition des espèces dans les bases de données BIEN ont été estimées à l’aide de l’une des trois approches suivantes, en fonction des occurrences disponibles pour chaque espèce. Pour les espèces ayant seulement une ou deux occurrences (environ 35 % des espèces), l’aire de répartition géographique a été définie comme une zone carrée de 75 000 km2 entourant chaque point de données. Les aires de répartition géographique des espèces ayant trois ou quatre occurrences ont été identifiées à l’aide d’une coque convexe (environ 15 % des espèces). Enfin, les cartes d’aire de répartition des espèces ayant au moins cinq occurrences ont été obtenues à l’aide de l’algorithme de modélisation de la distribution des espèces Maxent, en utilisant 19 couches climatiques comme variables prédictives et 19 vecteurs propres spatiaux comme filtres pour contraindre les sur-prédictions des modèles (voir Goldsmith et al, 2016 pour plus de détails sur la méthodologie des cartes d’aires de répartition).
Nous avons superposé les cartes d’espèces végétales BIEN 2.0 sur une carte quadrillée de 100 × 100 km avec une projection de Lambert Azimuthal Equal Area pour obtenir une matrice de présence/absence d’espèces pour chaque cellule de la grille. Sur la base de la classification des biomes d’Olson et al. (2001), nous avons attribué chaque cellule de la matrice à l’une des catégories de biomes. En raison des limitations de calcul pour les analyses ultérieures, nous avons joint certains biomes sur la base de leurs similitudes en matière de climat et de végétation et de littérature pour obtenir une classification générale telle que décrite dans le tableau 1 (à l’exclusion de Inland Water, Rock and Ice et Mangroves). Les écorégions du Chaco et de la Caatinga ont été classées respectivement comme des zones boisées xériques et des forêts sèches, en suivant Prado et Gibbs (1993), Pennington et al. (2000), Banda et al. (2016), Silva de Miranda et al. (2018).
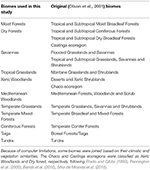
Tableau 1. Aperçu de la classification des biomes adoptée dans cette étude et de la classification équivalente (Olson et al., 2001) des biomes (à l’exclusion des eaux intérieures, des roches et de la glace, et des mangroves).
Composition des espèces parmi les biomes
Pour comprendre la variation de l’espace des traits fonctionnels entre les biomes, nous avons d’abord exploré les différences de composition des espèces végétales entre eux. Sur la base de la liste des espèces pour chaque cellule de grille et chaque biome, nous avons défini les espèces caractéristiques de chaque biome comme étant celles qui ont la proportion maximale de leur aire de répartition dans ce biome. Ces listes d’espèces géographiquement prédominantes dans un biome donné ont été comparées à la liste des espèces des autres biomes. Cette comparaison par paire fournit un moyen simple de déduire un chevauchement taxonomique directionnel entre les biomes (c’est-à-dire la proportion d’espèces prédominantes d’un biome partagé avec un autre biome). Sur les 88 417 espèces dont les cartes d’aire de répartition sont disponibles, 44 899 espèces ont des aires de répartition couvrant plus d’un biome, et 43 518 espèces sont endémiques à un biome spécifique.
Données sur les traits
Nous avons extrait toutes les informations sur les traits pour les espèces végétales du Nouveau Monde disponibles dans le jeu de données BIEN 3.0 (récupéré le 7 février 2018), ce qui donne un total de 80 405 observations de traits de niveaux d’espèces. Nous avons ensuite filtré les informations pour six traits fonctionnels : hauteur maximale de la plante (m), masse des graines (mg), densité du bois (mg/cm3), surface spécifique de la feuille SLA (cm2/g) et concentration de phosphore et d’azote foliaire par unité de masse (mg/g). Un total de 18 192 observations au niveau des espèces a été laissé après le filtrage. Parmi celles-ci, le sous-ensemble de 8 820 espèces disposant à la fois de cartes d’aires de répartition et d’informations sur les traits a été utilisé pour les analyses ultérieures.
Pour estimer l’espace fonctionnel des traits pour chaque biome, nous avions besoin de données complètes sur les traits. Pour cette raison, nous avons imputé phylogénétiquement les données de traits manquantes (Bruggeman et al., 2009 ; Penone et al., 2014 ; Swenson, 2014 ; Swenson et al., 2017) en utilisant le package R “Rphylopars” v 0.2.9 (Goolsby et al., 2017) et la phylogénie des plantes à graines récemment publiée par Smith et Brown (2018) comme référence. L’imputation phylogénétique est un outil permettant de prédire les données manquantes dans les ensembles de données sur les traits fonctionnels, en se basant sur l’hypothèse que les espèces étroitement apparentées ont tendance à avoir des valeurs de traits similaires (Swenson, 2014). Nous avons utilisé l’arbre ALLBM (c’est-à-dire la banque de gènes et les taxons de l’Open Tree of life avec une colonne vertébrale fournie par Magallón et al., 2015) car il maximisait le chevauchement entre les espèces avec des informations disponibles sur les traits et la distribution. Après l’imputation des traits, il restait un total de 7 842 espèces avec des informations complètes sur les traits et des cartes de répartition pour une analyse plus approfondie.
Mesure des hypervolumes de traits
Nous avons mesuré la diversité fonctionnelle relative des biomes en calculant les hypervolumes de traits à partir des pools d’espèces dans les cellules de biomes. En raison des limites de calcul, nous avons construit les hypervolumes de traits en utilisant un échantillon aléatoire de 20% des cellules de chaque biomes. Les hypervolumes pour chaque cellule de la grille ont été estimés à l’aide des six traits fonctionnels extraits et du package R “hypervolume” (Blonder et al., 2014, 2018), en utilisant la méthode KDE gaussienne avec l’estimateur de largeur de bande par défaut de Silverman. La masse des graines, la hauteur et la densité du bois ont été transformées en logarithme, tandis que l’ALS a été transformée en racine carrée. Tous les traits ont été mis à l’échelle et centrés avant l’analyse. Les hypervolumes sont rapportés en unités d’écarts types (sd) à la puissance du nombre de traits utilisés (c’est-à-dire sd6).
Distinction fonctionnelle et généralité
Parce que les biomes sont caractérisés par leur végétation dominante, nous avons également examiné la communeté géographique et la distinctivité fonctionnelle des espèces au sein des biomes. À l’aide des cartes de l’aire de répartition des espèces et des informations sur les traits fonctionnels, nous avons estimé le caractère distinctif fonctionnel et la généralité de chaque espèce dans chaque biome, en suivant le cadre conceptuel de la rareté fonctionnelle de Violle et al. (2017). En utilisant l’ensemble des traits (mesurés et imputés), nous avons d’abord mesuré la distance euclidienne dans l’espace standardisé des traits entre toutes les paires d’espèces. Nous avons ensuite calculé le caractère distinctif fonctionnel (Di) de chaque espèce dans chaque biome comme la distance fonctionnelle moyenne d’une espèce par rapport aux N autres espèces du pool d’espèces du biome. La Di a été mise à l’échelle entre 0 et 1 dans chaque biome, les valeurs les plus faibles représentant les espèces qui sont fonctionnellement communes (redondantes) et les valeurs les plus élevées représentant les espèces qui sont fonctionnellement distinctives, par rapport aux autres espèces du biome. Nous estimons également l’étendue géographique (Wi) d’une espèce dans un biome, mesurée comme le nombre de cellules de grille occupées par l’espèce dans un biome par rapport au nombre total de cellules dans ce biome. Une valeur de 1 indique que l’espèce focale est présente dans toutes les cellules de la grille couvertes par le biome. La distinctivité fonctionnelle et la généralité géographique ont toutes deux été calculées à l’aide du package R “funrar” (Grenié et al., 2017).
Parce que nous ne disposons pas de mesures complètes de la dominance basées sur l’abondance ou la biomasse locale, nous avons utilisé les mesures Di et Wi pour identifier pour chaque biome les espèces les plus “communes” comme étant celles qui sont à la fois géographiquement répandues (Wi > 0,5) et fonctionnellement similaires (Di < 0,25). Ce dernier seuil a été utilisé car le troisième quantile des valeurs de distinctivité fonctionnelle entre les biomes se situait entre 0,2 et 0,3. Pour distinguer les espèces fonctionnellement distinctes des espèces fonctionnellement similaires dans les analyses ultérieures, nous avons donc utilisé une valeur de 0,25 comme seuil (c’est-à-dire, espèces avec des valeurs de distinctivité < 0,25 ont été considérées comme fonctionnellement communes ou redondantes dans un biome spécifique).
Espace fonctionnel et similarité des biomes
Pour estimer le chevauchement entre les hypervolumes des biomes, nous avons employé l’indice de similarité de Sørensen en utilisant (i) le nombre total d’espèces et (ii) la liste des espèces considérées comme fonctionnellement communes et géographiquement répandues pour chaque biome. La similarité de l’espace des traits fonctionnels a été calculée comme le chevauchement fractionnel par paire des hypervolumes entre les biomes. Le chevauchement fractionnel a été calculé en divisant deux fois le volume de l’intersection de deux hypervolumes par le volume de leurs unions. Tous les hypervolumes ont été estimés à l’aide du paquet R “hypervolume” (Blonder et al., 2014, 2018), en utilisant la méthode KDE gaussienne avec l’estimateur de largeur de bande par défaut de Silverman.
Résultats
Nous avons trouvé un chevauchement substantiel dans la composition des espèces végétales à travers les biomes, basé sur l’intersection des gammes d’espèces modélisées (voir la figure 1, et le tableau supplémentaire 1). Ce chevauchement taxonomique est plus important dans les biomes tropicaux et tempérés, avec relativement peu d’espèces partagées entre ces deux zones climatiques. Il est intéressant de noter que les zones boisées xériques partagent des espèces avec les biomes tropicaux et tempérés. Malgré la forte proportion d’espèces caractéristiques de la forêt tropicale humide (83 %), ce biome partage également un grand nombre d’espèces avec d’autres biomes tropicaux tels que les forêts sèches, les savanes, les bois xériques et les prairies tropicales. Le chevauchement taxonomique élevé des biomes tempérés tels que les prairies tempérées, les forêts méditerranéennes, la taïga et la toundra suggère la possibilité d’une faible distinctivité fonctionnelle, certains biomes tempérés représentant un sous-ensemble plus pauvre des biomes tropicaux plus riches en espèces et plus diversifiés sur le plan fonctionnel.
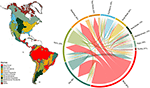
Figure 1. Chevauchement des espèces végétales entre les biomes du Nouveau Monde. Les valeurs en pourcentage expriment la fraction des espèces présentes dans un biome qui ont la plus grande proportion de leur aire de répartition géographique dans ce biome, N = 84 413. La base de chaque flèche ramifiée est positionnée de manière à montrer le biome qui comprend la plus grande proportion de l’aire de répartition d’une espèce, tandis que la largeur représente le nombre d’espèces partagées avec les biomes aux extrémités de la flèche. Voir le tableau supplémentaire 1 pour la matrice sous-jacente.
Avec moins de 10% des espèces cartographiées représentées, les données de traits étaient assez rares pour nos assemblages d’espèces à l’échelle du biome (figure 2A). De plus, les données disponibles sur les traits varient considérablement selon les traits, les clades de plantes et les biomes. D’un point de vue phylogénétique, le P des feuilles et la densité du bois étaient particulièrement mal représentés, des clades entiers ne disposant d’aucune donnée. Par conséquent, sur les deux tiers environ des valeurs de traits pour nos 7842 espèces qui ont dû être imputées, beaucoup ont dû être attribuées en l’absence de taxons étroitement apparentés. Géographiquement, la SLA, la hauteur et la masse des graines sont sous-échantillonnées dans les tropiques et en Amérique du Sud tempérée, tandis que l’azote foliaire et la densité du bois sont échantillonnés de manière plus uniforme entre les régions. Le P foliaire est mal échantillonné dans tous les biomes. Les hypervolumes de traits créés à partir de pools d’espèces d’une sélection aléatoire de 20% des cellules pour chaque biome montrent principalement des différences entre les biomes tropicaux et tempérés/froids (Figure 2B). Les hypervolumes de traits ont tendance à être plus grands et plus variables dans les biomes tropicaux, avec la plus grande variation dans les forêts tropicales humides et sèches. Parmi les biomes tempérés/froids, les forêts de conifères et les forêts mixtes tempérées présentent les plus grands hypervolumes de traits. De façon intéressante, les arbustes xériques présentent une distribution des hypervolumes plus similaire aux biomes tropicaux qu’aux biomes tempérés.
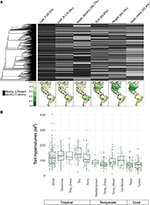
Figure 2. (A) Proportion d’espèces dans la base de données BIEN 3.0 avec des valeurs de traits connues (gris) ou manquantes (noir). La phylogénie à gauche correspond à l’arbre ALLBM des plantes à graines de Smith et Brown (2018) (c’est-à-dire les taxons de GenBank et de l’Open Tree of life avec une colonne vertébrale fournie par Magallón et al., 2015). Les cartes représentent la proportion d’espèces avec des informations sur les traits par rapport au nombre total d’espèces dans la base de données BIEN 2.0. (B) Distribution des hypervolumes de traits de 20 % des cellules de 100 × 100 km sélectionnées au hasard dans chaque biome. Les hypervolumes sont rapportés en unités d’écarts types à la puissance du nombre de traits utilisés.
La relation entre le caractère distinctif fonctionnel et la distribution géographique est remarquablement similaire entre les biomes (figure 3). Dans chaque biome, la grande majorité des espèces sont à la fois géographiquement restreintes et fonctionnellement similaires. Dans le même temps, les espèces les plus distinctives sur le plan fonctionnel au sein de chaque biome étaient généralement limitées géographiquement aussi, et les espèces les plus répandues géographiquement étaient presque toujours similaires sur le plan fonctionnel.
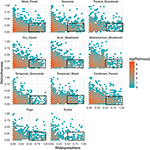
Figure 3. Modèles de distinctivité fonctionnelle à travers les biomes. La distinction représente la façon dont les espèces sont fonctionnellement éloignées les unes des autres au sein d’un biome (c’est-à-dire la distance phénotypique moyenne par paire d’une espèce focale par rapport à toutes les autres). Plus la valeur est élevée, plus une espèce est éloignée du centroïde de l’espace fonctionnel du biome. La généralité mesure la fréquence géographique d’une espèce dans un biome. Une valeur de 0 indique qu’une espèce est présente dans une seule cellule du biome. Les valeurs des cases correspondent au nombre d’espèces sur une échelle logarithmique. Les rectangles représentent les espèces qui sont considérées comme fonctionnellement similaires et répandues dans chaque biome en utilisant des valeurs seuils de 0,25 et 0,5 de distinctivité et de généralité, respectivement.
Nous avons trouvé une variation considérable dans la distribution proportionnelle des formes de croissance au sein et entre les biomes. Les espèces ligneuses représentent les formes de croissance dominantes dans les biomes tropicaux en termes de nombre d’espèces, alors que les espèces herbacées dominent dans les environnements tempérés (figure 4). Lorsque nous avons pris en compte uniquement les espèces qui sont répandues et fonctionnellement communes dans chaque biome, la distribution des formes de croissance dans les biomes a changé, notamment en ce qui concerne la proportion d’arbres, d’herbes et de graminées. Par exemple, dans les biomes tropicaux, la proportion d’arbres a diminué dans chaque biome, à l’exception de la forêt humide. Dans les biomes tempérés, la proportion d’herbes a augmenté, en particulier vers les régions polaires. Il est intéressant de noter que la distribution des formes de croissance dans les boisés xériques ressemble plus étroitement à la distribution dans les biomes tempérés lorsque seules les espèces répandues et fonctionnellement communes sont prises en compte.
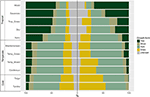
Figure 4. Distribution des formes de croissance dans chaque biome (à gauche) en utilisant le nombre total d’espèces, et (à droite) en utilisant uniquement les espèces qui sont fonctionnellement similaires et répandues dans le biome (voir Figure 3).
Les comparaisons par paires de la composition des espèces entre les biomes révèlent trois groupes principaux représentant les zones climatiques tropicales, tempérées et polaires (Figure 5A), reflétant le chevauchement taxonomique élevé au sein de ces régions, mais pas entre elles (Figure 1). Les comparaisons par paires des hypervolumes de caractères entre les biomes montrent un regroupement moins clair des zones climatiques (figure 5B). Dans ce cas, l’espace fonctionnel des zones boisées xériques se chevauche de manière significative avec les biomes tempérés. Cette analyse révèle également le chevauchement de l’espace fonctionnel des taïgas avec les prairies tempérées et les forêts mixtes. La comparaison par paires des hypervolumes de traits entre les biomes en utilisant uniquement les espèces considérées comme fonctionnellement communes et répandues montre un chevauchement moindre des espaces de traits entre et au sein des zones climatiques (figure 5C). Cependant, même si les boisés xériques sont maintenant regroupés avec le reste des biomes tropicaux, ces habitats ainsi que les prairies tropicales présentent un grand chevauchement dans l’espace fonctionnel avec les biomes tempérés tels que les boisés méditerranéens et les prairies tempérées.
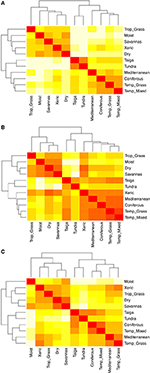
Figure 5. (A) Dissimilarité par paires dans la composition des espèces entre les biomes. (B) Dissimilarité par paires dans les hypervolumes de traits (similarité 1-Sørensen) entre les biomes en utilisant le nombre total d’espèces. (C) Dissimilarité par paire des hypervolumes de traits (similarité 1-Sørensen) entre les biomes en utilisant uniquement les espèces considérées comme fonctionnellement similaires et répandues. Plus la cellule est claire, plus la dissimilarité est grande.
Discussion
Nos analyses donnent trois aperçus importants pour comprendre les biomes terrestres à travers une lentille fonctionnelle. Premièrement, nous montrons que malgré les progrès réalisés dans la compilation et la synthèse des données primaires sur la biodiversité, d’importantes lacunes dans les connaissances persistent et peuvent limiter notre capacité à quantifier la biodiversité fonctionnelle des biomes à l’échelle continentale à mondiale. Deuxièmement, nos analyses des données disponibles montrent néanmoins que tous les biomes d’Amérique du Nord et du Sud partagent un modèle commun remarquable dans lequel les espèces les plus répandues géographiquement dans un biome ont tendance à partager des traits fonctionnels communs tandis que les espèces les plus distinctives sur le plan fonctionnel sont invariablement limitées dans leur distribution. Troisièmement, lorsque seules les espèces répandues et fonctionnellement communes sont prises en compte, les biomes peuvent être plus facilement distingués sur le plan fonctionnel, et les schémas de dissimilarité entre les biomes semblent refléter une correspondance entre le climat et l’espace de niche fonctionnel des plantes. Pris ensemble, nos résultats suggèrent que, bien que l’étude de la diversité fonctionnelle des biomes en soit encore à ses débuts, la poursuite du développement de ce domaine permettra probablement d’obtenir des aperçus reliant l’évolution, la biogéographie, l’assemblage des communautés et la fonction des écosystèmes.
Défauts de connaissances
La base de données BIEN est spécifiquement conçue pour combler les lacunes dans notre connaissance de la biodiversité végétale, pourtant, comme le soulignent Hortal et al. (2015), l’interaction des déficits de connaissances entraîne une incertitude dans la quantification de la biodiversité aux plus grandes échelles. Par exemple, non seulement moins de 10 % de nos espèces cartographiées disposaient à la fois de données sur les traits et d’informations phylogénétiques, mais les données manquantes sur les traits (~66 % des valeurs des traits des espèces) étaient assez structurées, tant sur le plan phylogénétique que géographique. Ainsi, le manque de données sur les traits fonctionnels (sensu Hortal et al., 2015) interagit avec le manque d’informations sur la distribution (sensu Wallace) et le manque de compréhension phylogénétique (sensu Darwin). Et si nous pouvons utiliser les connaissances phylogénétiques pour imputer raisonnablement ces valeurs manquantes (Swenson et al., 2017), plusieurs aspects des modèles résultants qui sont importants pour la classification des biomes restent incertains. Par exemple, les données existantes sur les formes de croissance suggèrent que les espèces ligneuses dominent dans tous les biomes tropicaux, alors que la diversité proportionnelle des formes de croissance herbacées est beaucoup plus élevée dans les biomes tempérés et polaires (voir également Engemann et al., 2016 ; Zanne et al., 2018). Cette augmentation latitudinale de la diversité relative des plantes herbacées reflète-t-elle des biais d’échantillonnage et un manque de connaissances taxonomiques sur les plantes herbacées tropicales, ou bien des histoires évolutives et biogéographiques différentes dans les domaines néarctique et néotropical ? Les formes de croissance dominantes sont l’une des principales caractéristiques distinctives des biomes, de sorte que les changements systématiques dans les formes de croissance les plus diverses (qu’elles soient dominantes ou non) influenceront nécessairement nos prédictions sur la façon dont la diversité fonctionnelle pourrait changer à travers les biomes, et comment ces changements affecteront la fonction et les services des écosystèmes.
Nous avons utilisé des cartes d’aires de répartition des espèces comme données d’entrée principalement pour surmonter le problème indéniable du biais d’échantillonnage qui est caractéristique des ensembles de données compilés à partir de sources multiples (voir la figure supplémentaire 1). Cependant, les cartes d’aires de répartition établies à partir de modèles de distribution des espèces pourraient représenter un élément supplémentaire d’incertitude dans nos résultats. Par exemple, étant donné la résolution géographique de cette étude et la complexité spatiale de certains biomes, ces modèles auraient pu surestimer l’étendue géographique de certaines espèces des cellules d’un seul biome aux cellules de biomes voisins et interdigités. L’utilisation des données d’occurrence n’a pas modifié les résultats généraux de cette étude (voir les figures supplémentaires 2-6) ; toutefois, une légère diminution du chevauchement fonctionnel entre les biomes pourrait effectivement révéler une surestimation de l’étendue de certaines espèces (voir les figures supplémentaires 2, 5 et 6). L’utilisation d’informations sur l’occurrence a également modifié les relations générales entre le caractère distinctif fonctionnel et l’étendue dans nos résultats, en raison du suréchantillonnage relatif des régions tempérées par rapport aux régions tropicales (voir figure supplémentaire 4). Dans ce cas, notre mesure de la généralité est limitée par l’échantillonnage extrêmement restreint de la plupart des espèces dans les biomes tropicaux. Au fur et à mesure que les ensembles de données et l’échantillonnage s’améliorent, il est probable qu’il sera possible de réduire ces incertitudes à l’avenir.
L’autre lacune dans les données qui doit être comblée pour comprendre la diversité fonctionnelle des biomes est le manque Prestonien d’informations sur l’abondance. L’abondance est particulièrement importante dans les études de la diversité fonctionnelle parce que les traits qui comptent le plus pour l’assemblage des communautés, le fonctionnement des écosystèmes et le cycle biogéochimique sont ceux des espèces les plus dominantes. Étant donné que nous avons basé nos assemblages sur des cartes d’aires de répartition dérivées de modèles de distribution des espèces, nous n’avons pu aborder que la composante géographique de la banalité, mais la relation positive entre l’abondance locale et l’aire de répartition géographique, appelée relation occupation-abondance, suggère que les espèces les plus répandues dans chaque biome sont souvent parmi les plus abondantes (Borregaard et Rahbek, 2010 ; Novosolov et al., 2017). Les biomes étant généralement caractérisés par les formes de croissance dominantes dans la région, l’intégration des informations sur l’abondance pourrait aboutir à des biomes présentant moins de chevauchement fonctionnel. Cependant, même si le BIEN a compilé de volumineuses données sur les parcelles qui permettent d’estimer l’abondance locale, l’établissement de comparaisons raisonnables entre différentes régions et formes de croissance est entravé par un échantillonnage inégal, des différences régionales dans la diversité gamma et des méthodes incommensurables de quantification de l’abondance.
Modèles communs au sein des biomes
Malgré les lacunes persistantes dans les données disponibles, nos analyses ont mis en évidence une relation jusqu’alors non documentée, commune à tous les biomes de l’hémisphère occidental : dans tout biome, les espèces les plus répandues ont également tendance à présenter une faible distinctivité fonctionnelle, tandis que les espèces les plus distinctives sur le plan fonctionnel sont presque invariablement restreintes dans leur distribution (figure 3). Cette relation “occupation-redondance” peut suggérer que les conditions climatiques prévalant dans un biome sélectionnent un ensemble de caractéristiques communes, les espèces les plus distinctives sur le plan fonctionnel étant limitées à un sous-ensemble plus rare d’habitats dans le biome. La prévalence globale d’espèces fonctionnellement similaires dans tous les biomes et la relation ” occupation-redondance ” sont toutes deux cohérentes avec une analyse mondiale récente de la diversité fonctionnelle au niveau de la communauté, qui suggère que le filtrage des habitats conduit à la coexistence d’espèces fonctionnellement similaires (Li et al., 2018), ainsi qu’avec des études montrant que les redondances fonctionnelles augmentent la stabilité des communautés (par exemple, Walker et al., 1999 ; Pillar et al., 2013). De plus, avec le degré élevé de chevauchement à la fois taxonomique et fonctionnel entre les biomes (figures 1, 5), le fait que les espèces communes et répandues soient fonctionnellement similaires renforce la notion selon laquelle les plantes terrestres dans une large gamme de conditions environnementales partagent des caractéristiques communes proches du cœur du spectre des traits fonctionnels (Wright et al., 2004 ; Díaz et al., 2016). Contrairement à Umaña et al. (2017), nos résultats montrent que les espèces rares et géographiquement limitées peuvent ou non être fonctionnellement distinctes des espèces plus répandues et communes. Ainsi, la question reste ouverte de savoir si les espèces plus distinctives sur le plan fonctionnel sont des spécialistes dans des environnements particuliers ou si leurs combinaisons de traits entraînent des compromis démographiques ou physiologiques qui limitent leur distribution géographique.
Comparaisons entre les biomes
Notre comparaison des distributions d’hypervolumes de traits entre les biomes (figure 2B) est cohérente avec l’observation que les environnements plus riches en espèces sont également plus diversifiés sur le plan fonctionnel (Swenson et al, 2012 ; Lamanna et al., 2014 ; Li et al., 2018 ; Šímová et al., 2018). Nos résultats sont plus équivoques concernant l’hypothèse selon laquelle les environnements climatiques saisonniers et extrêmes limitent systématiquement la diversité fonctionnelle des espèces (de la Riva et al., 2018). Tous les biomes tropicaux affichent une diversité fonctionnelle moyenne plus élevée que tous les biomes tempérés, et les biomes polaires affichent effectivement les plus petits hypervolumes. Cependant, au sein de chaque groupe, les biomes plus secs ou plus variables sur le plan saisonnier n’affichent pas toujours des hypervolumes plus petits (par exemple, les forêts sèches, les zones boisées xériques), comme nous l’aurions attendu en suivant l’hypothèse de tolérance de Currie et al. (2004), alors que les conditions climatiques optimales supportent davantage de combinaisons de paramètres physiologiques. À partir de ces seuls résultats, nous ne pouvons pas déterminer si les biomes tempérés et polaires sont moins diversifiés sur le plan taxonomique en raison des limites de l’espace de niche fonctionnel, ou si leurs hypervolumes fonctionnels sont petits parce qu’ils ne sont pas diversifiés sur le plan taxonomique. Les approches de modélisation nulle pourraient potentiellement aider à démêler la diversité taxonomique et fonctionnelle (Swenson et al., 2012 ; Lamanna et al., 2014 ; Šímová et al., 2018), mais une telle analyse dépassait le cadre de cette étude. Plus important encore, nos résultats renforcent l’importance de comprendre comment l’histoire évolutive et biogéographique façonne la diversité fonctionnelle des biomes (Woodward et al., 2004 ; Pennington et al., 2006 ; Donoghue et Edwards, 2014 ; Moncrieff et al., 2016). Le partage étendu d’espèces (et de lignées supérieures) à travers les biomes au sein de différents domaines biogéographiques, mais en grande partie pas entre eux, pourrait servir à la fois à homogénéiser la diversité fonctionnelle au sein des domaines et à fournir des indices sur les traits caractéristiques qui sont sélectionnés pour, ou contre, les différents environnements (Douma et al, 2012 ; Zanne et al., 2014, 2018).
Malgré un chevauchement substantiel des hypervolumes entre tous les biomes (figure supplémentaire 2), les biomes tropicaux, tempérés et froids semblent tous occuper des régions distinctes de l’espace fonctionnel (figures 5B,C). Les principaux traits qui différencient les biomes semblent être des traits liés à la taille globale de la plante, y compris la hauteur à maturité et la masse des graines (figures supplémentaires 7-10), plutôt que des traits liés à l’économie des feuilles, comme cela a été observé dans des analyses plus locales, basées sur des parcelles (par exemple, Douma et al., 2012). L’exception est le P foliaire, qui présentait des différences substantielles entre les biomes tropicaux et tempérés/polaires (Figures supplémentaires 7-10), un schéma qui a été observé dans d’autres analyses basées à la fois sur des valeurs spécifiques aux espèces et sur des mesures de l’écosystème entier (Kerkhoff et al., 2005 ; Swenson et al., 2012). Le P foliaire étant le trait le plus faiblement échantillonné, les différences entre les zones tropicales et tempérées/polaires peuvent être sujettes à des biais dus à la procédure d’imputation. Cependant, la feuille P présente un signal phylogénétique significatif (Kerkhoff et al., 2006), ce qui suggère que les imputations ne devraient pas être biaisées (Swenson et al., 2017). Le P foliaire est également significativement plus élevé dans les formes de croissance herbacées (Kerkhoff et al., 2006), de sorte que le passage latitudinal d’une diversité à prédominance ligneuse à une diversité herbacée (figure 4) peut également influencer ce schéma.
Lorsque nous avons limité les analyses d’hypervolume aux seules espèces les plus répandues et fonctionnellement communes dans chaque biome, les biomes individuels au sein de chaque domaine biogéographique se chevauchaient moins dans l’espace des traits fonctionnels (comparer les figures 5B,C), ce qui suggère que ces espèces peuvent refléter des phénotypes mieux adaptés à des environnements particuliers. Dans ce contexte, le biome boisé xérique est particulièrement intéressant. En partie en raison de l’inclusion de l’écorégion du Chaco, les forêts xériques se regroupent avec les biomes tropicaux sur le plan taxonomique (figure 5A). Mais lorsque les hypervolumes fonctionnels de toutes les espèces sont pris en compte, ils présentent une similarité beaucoup plus forte avec les biomes tempérés (Figure 5B). Enfin, lorsque seules les espèces les plus répandues et les plus communes d’un point de vue fonctionnel sont analysées, les zones boisées xériques présentent à nouveau une similarité accrue avec les biomes tropicaux, mais elles conservent également une grande similarité avec les prairies tempérées et les biomes méditerranéens (figure 5C). Les transitions entre les environnements chauds et mésiques et les environnements plus froids, plus secs et plus saisonniers sont facilitées par des traits similaires, par exemple le port herbacé (Douma et al., 2012 ; Zanne et al., 2014, 2018), et comme les environnements plus froids, les communautés des environnements secs ont également tendance à être plus regroupées phylogénétiquement (Qian et Sandel, 2017). En outre, la position des zones xériques à la limite de la zone de convergence intertropicale en fait une transition géographique entre les domaines tropical et tempéré. Le fait que les zones boisées xériques soient intermédiaires entre les royaumes tropicaux et tempérés, tant sur le plan fonctionnel que biogéographique, renforce encore l’idée que pour mieux comprendre la diversité fonctionnelle des biomes, nous devons tenir compte de leurs histoires biogéographiques et phylogénétiques (Pennington et al., 2006 ; Donoghue et Edwards, 2014 ; Moncrieff et al, 2016).
Conclusions
Toute classification des biomes terrestres impose un petit nombre de catégories discrètes sur des gradients continus de climat et de distribution des espèces, et représente donc une simplification grossière du paysage écologique complexe (Moncrieff et al., 2016, mais voir Silva de Miranda et al., 2018). Pourtant, malgré leur potentiel de simplification excessive, les biomes sont des constructions utiles pour organiser et comprendre la biodiversité et le fonctionnement des principaux écosystèmes terrestres de la Terre, et les approches basées sur les traits ont un fort potentiel pour aider à modéliser dynamiquement les distributions mondiales de végétation.
Dans cette étude, nous avons montré qu’une grande partie de la diversité taxonomique de tous les biomes représente des espèces qui sont à la fois étroitement distribuées et fonctionnellement similaires. En outre, au sein des biomes, les espèces les plus distinctives sur le plan fonctionnel ont également tendance à être géographiquement rares, tandis que les espèces répandues présentent uniformément une faible distinctivité fonctionnelle. Malgré un chevauchement taxonomique et fonctionnel important entre les biomes, ceux-ci se regroupent en unités distinctes sur le plan biogéographique et climatique, en particulier lorsque le regroupement fonctionnel est basé sur les espèces les plus répandues et les plus communes sur le plan fonctionnel dans chaque biome. Cependant, faire progresser une compréhension fonctionnelle des biomes nécessitera non seulement une meilleure caractérisation de la variation des traits au sein et entre les types de végétation, mais aussi des informations sur l’histoire biogéographique et phylogénétique des assemblages d’espèces et l’abondance relative des espèces au sein des biomes.
Data Availability
Les ensembles de données sur les traits et les cartes d’aires de répartition des espèces analysés pour cette étude peuvent être téléchargés via le package R BIEN (Maitner et al., 2018). Voir http://bien.nceas.ucsb.edu/bien/ pour plus de détails sur la base de données BIEN.
Contributions des auteurs
SE-L, AK, BJE, DMN et CV ont conçu l’étude ; SE-L et AK ont analysé les données ; SE-L et AK ont rédigé la première version du manuscrit ; CV, BB, NK, BSM, BM, RKP, BS, SS, J-CS et SKW ont contribué à la collation et à la création de la base de données des traits et des cartes d’aire de répartition. Tous les auteurs ont contribué au développement et à la rédaction du manuscrit.
Funding
SE-L, DMN, et AK ont été soutenus par une subvention de recherche collaborative de la US National Science Foundation (DEB-1556651). BJE a été soutenu par la National Science Foundation (DEB-1457812) et Macrosystems-1065861. CV a été soutenu par le Conseil européen de la recherche (subvention ERC-StG-2014-639706-CONSTRAINTS) et par la Fondation française pour la recherche sur la biodiversité (FRB ; www.fondationbiodiversite.fr) dans le cadre du projet CESAB Causes et conséquences de la rareté fonctionnelle de l’échelle locale à l’échelle globale. J-CS considère ce travail comme une contribution à son projet VILLUM Investigator Biodiversity Dynamics in a Changing World financé par VILLUM FONDEN (subvention 16549). SKW a été soutenu par le Fonds d’investissement scientifique stratégique du groupe Science et Innovation du ministère néo-zélandais du Commerce, de l’Innovation et de l’Emploi.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Dan Griffith et deux réviseurs pour leurs critiques constructives qui ont grandement amélioré ce manuscrit. Nous remercions également tous les contributeurs de données BIEN (voir http://bien.nceas.ucsb.edu/bien/data-contributors/ pour une liste complète).
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fevo.2018.00219/full#supplementary-material
Banda, R.K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D., et al. (2016). Les modèles de diversité végétale dans les forêts sèches néotropicales et leurs implications pour la conservation. Science 353, 1383-1387. doi : 10.1126/science.aaf5080
PubMed Abstract | CrossRef Full Text | Google Scholar
Blonder, B., Lamanna, C., Violle, C., et Enquist, B. J. (2014). L’hypervolume à n dimensions. Glob. Ecol. Biogeogr. 23, 595-609. doi : 10.1111/geb.12146
CrossRef Full Text | Google Scholar
Blonder, B., Morrow, C. B., Maitner, B., Harris, D. J., Lamanna, C., Violle, C., et al. (2018). Nouvelles approches pour délimiter les hypervolumes n-dimensionnels. Méthodes Ecol. Evol. 9, 305-319. doi : 10.1111/2041-210X.12865
CrossRef Full Text | Google Scholar
Bonan, G. B., Oleson, K. W., Fisher, R. A., Lasslop, G., et Reichstein, M. (2012). Reconciling leaf physiological traits and canopy flux data : use of the TRY and FLUXNET databases in the Community Land Model version 4. J. Geophys. Res. Biogeosci. 117:G02026. doi : 10.1029/2011JG001913
CrossRef Full Text | Google Scholar
Borregaard, M. K., et Rahbek, C. (2010). Causalité de la relation entre la distribution géographique et l’abondance des espèces. Q. Rev. Biol. 85, 3-25. doi : 10.1086/650265
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruggeman, J., Heringa, J., et Brandt, B. W. (2009). PhyloPars : estimation des valeurs de paramètres manquants en utilisant la phylogénie. Nucleic Acids Res. 37, W179-W184. doi : 10.1093/nar/gkp370
PubMed Abstract | CrossRef Full Text | Google Scholar
Cadotte, M. W., Carscadden, K., et Mirotchnick, N. (2011). Au-delà des espèces : la diversité fonctionnelle et le maintien des processus et services écologiques. J. Appl. Ecol. 48, 1079-1087. doi : 10.1111/j.1365-2664.2011.02048.x
CrossRef Full Text | Google Scholar
Cornwell, W. K., Cornelissen, J. H., Amatangelo, K., Dorrepaal, E., Eviner, V. T., Godoy, O., et al. (2008). Les traits des espèces végétales sont le contrôle prédominant des taux de décomposition de la litière dans les biomes du monde entier. Ecol. Lett. 11, 1065-1071. doi : 10.1111/j.1461-0248.2008.01219.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Craine, J. M. (2009). Stratégies de ressources des plantes sauvages. New Jersey, NJ : Princeton University Press. doi : 10.1515/9781400830640
CrossRef Full Text | Google Scholar
Currie, D. J., Mittelbach, G. G., Cornell, H. V., Field, R., Guégan, J. F., Hawkins, B. A., et al. (2004). Predictions and tests of climate-based hypotheses of broad-scale variation in taxonomic richness. Ecol. Lett. 12, 1121-1134. doi : 10.1111/j.1461-0248.2004.00671.x
CrossRef Full Text | Google Scholar
de la Riva, E. G., Violle, C., Pérez-Ramos, I. M., Marañón, T., Navarro-Fernández, C. M., Olmo, M., et al. (2018). Une approche multidimensionnelle des traits fonctionnels révèle l’empreinte du stress environnemental dans les Communautés ligneuses méditerranéennes. Ecosystems 21, 248-262. doi : 10.1007/s10021-017-0147-7
CrossRef Full Text | Google Scholar
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S., Dray, S., et al. (2016). Le spectre global de la forme et de la fonction des plantes. Nature 529, 167-171. doi : 10.1038/nature16489
PubMed Abstract | CrossRef Full Text | Google Scholar
Díaz, S., Lavorel, S., de Bello, F., Quétier, F., Grigulis, K., et Robson, T. M. (2007). Incorporation des effets de la diversité fonctionnelle des plantes dans les évaluations des services écosystémiques. Proc. Natl. Acad. Sci. U.S.A 104, 20684-20689. doi : 10.1073/pnas.0704716104
PubMed Abstract | CrossRef Full Text | Google Scholar
Donoghue, M. J., et Edwards, E. J. (2014). Changements de biomes et évolution des niches chez les plantes. Annu. Rev. Ecol. Evol. Syst. 45, 547-572. doi : 10.1146/annurev-ecolsys-120213-091905
CrossRef Full Text | Google Scholar
Douma, J. C., Aerts, R., Witte, J. P. M., Bekker, R. M., Kunzmann, D., Metselaar, K., et al. (2012). Une combinaison de traits végétaux fonctionnellement différents fournit un moyen de prédire quantitativement une large gamme d’assemblages d’espèces en Europe du Nord-Ouest. Ecography 35, 364-373. doi : 10.1111/j.1600-0587.2011.07068.x
CrossRef Full Text | Google Scholar
Engemann, K., Sandel, B., Enquist, B. J., Jørgensen, P. M., Kraft, N., Marcuse-Kubitza, A., et al. (2016). Patterns and drivers of plant functional group dominance across the Western Hemisphere : a macroecological re-assessment based on a massive botanical dataset. Bot. J. Linn. Soc. 180, 141-160. doi : 10.1111/boj.12362
CrossRef Full Text | Google Scholar
Enquist, B. J., Condit, R., Peet, R., Thiers, B., et Schildhauer, M. (2016). Le réseau d’information botanique et d’écologie (BIEN) : cyberinfrastructure pour un réseau d’information botanique intégré pour étudier les impacts écologiques du changement climatique mondial sur la biodiversité végétale. PeerJ Prepr. 4:e2615v2. doi : 10.7287/peerj.preprints.2615v2
CrossRef Full Text | Google Scholar
Garnier, E., Cortez, J., Billès, G., Navas, M. L., Roumet, C., Debussche, M., et al. (2004). Plant functional markers capture ecosystem properties during secondary succession. Ecology 85, 2630-2637. doi : 10.1890/03-0799
CrossRef Full Text | Google Scholar
Goldsmith, G. R., Morueta-Holme, N., Sandel, B., Fitz, E. D., Fitz, S. D., Boyle, B., et al. (2016). Plant-O-Matic : un guide dynamique et mobile de toutes les plantes des Amériques. Méthodes Ecol. Evol. 7, 960-965. doi : 10.1111/2041-210X.12548
CrossRef Full Text | Google Scholar
Goolsby, E. W., Bruggeman, J., et Ané, C. (2017). Rphylopars : méthodes comparatives phylogénétiques multivariées rapides pour les données manquantes et la variation intra-spécifique. Méthodes Ecol. Evol. 8, 22-27. doi : 10.1111/2041-210X.12612
CrossRef Full Text | Google Scholar
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F., and Violle, C. (2017). funrar : an R package to characterize functional rarity. Divers. Distrib. 23, 1365-1371. doi : 10.1111/ddi.12629
CrossRef Full Text | Google Scholar
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., et Ladle, R. J. (2015). Sept lacunes qui assaillent la connaissance de la biodiversité à grande échelle. Annu. Rev. Ecol. Evol. Syst. 46, 523-549. doi : 10.1146/annurev-ecolsys-112414-054400
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Enquist, B. J., Elser, J. J., and Fagan, W. F. (2005). Allométrie des plantes, stœchiométrie et la dépendance de la température de la productivité primaire. Glob. Ecol. Biogeogr. 14, 585-598. doi : 10.1111/j.1466-822X.2005.00187.x
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Fagan, W. F., Elser, J. J., et Enquist, B. J. (2006). Variation phylogénétique et de forme de croissance dans l’échelonnement de l’azote et du phosphore dans les plantes à graines. Am. Nat. 168, E103-E122. doi : 10.1086/507879
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraft, N. J., Valencia, R., et Ackerly, D. D. (2008). Traits fonctionnels et assemblage de communauté d’arbres basé sur la niche dans une forêt amazonienne. Science 322, 580-582. doi : 10.1126/science.1160662
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamanna, C., Blonder, B., Violle, C., Kraft, N. J., Sandel, B., et al. (2014). L’espace des traits fonctionnels et le gradient de diversité latitudinal. Proc. Natl. Acad. Sci. U.S.A. 111, 13745-13750. doi : 10.1073/pnas.1317722111
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavorel, S., et Garnier, E. (2002). Prédire les changements dans la composition des communautés et le fonctionnement des écosystèmes à partir des traits des plantes : revisiter le Saint Graal. Funct. Ecol. 16, 545-556. doi : 10.1046/j.1365-2435.2002.00664.x
CrossRef Full Text | Google Scholar
Lavorel, S., Grigulis, K., Lamarque, P., Colace, M.-P., Garden, D., Girel, J., et al. (2011). Utilisation des traits fonctionnels des plantes pour comprendre la distribution paysagère de multiples services écosystémiques. J. Ecol. 99, 135-147. doi : 10.1111/j.1365-2745.2010.01753.x
CrossRef Full Text | Google Scholar
Li, Y., Shipley, B., Price, J. N., Dantas, V. de L., Tamme, R., Westoby, M., et al. (2018). Le filtrage de l’habitat détermine l’occupation de la niche fonctionnelle des communautés végétales dans le monde entier. J. Ecol. 106, 1001-1009. doi : 10.1111/1365-2745.12802
CrossRef Full Text | Google Scholar
Magallón, S., Gómez-Acevedo, S., Sánchez-Reyes, L. L., et Hernández-Hernández, T. (2015). Un arbre temporel métacalibré documente la montée précoce de la diversité phylogénétique des plantes à fleurs. New Phytol. 207, 437-453. doi : 10.1111/nph.13264
PubMed Abstract | CrossRef Full Text | Google Scholar
Maitner, B. S., Boyle, B., Casler, N., Condit, R., Donoghue, J., Durán, S. M., et al. (2018). Le paquet BIEN R : un outil pour accéder à la base de données du réseau d’information botanique et d’écologie (BIEN). Méthodes Ecol. Evol. 9, 373-379. doi : 10.1111/2041-210X.12861
CrossRef Full Text | Google Scholar
Moncrieff, G. R., Bond, W. J., et Higgins, S. I. (2016). Révision du concept de biome pour comprendre et prédire les impacts du changement global. J. Biogeogr. 43, 863-873. doi : 10.1111/jbi.12701
CrossRef Full Text | Google Scholar
Novosolov, M., Rodda, G. H., North, A. C., Butchart, S. H. M., Tallowin, O. J. S., Gainsbury, A. M., et al. (2017). La relation entre la densité de la population et la taille de la gamme revisitée. Glob. Ecol. Biogeogr. 26, 1088-1097. doi : 10.1111/geb.12617
CrossRef Full Text | Google Scholar
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C., et al. (2001). Terrestrial Ecoregions of the world : a new map of life on earth : a new global map of terrestrial ecoregions provides an innovative tool for conserving biodiversity. Bioscience 51, 933-938.doi : 10.1641/0006-3568(2001)0512.0.CO;2
CrossRef Full Text | Google Scholar
Pennington, R. T., Prado, D. E., et Pendry, C. A. (2000). Les forêts saisonnièrement sèches néotropicales et les changements de végétation quaternaires. J. Biogeogr. 27, 261-273. doi : 10.1046/j.1365-2699.2000.00397.x
CrossRef Full Text | Google Scholar
Pennington, R. T., Richardson, J. E., et Lavin, M. (2006). Insights into the historical construction of species-rich biomes from dated plant phylogenies, neutral ecological theory and phylogenetic community structure. New Phytol. 172, 605-616. doi : 10.1111/j.1469-8137.2006.01902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Penone, C., Davidson, A. D., Shoemaker, K. T., Di Marco, M., Rondinini, C., Brooks, T. M., et al. (2014). Imputation des données manquantes dans les ensembles de données sur les traits d’histoire de vie : quelle approche est la plus performante ? Methods Ecol. Evol. 5, 961-970. doi : 10.1111/2041-210X.12232
CrossRef Full Text | Google Scholar
Pillar, V. D., Blanco, C. C., Müller, S. C., Sosinski, E. E., Joner, F., et Duarte, L. D. S. (2013). Redondance fonctionnelle et stabilité dans les communautés végétales. J. Veg. Sci. 24, 963-974. doi : 10.1111/jvs.12047
CrossRef Full Text | Google Scholar
Prado, D. E., et Gibbs, P. E. (1993). Modèles de distribution des espèces dans les forêts saisonnières sèches d’Amérique du Sud. Ann. Mo. Bot. Gard. 80, 902-927. doi : 10.2307/2399937
CrossRef Full Text | Google Scholar
Qian, H., et Sandel, B. (2017). Structure phylogénétique des assemblages régionaux d’angiospermes à travers les gradients latitudinaux et climatiques en Amérique du Nord. Glob. Ecol. Biogeogr. 26, 1258-1269. doi : 10.1111/geb.12634
CrossRef Full Text | Google Scholar
Reich, P. B., Wright, I. J., Cavender-Bares, J., Craine, J. M., Oleksyn, J., Westoby, M., et al. (2003). The evolution of plant functional variation : traits, spectres, and strategies. Int. J. Plant Sci. 164, S143-S164. doi : 10.1086/374368
CrossRef Full Text | Google Scholar
Silva de Miranda, P. L., Oliveira-Filho, A., Pennington, R. T., Neves, D. M., Baker, T. R., and Dexter, K. G. (2018). Utilisation des inventaires d’espèces d’arbres pour cartographier les biomes et évaluer leurs chevauchements climatiques dans les basses terres tropicales d’Amérique du Sud. Glob. Ecol. Biogeogr. 27, 899-912. doi : 10.1111/geb.12749
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Kraft, N. J. B., Storch, D., Svenning, J.-C., Boyle, B., et al. (2015). Shifts in trait means and variances in North American tree assembages : species richness patterns are loosely related to the functional space. Ecography 38, 649-658. doi : 10.1111/ecog.00867
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Svenning, J.-C., Kattge, J., Engemann, K., Sandel, B., et al. (2018). Les modèles spatiaux et les relations climatiques des principaux traits des plantes dans le Nouveau Monde diffèrent entre les espèces ligneuses et herbacées. J. Biogeogr. 45, 895-916. doi : 10.1111/jbi.13171
CrossRef Full Text | Google Scholar
Smith, S. A., et Beaulieu, J. M. (2009). L’histoire de vie influence les taux d’évolution de la niche climatique chez les plantes à fleurs. Proc. Biol. Sci. 276, 4345-4352. doi : 10.1098/rspb.2009.1176
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., et Brown, J. W. (2018). Construire une phylogénie de plantes à graines largement inclusive. Am. J. Bot. 105, 302-314. doi : 10.1002/ajb2.1019
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., et Donoghue, M. J. (2008). Les taux d’évolution moléculaire sont liés à l’histoire de vie des plantes à fleurs. Science 322, 86-89. doi : 10.1126/science.1163197
PubMed Abstract | CrossRef Full Text | Google Scholar
Swenson, N. G. (2014). Imputation phylogénétique des bases de données de traits fonctionnels végétaux.Ecography 37, 105-110. doi : 10.1111/j.1600-0587.2013.00528.x
CrossRef Full Text
Swenson, N. G., Enquist, B. J., Pither, J., Kerkhoff, A. J., Boyle, B., Weiser, M. D., et al. (2012). La biogéographie et le filtrage de la diversité fonctionnelle des plantes ligneuses en Amérique du Nord et du Sud. Glob. Ecol. Biogeogr. 21, 798-808. doi : 10.1111/j.1466-8238.2011.00727.x
CrossRef Full Text | Google Scholar
Swenson, N. G., Weiser, M. D., Mao, L., Araújo, M. B., Diniz-Filho, J. A. F., Kollmann, J., et al. (2017). La phylogénie et la prédiction de la diversité fonctionnelle des arbres dans des contextes continentaux inédits. Glob. Ecol. Biogeogr. 26, 553-562. doi : 10.1111/geb.12559
CrossRef Full Text | Google Scholar
Umaña, M. N., Mi, X., Cao, M., Enquist, B. J., Hao, Z., Howe, R., et al. (2017). Le rôle de l’unicité fonctionnelle et de l’agrégation spatiale dans l’explication de la rareté des arbres. Glob. Ecol. Biogeogr. 26, 777-786. doi : 10.1111/geb.12583
CrossRef Full Text | Google Scholar
van Bodegom, P. M., Douma, J. C., et Verheijen, L. M. (2014). Une approche entièrement basée sur les traits pour modéliser la distribution globale de la végétation. Proc. Natl. Acad. Sci. U.S.A. 111, 13733-13738. doi : 10.1073/pnas.1304551110
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Reich, P. B., Pacala, S. W., Enquist, B. J., et Kattge, J. (2014). L’émergence et la promesse de la biogéographie fonctionnelle. Proc. Natl. Acad. Sci. U.S.A. 111, 13690-13696. doi : 10.1073/pnas.1415442111
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W., et al. (2017). La rareté fonctionnelle : l’écologie des valeurs aberrantes. Trends Ecol. Evol. 32, 356-367. doi : 10.1016/j.tree.2017.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, B., Kinzig, A., et Langridge, J. (1999). Diversité des attributs des plantes, résilience et fonction des écosystèmes : la nature et la signification des espèces dominantes et mineures. Ecosystems 2, 95-113. doi : 10.1007/s100219900062
CrossRef Full Text | Google Scholar
Westoby, M. (1998). Un schéma de stratégie d’écologie végétale de type leaf-height-seed (LHS). Plant Soil 199, 213-227. doi : 10.1023/A:1004327224729
CrossRef Full Text | Google Scholar
Woodward, F. I., Lomas, M. R., et Kelly, C. K. (2004). Le climat mondial et la distribution des biomes végétaux. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 359, 1465-1476. doi : 10.1098/rstb.2004.1525
PubMed Abstract | CrossRef Full Text | Google Scholar
Wright, I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Baruch, Z., Bongers, F., et al. (2004). The worldwide leaf economics spectrum. Nature 428, 821-827. doi : 10.1038/nature02403
PubMed Abstract | CrossRef Full Text | Google Scholar
Xia, J., Niu, S., Ciais, P., Janssens, I. A., Chen, J., Ammann, C., et al. (2015). Contrôle conjoint de la productivité primaire brute terrestre par la phénologie et la physiologie des plantes. Proc. Natl. Acad. Sci. U.S.A. 112, 2788-2793. doi : 10.1073/pnas.1413090112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Pearse, W. D., Cornwell, W. K., McGlinn, D. J., Wright, I. J., et Uyeda, J. C. (2018). Biogéographie fonctionnelle des angiospermes : la vie aux extrêmes. New Phytol. 218, 1697-1709. doi : 10.1111/nph.15114
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Tank, D. C., Cornwell, W. K., Eastman, J. M., Smith, S. A., FitzJohn, R. G., et al. (2014). Trois clés pour la radiation des angiospermes dans les environnements de congélation. Nature 506, 89-92. doi : 10.1038/nature12872
PubMed Abstract | CrossRef Full Text | Google Scholar
.