Évaluation | Biopsychologie | Comparatif |Cognitif | Développemental | Langage | Différences individuelles |Personnalité | Philosophie | Social |
Méthodes | Statistiques |Clinique | Éducatif | Industriel | Articles professionnels |Psychologie mondiale |
Biologique :Génétique comportementale – Psychologie évolutive – Neuroanatomie – Neurochimie – Neuroendocrinologie -Neuroscience – Psychoneuroimmunologie – Psychologie physiologique – Psychopharmacologie(Index, Schéma)
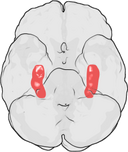
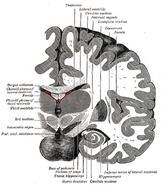
L’emplacement de l’hippocampe dans le cerveau humain.
Pour la revue du même nom, voir Hippocampe (revue)
L’hippocampe est une partie du cerveau antérieur, située dans le lobe temporal médian. Il appartient au système limbique et joue des rôles majeurs dans la mémoire à long terme et la navigation spatiale. Les humains et les autres mammifères possèdent deux hippocampes, un de chaque côté du cerveau. Chez les rongeurs, où il a été le plus étudié, l’hippocampe a la forme d’une banane. Chez l’homme, il a une forme incurvée et convolutée qui rappelait aux premiers anatomistes un hippocampe. Le nom, en fait, dérive du mot grec pour hippocampe (grec : hippos = cheval, campos = mer).
Dans la maladie d’Alzheimer, l’hippocampe est l’une des premières régions du cerveau à subir des dommages ; les problèmes de mémoire et la désorientation apparaissent parmi les premiers symptômes. Les dommages à l’hippocampe peuvent également résulter d’une privation d’oxygène (anoxie), d’une encéphalite ou d’une épilepsie du lobe temporal mésial. Les personnes présentant des lésions étendues de l’hippocampe peuvent souffrir d’amnésie, c’est-à-dire d’une incapacité à former ou à conserver de nouveaux souvenirs.
- Fonctions de l’hippocampe
- Rôle dans la mémoire
- Rôle dans la mémoire spatiale et la navigation
- Hippocampe et dépression
- Historique
- Anatomie
- Physiologie
- Le rythme thêta
- Ondes aiguës
- Evolution
- Voir aussi
- Références & Bibliographie
- Textes clés
- Livres
- Papiers
- Matériel supplémentaire
- Articles
- Images supplémentaires
Fonctions de l’hippocampe
L’idée la plus ancienne était peut-être que l’hippocampe est impliqué dans l’olfaction : cela semble avoir été suggéré principalement par son emplacement dans le cerveau, à côté du cortex olfactif. On continue à s’intéresser aux réponses olfactives de l’hippocampe, mais presque personne ne croit aujourd’hui que la fonction primaire de l’hippocampe est olfactive.
Au fil des ans, trois idées principales de la fonction hippocampique ont dominé la littérature : l’inhibition, la mémoire et l’espace. La théorie de l’inhibition comportementale (caricaturée par O’Keefe et Nadel sous le nom de “step on the brakes !”) a été très populaire jusque dans les années 1960. Elle tirait une grande partie de sa force de deux observations : premièrement, les animaux présentant des lésions de l’hippocampe ont tendance à être hyperactifs ; deuxièmement, les animaux présentant des lésions de l’hippocampe ont souvent du mal à apprendre à inhiber les réponses qui leur ont été précédemment enseignées. Jeffrey Gray a développé ce courant de pensée pour en faire une théorie à part entière du rôle de l’hippocampe dans l’anxiété. La théorie de l’inhibition n’est cependant pas très populaire à l’heure actuelle.
La deuxième ligne de pensée importante relie l’hippocampe à la mémoire. Bien qu’elle ait eu des précurseurs, cette idée a tiré sa force principale d’un rapport très connu de Scoville et Milner sur les résultats de la destruction chirurgicale de l’hippocampe (dans une tentative de soulager les crises d’épilepsie), chez un patient connu sous le nom de H.M. Le résultat inattendu était une amnésie sévère : H.M. était incapable de se souvenir consciemment des événements survenus après son opération ou pendant plusieurs années avant celle-ci. Ce cas a suscité un tel intérêt que l’on dit aujourd’hui que H.M. est le cas médical le plus étudié de l’histoire. Dans les années qui ont suivi, d’autres patients présentant des niveaux similaires de lésions de l’hippocampe et d’amnésie (causée par un accident ou une maladie) ont également été étudiés, et des milliers d’expériences ont littéralement étudié la physiologie de la plasticité neuronale dans l’hippocampe. Il est maintenant presque universellement admis que l’hippocampe joue une sorte de rôle important dans la mémoire ; cependant, la nature précise de ce rôle reste largement débattue.
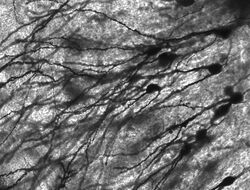
Nerfs colorés par le golgi dans l’hippocampe des rongeurs.
Rôle dans la mémoire
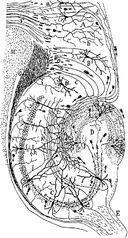
Dessin du circuit neuronal de l’hippocampe des rongeurs. S. Ramón y Cajal, 1911.
Les psychologues et les neuroscientifiques se disputent le rôle précis de l’hippocampe, mais s’accordent généralement à dire qu’il joue un rôle essentiel dans la formation de nouveaux souvenirs concernant des événements vécus personnellement (mémoire épisodique ou autobiographique). Certains chercheurs préfèrent considérer l’hippocampe comme faisant partie d’un plus grand système de mémoire du lobe temporal médian responsable de la mémoire déclarative générale (les souvenirs qui peuvent être explicitement verbalisés – ceux-ci incluraient, par exemple, la mémoire des faits en plus de la mémoire épisodique).
Article principal : Rôle de l’hippocampe dans la mémoire
Certaines preuves impliquent l’hippocampe dans le stockage et le traitement des informations spatiales. Des études sur des rats ont montré que les neurones de l’hippocampe ont des champs de tir spatiaux. Ces cellules sont appelées cellules de lieu. Certaines cellules tirent lorsque l’animal se trouve dans un endroit particulier, indépendamment de la direction du déplacement, tandis que la plupart sont au moins partiellement sensibles à la direction de la tête et à la direction du déplacement.
Article principal : Rôle de l’hippocampe dans la mémoire spatiale et la navigation
Hippocampe et dépression
- Une perte de volume de l’hippocampe,reflétant peut-être les effets d’un excès de glucocorticoïdes sur
la neurogenèse, a été identifiée dans des groupes de personnes déprimées par rapport aux témoins.
Article principal : Dépression et hippocampe
Historique
L’anatomiste Giulio Cesare Aranzi (vers 1564) a utilisé pour la première fois le terme hippocampe pour décrire l’organe cérébral en raison de sa ressemblance visuelle avec un hippocampe. Cet organe était initialement lié au sens de l’odorat, plutôt qu’à sa fonction connue dans l’acquisition de la mémoire. Le Russe Vladimir Bekhterev a noté le rôle de l’hippocampe dans la mémoire vers 1900, sur la base d’observations d’un patient présentant de profonds troubles de la mémoire. Cependant, pendant de nombreuses années, la vision conventionnelle de l’hippocampe était que, comme le reste du système limbique, il était responsable des émotions.
L’importance de l’hippocampe dans la mémoire a été portée à l’attention des chercheurs par le patient HM. HM souffrait d’un certain nombre de troubles de la mémoire antérograde et rétrograde à gradation temporelle (ces troubles font l’objet du film Memento) suite à l’ablation bilatérale de diverses structures du lobe médio-temporal (y compris l’ablation bilatérale de ses hippocampes) pour soulager de fréquentes crises d’épilepsie. Il est particulièrement important de noter que HM était encore capable d’apprendre des tâches procédurales (qui sont associées au striatum) et avait un QI supérieur à la moyenne. HM a démontré une dissociation unique frappante entre l’intelligence et la mémoire déclarative. La taille relative de la formation de l’hippocampe par rapport au volume total du cerveau est souvent conservée chez la plupart des espèces de mammifères. Néanmoins, il a été constaté que ces zones sont relativement hypotrophes chez les cétacés.
Anatomie
Article principal : Anatomie de l’hippocampe
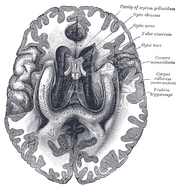
Hippocampe humain.
Coupe coronale colorée au Nissl du cerveau d’un singe macaque, montrant l’hippocampe (encerclé). Source : brainmaps.org
Anatomiquement, l’hippocampe est une élaboration du bord ducortex. Il peut être distingué comme une zone où le cortex se rétrécit en une seule couche de neurones très denses, qui s’enroule en forme de S serré. Les structures qui bordent le cortex constituent ce qu’on appelle le système limbique (du latin limbus =bordure) : l’hippocampe, le cortex cingulaire, le cortex olfactif et l’amygdale. Paul MacLean a un jour suggéré, dans le cadre de sa théorie du cerveau trinitaire, que les structures limbiques comprenaient la base neuronale des émotions. La plupart des neuroscientifiques ne croient plus à la validité du concept de “système limbique” unifié.
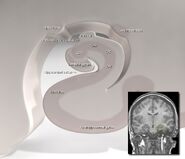
L’hippocampe, dans son ensemble, finit par ressembler à un tube incurvé, qui a été diversement analogué à un hippocampe, à une corne de bélier (Cornu Ammonis) ou à une banane.
Cette disposition générale se retrouve chez toutes les espèces de mammifères, du hérisson à l’homme, bien que les détails varient. Chez le rat, les deux hippocampes ressemblent étonnamment à une paire de bananes, jointes par la tige. Dans le cerveau de l’homme ou du singe, la partie de l’hippocampe située en bas, près de la base du lobe temporal, est beaucoup plus large que celle située en haut. L’une des conséquences de cette géométrie complexe est que les coupes transversales à travers l’hippocampe peuvent présenter une variété déconcertante de formes, selon l’angle et l’emplacement de la coupe.
Les connexions les plus fortes de l’hippocampe sont avec le cortex entorhinal (CE), qui se trouve à côté de lui dans le lobe temporal. Les couches superficielles du CE fournissent les entrées les plus nombreuses à l’hippocampe, et les couches profondes du CE reçoivent les sorties les plus nombreuses. L’EC, à son tour, est fortement, et réciproquement, connecté avec de nombreuses autres parties du cortex. L’hippocampe reçoit également une projection très importante de la zone septale médiane. La destruction de cette zone septale abolit le rythme thêta de l’hippocampe et altère gravement certains types de mémoire. (On pense que les drogues dites “de viol” exercent leurs effets amnésiants au moins en partie en antagonisant la projection cholinergique du septum médian vers l’hippocampe.)
Physiologie
Exemples de l’EEG de l’hippocampe du rat et de l’activité neuronale CA1 dans les modes thêta (éveillé/agité) et LIA (sommeil lent). Chaque graphique montre 20 secondes de données, avec un tracé EEG hippocampique en haut, des trames de pointes provenant de 40 cellules pyramidales CA1 enregistrées simultanément au milieu (chaque ligne de trame représente une cellule différente), et un graphique de la vitesse de course en bas. Le tracé du haut représente une période de temps pendant laquelle le rat recherchait activement des boulettes de nourriture éparpillées. Pour le tracé du bas, le rat était endormi.
L’hippocampe présente deux “modes” majeurs d’activité, chacun associé à un schéma distinct d’ondes EEG et d’activité de la population neuronale.Ces modes sont nommés d’après les schémas EEG qui leur sont associés : thêta et grande activité irrégulière (LIA). Voici quelques-unes de leurs principales caractéristiques chez le rat, l’animal qui a été le plus étudié :
Le mode thêta apparaît pendant les états de comportement actif et alerte (en particulier la locomotion), et aussi pendant le sommeil paradoxal (rêve). Dans le mode thêta, l’EEG est dominé par de grandes ondes régulières avec une gamme de fréquences de 6-9 Hz, et les principaux groupes de neurones de l’hippocampe (cellules pyramidales et cellules granuleuses) montrent une activité de population clairsemée, ce qui signifie que dans tout intervalle de temps court, la grande majorité des cellules sont silencieuses, tandis que la petite fraction restante tire à des taux relativement élevés, jusqu’à 50 pointes en une seconde pour les plus actifs d’entre eux. Une cellule active reste généralement active pendant une demi-seconde à quelques secondes. Au fur et à mesure que le rat se comporte, les cellules actives se taisent et de nouvelles cellules deviennent actives, mais le pourcentage global de cellules actives reste plus ou moins constant. Dans de nombreuses situations, la cellactivité est déterminée en grande partie par la localisation spatiale de l’animal,mais d’autres variables comportementales l’influencent aussi clairement.
Le mode LIA apparaît pendant le sommeil à ondes lentes (sans rêve), et aussipendant les états d’immobilité à l’état de veille, comme se reposer ou manger. Dans le mode LIA, l’EEG est dominé par des ondes aiguës, c’est-à-dire de grandes déviations du signal EEG survenant de manière aléatoire et durant 200 à 300 ms. Ces ondes aiguës déterminent également les modèles d’activité neuronale de la population. Entre elles, les cellules pyramidales et les cellules granuleuses sont très silencieuses (mais pas muettes). Au cours d’une onde aiguë, 5 à 10 % de la population peuvent émettre des potentiels d’action pendant une période de 50 msec ; beaucoup de ces cellules émettent non pas une mais une salve de pointes.
Ces deux modes d’activité de l’hippocampe peuvent être observés chez les primates ainsi que chez les rats, à l’exception importante qu’il a été difficile d’observer une rythmicité thêta robuste dans l’hippocampe des primates. Il existe cependant des ondes aiguës qualitativement similaires, et des changements similaires dépendant de l’état dans l’activité de la population neuronale..
Le rythme thêta
Parce que ses couches neuronales sont très denses, l’hippocampe génère certains des plus grands signaux EEG de toute structure cérébrale. Dans certaines situations, l’EEG est dominé par des ondes régulières, qui se poursuivent souvent pendant plusieurs secondes. Ce schéma EEG est connu sous le nom de rythme thêta. C’est l’un des premiers phénomènes EEG à avoir été découvert : la première description a été faite par Jung et Kornmuller, en 1938. Ce n’est toutefois qu’en 1954, avec la publication par Green et Arduini d’une étude longue et approfondie du rythme thêta chez le lapin, le chat et le singe, que l’intérêt s’est vraiment développé. Peut-être en grande partie parce qu’ils ont établi un lien entre le rythme thêta et l’excitation, qui était le sujet brûlant de l’époque, leur article a provoqué un flot d’études ultérieures, qui ont abouti à la publication de centaines d’études sur la physiologie et la pharmacologie du rythme thêta au cours des années 1950 et 1960. Malgré cette masse de travail plutôt impressionnante, de nombreuses questions sont restées sans réponse, notamment celle de la fonction. Même à l’heure actuelle, cette question des plus critiques n’a pas encore reçu de réponse convaincante.
La rythmicité thêta est très évidente chez les lapins et les rongeurs, et également clairement présente chez les chats et les chiens. La question de savoir si le thêta peut être observé chez les primates est une question épineuse. Green et Arduini n’ont signalé que de très brefs éclats de rythmicité plutôt irrégulière chez les singes, et la plupart des études ultérieures n’en ont guère vu davantage. Chez les rats (les animaux qui ont été de loin les plus étudiés), le thêta est observé principalement dans deux conditions : premièrement, lorsqu’un animal marche ou interagit activement avec son environnement ; deuxièmement, pendant le sommeil paradoxal. La fréquence augmente en fonction de la vitesse de course, commençant à environ 6,5 Hz dans le bas de l’échelle et augmentant jusqu’à environ 9 Hz dans le haut de l’échelle, bien que des fréquences plus élevées soient parfois observées pour des mouvements spectaculaires tels que des sauts à travers de grands espaces. Chez d’autres espèces animales, plus grandes, les fréquences thêta sont généralement un peu plus basses. La dépendance comportementale semble également varier selon les espèces : chez les chats et les lapins, le thêta est souvent observé pendant les états de vigilance immobile. Ce phénomène a également été rapporté chez les rats, mais uniquement lorsqu’ils sont gravement effrayés.
Le thêta n’est pas seulement confiné à l’hippocampe. Chez les rats, il peut être observé dans de nombreuses parties du cerveau, y compris dans presque toutes celles qui interagissent fortement avec l’hippocampe. On pense que le stimulateur du rythme se trouve dans la zone septale médiane : cette zone se projette dans toutes les régions qui présentent une rythmicité thêta, et sa destruction élimine le thêta dans tout le cerveau. (Il existe peut-être une exception, une petite zone de l’hypothalamus appelée le noyau supramamillaire, qui semble capable de maintenir le thêta indépendamment du septum dans certaines situations.)
La fonction du thêta, à supposer qu’il en ait une, n’a pas encore été expliquée de manière convaincante, bien que de nombreuses théories aient été proposées.La tendance la plus populaire a été de le relier à l’apprentissage et à la mémoire.Il est bien établi que les lésions du septum médian–le nœud central du système thêta–entraînent de graves perturbations de la mémoire.Cependant, le septum médian est plus que le simple contrôleur du thêta,il est aussi la principale source de projections cholinergiques vers l’hippocampe. Il n’a pas été établi que les lésions septales exercent leurs effets spécifiquement en éliminant le thêta.
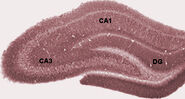
Ondes aiguës
Pendant le sommeil, ou pendant les états d’éveil lorsqu’un animal se repose ou n’est pas autrement engagé avec son environnement, l’EEG hippocampique montre un schéma d’ondes lentes irrégulières, un peu plus grandes en amplitude que les ondes thêta. Ce schéma est occasionnellement interrompu par de grandes poussées appelées ondes aiguës. Ces événements sont associés à des salves d’activité en pic, d’une durée de 50 à 100 msec, dans les cellules pyramidales de CA3 et de CA1. Ils sont également associés à des oscillations EEG de courte durée et de haute fréquence appelées “ondulations”. Les ondulations, dont la fréquence est comprise entre 150 et 200 Hz chez le rat, ne peuvent généralement être détectées que par des électrodes situées soit à l’intérieur, soit très près de la couche du corps cellulaire de CA1. En revanche, les électrodes situées n’importe où à l’intérieur de l’hippocampe, ou même dans les structures cérébrales voisines, détecteront souvent les ondes aiguës sous forme de grandes déviations EEG lentes, d’une durée de 200 à 400 msec.
Chez les rats, les ondes aiguës sont les plus fortes pendant le sommeil, où elles se produisent à un taux moyen d’environ 1 par seconde, mais dans un schéma temporel très irrégulier. Les ondes aiguës se produisent également pendant les états d’éveil inactifs, mais elles sont alors moins fréquentes et généralement plus petites. Des ondes aiguës ont également été observées dans le lobe temporal humain et dans l’hippocampe des singes.Chez les singes, les ondes aiguës sont assez robustes, mais ne se produisent pas aussi fréquemment que chez les rats.
L’un des aspects les plus intéressants des ondes aiguës est qu’elles semblent être associées à la mémoire. Wilson et McNaughton 1994, et de nombreuses études ultérieures, ont rapporté que lorsque les cellules de lieu de l’hippocampe ont des champs de tir spatiaux qui se chevauchent (et tirent donc souvent de façon quasi-simultanée), elles ont tendance à présenter une activité corrélée pendant le sommeil qui suit la session comportementale. Il a été constaté que ce renforcement de la corrélation, communément appelé réactivation, se limite principalement aux ondes aiguës. Il a été proposé que les ondes aiguës soient, en fait, des réactivations de modèles d’activité neuronale qui ont été mémorisés pendant le comportement, sous l’effet du renforcement des connexions synaptiques au sein de l’hippocampe. Cette idée constitue un élément clé de la théorie de la “mémoire en deux étapes”, défendue par Buzsaki et d’autres, qui propose que les souvenirs sont stockés dans l’hippocampe pendant le comportement, puis transférés plus tard au néocortex pendant le sommeil : les ondes aiguës sont suggérées pour conduire les changements synaptiques de Hebbian dans les cibles néocorticales des voies de sortie de l’hippocampe.
Evolution
L’hippocampe a une apparence généralement similaire à travers la gamme d’espèces de mammifères, des basales comme le hérisson aux plus “avancées” comme l’homme.Le rapport taille de l’hippocampe/taille du corps augmente largement, étant environdeux fois plus grand pour les primates que pour le hérisson. Ainsi, l’hippocampe occupe un volume beaucoup plus important du manteau cortical chez les rongeurs que chez les primates.
Il existe également une relation générale entre la taille de l’hippocampe et la mémoire spatiale : lorsque l’on compare des espèces similaires, celles qui ont une plus grande capacité de mémoire spatiale tendent à avoir des volumes d’hippocampe plus importants…. Cette relation s’étend également aux différences entre les sexes : dans les espèces où les mâles et les femelles montrent de fortes différences dans la capacité de mémoire spatiale, ils ont également tendance à montrer des différences correspondantes dans le volume de l’hippocampe
Les espèces non-mammifères n’ont pas une structure cérébrale qui ressemble à l’hippocampe des mammifères, mais elles en ont une qui est considérée comme homologue. L’hippocampe, comme indiqué ci-dessus, est essentiellement le bord médian du cortex. Seuls les mammifères ont un cortex pleinement développé, mais la structure dont il est issu, appelée pallium, est présente chez tous les vertébrés, même les plus primitifs comme la lamproie ou la myxine. Le pallium est généralement divisé en trois zones : médiale, latérale et dorsale. Le pallium médian forme le précurseur de l’hippocampe. Il ne ressemble pas visuellement à l’hippocampe, car les couches ne sont pas déformées en forme de S ou enveloppées par le gyrus denté, mais l’homologie est indiquée par de fortes affinités chimiques et fonctionnelles. Il existe maintenant des preuves que ces structures semblables à l’hippocampe sont impliquées dans la cognition spatiale chez les oiseaux, les reptiles et les poissons.
Chez les oiseaux, la correspondance est suffisamment bien établie pour que la plupart des anatomistes se réfèrent à la zone palliale médiane comme étant l'”hippocampe aviaire”. De nombreuses espèces d’oiseaux ont de fortes aptitudes spatiales, en particulier celles qui cachent de la nourriture. Il est prouvé que les oiseaux qui cachent de la nourriture ont un hippocampe plus grand que les autres types d’oiseaux, et que des dommages à l’hippocampe provoquent des déficiences de la mémoire spatiale….
L’histoire des poissons est plus complexe. Chez les poissons téléostéens (qui constituent la grande majorité des espèces existantes), le cerveau antérieur est étrangement déformé par rapport aux autres types de vertébrés. La plupart des neuroanatomistes pensent que le cerveau antérieur des téléostéens est essentiellement évasé, comme une chaussette retournée, de sorte que les structures qui se trouvent à l’intérieur, près des ventricules, chez la plupart des vertébrés, se retrouvent à l’extérieur chez les téléostéens, et vice versa. L’une des conséquences de ce phénomène est que l’on pense que le pallium médian (zone “hippocampique”) d’un vertébré typique correspond au pallium latéral d’un poisson typique. Plusieurs types de poissons (en particulier le poisson rouge) ont démontré expérimentalement qu’ils avaient de fortes capacités de mémoire spatiale, formant même des “cartes cognitives” des zones qu’ils habitent. Il est prouvé qu’une lésion du pallium latéral altère la mémoire spatiale (la navigation sur de longues distances, telle que la localisation par le saumon, semble toutefois reposer sur des mécanismes différents). On ne sait pas encore si le pallium médian joue un rôle similaire chez des vertébrés encore plus primitifs, comme les requins et les raies, ou même les lamproies et les myxines. Certains types d’insectes, et de mollusques comme la pieuvre, ont également de fortes capacités d’apprentissage spatial et de navigation, mais celles-ci semblent fonctionner différemment du système spatial des mammifères, de sorte qu’il n’y a pas encore de bonne raison de penser qu’ils ont une origine évolutive commune ; il n’y a pas non plus de similitude suffisante dans la structure du cerveau pour permettre d’identifier quelque chose qui ressemble à un “hippocampe” chez ces espèces.
Voir aussi
- Amygdalohippocampectomie
- Faisceau médian du cerveau antérieur
- Noyaux septaux. noyaux
Références & Bibliographie
Textes clés
Livres
- Aboitiz, F, Morales D, Montiel J (2003). L’origine évolutive de l’isocortex des mammifères : Vers une approche intégrée développementale et fonctionnelle. Behav. Brain Sciences 26 : 535-552.
- Amaral, D ; Lavenex P (2006). “Ch 3. Neuroanatomie hippocampique” Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J The Hippocampus Book, Oxford University Press.
- Broglio, C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). Signes distinctifs d’un plan commun du cerveau antérieur des vertébrés : Des zones palliales spécialisées pour la mémoire spatiale, temporelle et émotionnelle chez les poissons actinoptérygiens. Brain Res. Bull. 57 : 397-399.
- Buzsáki, G (2002). Les oscillations thêta dans l’hippocampe. Neuron 33 : 325-340.
- Buzsáki, G (2006). Rythmes du cerveau.
- Cantero, JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (2003). Oscillations thêta dépendantes du sommeil dans l’hippocampe et le néocortex humains. J. Neurosci. 23 : 10897-10903.
- Colombo, M, Broadbent N (2000). L’hippocampe aviaire est-il un homologue fonctionnel de l’hippocampe des mammifères ? Neurosci. Biobehav. Rev. 24 : 465-484.
- Eichnbaum, H ; Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System, MIT Press.
- Ekstrom, AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). Les réseaux cellulaires qui sous-tendent la navigation spatiale humaine. Nature 425 : 184-188.
- Gray, JA ; McNaughton N (2000). La neuropsychologie de l’anxiété : An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press.
- Green, JD, Arduini AA (1954). L’activité électrique hippocampique dans l’éveil. J. Neurophysiol. 17 : 533-557.
- Jacobs, LF, Gaulin SJ, Sherry DF, Hoffman GE (1990). Evolution de la cognition spatiale : les modèles sexospécifiques de comportement spatial prédisent la taille de l’hippocampe. PNAS 87 : 6349-6352.
- Jacobs, LF (2003). L’évolution de la carte cognitive. Brain Behav. Evol. 62 : 128-139.
- Kirk, IJ, McNaughton N (1991). Tir des cellules supramammillaires et activité lente rythmique hippocampique. Neuroreport 11 : 723-725.
- Maguire, EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). Navigation-related structural change in the hippocampi of taxi drivers. PNAS 97 : 4398-4403.
- McNaughton, BL, Battaglia FP, Jensen O, Moser EI, Moser MB (2006). L’intégration des chemins et la base neuronale de la “carte cognitive”. Nat. Rev. Neurosci. 7 : 663-678.
- Moser, EI, Kropf E, Moser M-B (2008). Cellules de lieu, cellules de grille, et le système de représentation spatiale du cerveau. Ann. Rev. Neurosci. 31.
- Nieuwenhuys, R (1982). Un aperçu de l’organisation du cerveau des poissons actinoptérygiens. Am. Zool. 22 : 287-310.
- O’Kane, G, Kensinger EA, Corkin S (2004). Preuve de l’apprentissage sémantique dans l’amnésie profonde : An investigation with patient H.M.. Hippocampus 14 : 417-425.
- O’Keefe, J ; Nadel L (1978). L’hippocampe comme carte cognitive, Oxford University Press.
- Portavella, M, Vargas JP, Torres B, Salas C (2002). Les effets des lésions palliales télencéphaliques sur l’apprentissage spatial, temporel et émotionnel chez le poisson rouge. Brain Res. Bull. 57 : 397-399.
- Rodríguez, F, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C (2002). Mémoire spatiale et pallium hippocampique à travers l’évolution des vertébrés : aperçus des reptiles et des poissons téléostéens. Brain Res. Bull. 57 : 499-503.
- Sainsbury, RS, Heynen A, Montoya CP (1987). Corrélats comportementaux du thêta de type 2 hippocampique chez le rat. Physiol. Behav. 39 : 513-519.
- Scoville, WB, Milner B (1957). Perte de mémoire récente après des lésions hippocampiques bilatérales. J. Neurol. Neurosurg. Psych. 20 : 11-21.
- Shettleworth, SJ (2003). Mémoire et spécialisation de l’hippocampe chez les oiseaux stockeurs de nourriture : Défis pour la recherche sur la cognition comparative. Brain Behav. Evol. 62 : 108-116.
- Skaggs, WE, McNaughton BL, Wilson MA, Barnes CA (1996). Précession de la phase thêta dans les populations neuronales hippocampiques et la compression des séquences temporelles. Hippocampus 6 : 149-176.
- Squire, LR (1992). La mémoire et l’hippocampe : une synthèse des résultats obtenus sur les rats, les singes et les humains. Psych. Rev. 99 : 195-231.
- Squire, LR ; Schacter DL (2002). The Neuropsychology of Memory, Guilford Press.
- Vanderwolf, CH (1969). Activité électrique hippocampique et mouvement volontaire chez le rat. EEG & Clin. Neurophysiol. 26 : 407-418.
- Vargas, JP, Bingman VP, Portavella M, López JC (2006). Télencéphale et espace géométrique chez le poisson rouge. Eur. J. Neurosci. 24 : 2870-2878.
- West, MJ (1990). Études stéréologiques de l’hippocampe : une comparaison des subdivisions de l’hippocampe de diverses espèces, y compris les hérissons, les rongeurs de laboratoire, les souris sauvages et les hommes…. Prog. Brain Res. 83 : 13-36.
Papiers
- Amaral DG et Cowan WM. 1980. Afférences sous-corticales de la formation hippocampique chez le singe. Journal of Comparative Neurology. Feb 15 ; 189(4):573-91.
- Duvernoy, H. (2005) The Human Hippocampus, 3rd ed. Berlin : Springer-Verlag.
Matériel supplémentaire
Articles
- Google Scholar
- http://www.psycheducation.org/emotion/hippocampus.htm Superbes circuits cérébraux ! !!
- Cerveaux à UCDavis hippocampe
- Hippocampe artificiel
- CerveauInfo à l’Université de Washington hier-164
- John O’Keefe & Lynn Nadel (1978) L’hippocampe comme carte cognitive , Oxford University Press. Texte intégral
Images supplémentaires
Ajouter une photo à cette galerie
Cerveau humain : Système limbique
Amygdale – Gyrus cingulaire – Gyrus fornicateur – Hippocampe – Hypothalamus – Corps mammillaire – Nucléus accumbens – Cortex orbitofrontal – Gyrus parahippocampique
|
v-d-e
Cerveau humain : cerveau antérieur (cerebrum – cortex cérébral – hémisphères cérébraux, matière grise) (TA A14.1.09.002-240, 301-320, GA 9.818-826) |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Lobe frontal |
|
||||||||||||||||
| Lobe pariétal |
|
Superolatéral
|
Médial/inférieur
|
Les deux
|
|||||||||||||
| Lobe occipital |
|
Superolateral
|
Médial/inférieur
|
||||||||||||||
| Lobe temporal |
|
Superolateral
|
Gyrus fusiforme médian/inférieur
|
||||||||||||||
| Interlobar sulci/fissures |
. |
Superolatéral
|
Médiale/inférieure
|
||||||||||||||
| Lobe limbique |
|
Autres
|
|||||||||||||||
| Lobe insulaire |
Gyrus long de l’insula – Gyri courts de l’insula – Sillon circulaire de l’insula |
||||||||||||||||
| Général |
Operculum – Pôles des hémisphères cérébraux |
||||||||||||||||
Certaines catégorisations sont des approximations, et certaines aires de Brodmann recouvrent des gyri.
|
|||||||||||||||||
Cette page utilise un contenu sous licence Creative Commons de Wikipedia (voir les auteurs).