US Pharm. 2012;37(6):26-29.
La maladie rénale chronique (MRC) est définie comme une atteinte rénale persistante accompagnée d’une réduction du taux de filtration glomérulaire (TFG) et de la présence d’albuminurie. La prévalence de l’IRC n’a cessé d’augmenter au cours des deux dernières décennies et, selon les rapports, elle touchait plus de 13 % de la population américaine en 2004.1 En 2009, plus de 570 000 personnes aux États-Unis ont été classées comme souffrant d’insuffisance rénale terminale (IRT), dont près de 400 000 dialysés et plus de 17 000 transplantés.2 On considère qu’un patient est atteint d’IRT lorsqu’il a besoin d’un traitement de substitution, y compris la dialyse ou la transplantation rénale. L’augmentation de l’incidence de l’IRC est attribuée au vieillissement de la population et à l’augmentation de l’hypertension (HTN), du diabète et de l’obésité au sein de la population américaine. L’IRC est associée à une multitude de complications, notamment des déséquilibres électrolytiques, des troubles minéraux et osseux, l’anémie, la dyslipidémie et l’hypertension. Il est bien connu que l’IRC est un facteur de risque de maladie cardiovasculaire (MCV) et qu’un DFG réduit et l’albuminurie sont indépendamment associés à une augmentation de la mortalité cardiovasculaire et toutes causes confondues.3,4
L’HTN est signalée chez 85% à 95% des patients atteints d’IRC (stades 3-5).5 La relation entre l’HTN et l’IRC est de nature cyclique. L’HTA non contrôlée est un facteur de risque de développement de l’IRC, elle est associée à une progression plus rapide de l’IRC et elle est la deuxième cause d’IRT aux États-Unis.6,7 Par ailleurs, la progression de la maladie rénale peut exacerber l’HTA non contrôlée en raison de l’expansion volumique et de l’augmentation de la résistance vasculaire systémique.De nombreuses directives discutent de l’importance d’abaisser la pression artérielle (PA) pour ralentir la progression de la maladie rénale et réduire la morbidité et la mortalité cardiovasculaires.8-10 Cependant, pour atteindre et maintenir un contrôle adéquat de la PA, la plupart des patients atteints d’IRC ont besoin d’une combinaison d’agents antihypertenseurs ; souvent, il est nécessaire d’utiliser jusqu’à trois ou quatre classes de médicaments.11
Pathophysiologie
L’hypertension est l’une des principales causes de l’IRC en raison des effets délétères de l’augmentation de la PA sur la vascularisation rénale.Une PA élevée non contrôlée à long terme entraîne une pression intraglomérulaire élevée, altérant la filtration glomérulaire12,13. Les dommages subis par les glomérules entraînent une augmentation de la filtration des protéines, ce qui se traduit par une augmentation normale des quantités de protéines dans l’urine (microalbuminurie ou protéinurie).12,13 La microalbuminurie est la présentation de petites quantités d’albumine dans l’urine et constitue souvent le premier signe de la maladie de Crohn. La protéinurie (rapport protéines-créatinine ≥200 mg/g) se développe à mesure que l’IRC progresse et est associée à un mauvais pronostic pour les maladies rénales et les MCV.3,4,14
Comme nous l’avons vu précédemment, la relation entre l’IRC et l’HTN est cyclique, car l’IRC peut contribuer à l’HTN ou la provoquer. Une pression artérielle élevée entraîne des lésions des vaisseaux sanguins à l’intérieur du rein, ainsi que dans tout le corps. Ces lésions nuisent à la capacité du rein à filtrer les liquides et les déchets du sang, ce qui entraîne une augmentation du volume de liquide dans le sang et donc une augmentation de la PA.
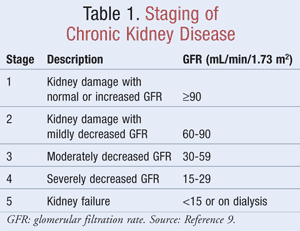
Stadification de l’IRC
Le DFG estimé, qui aide les cliniciens à déterminer dans quelle mesure les reins filtrent les déchets, est utilisé dans la stadification de l’IRC. La National Kidney Foundation définit l’IRC comme étant soit une atteinte rénale, identifiée par des marqueurs dans l’urine ou le sang ou par imagerie, avec ou sans modification du DFG, soit un DFG <60 mL/min/1,73 m2 pendant au moins 3 mois9. Le TABLEAU 1 décrit les critères de stadification tels que déterminés par les lignes directrices de la Kidney Disease Outcomes Quality Initiative (K/DOQI).9
Objectifs du traitement
Les patients atteints d’IRC non diabétique et diabétique devraient avoir un objectif de TA <130/80 mmHg.8-10Le maintien du contrôle de la PA et la réduction de la protéinurie chez les patients atteints d’IRC et d’HTN sont essentiels pour la prévention de la progression de la maladie rénale et le développement ou l’aggravation des MCV.8,9
La littérature récente suggère que les objectifs de PA dans l’IRC diabétique et non diabétique doivent être individualisés en fonction de la présence de protéinurie. Certains essais n’ont pas réussi à démontrer une réduction des résultats cardiovasculaires ou rénaux chez les patients diabétiques et non diabétiques atteints d’IRC lorsqu’une cible de TA de <130/80 mmHg est atteinte par rapport à une baisse de la TA à <140/90 mmHg.15,16 Cependant, les patients qui ont une protéinurie sont moins susceptibles de connaître une baisse de la fonction rénale, une insuffisance rénale ou un décès lorsque la cible de TA la plus basse est atteinte.15,17Il est probable que les futures directives puissent inclure un objectif de BP plus faible,<130/80 mmHg, pour les patients présentant une protéinurie, mais maintenir un objectif de<140/90 mmHg pour les patients sans protéinurie.
Traitement
Les agents qui non seulement abaissent la PA mais réduisent également la protéinurie sont recommandés comme traitement de première intention pour la plupart des patients atteints d’IRC et d’HTN ; les données indiquent qu’il peut y avoir des avantages significatifs à long terme sur les résultats cardiovasculaires et rénaux lorsque la protéinurie est réduite.9Plusieurs classes d’agents antihypertenseurs peuvent jouer un rôle dans le traitement de l’IRC et de l’HTN. Les agents qui ciblent le système thérénine-angiotensine-aldostérone (SRAA), comme les inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA) ou les antagonistes des récepteurs de l’angiotensine (ARA), sont généralement considérés comme un traitement antihypertenseur de première intention pour cette population de patients8,9,18. Le TABLEAU 2 fournit des indications sur les agents antihypertenseurs recommandés pour les patients atteints d’IRC avec ou sans diabète et avec ou sans protéinurie.
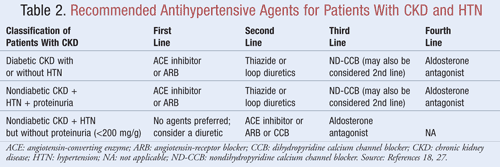
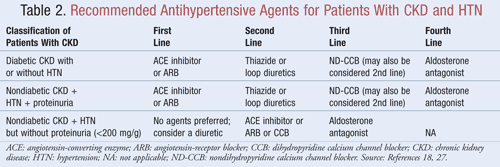
Inhibiteurs de l’ECA ou ARA : Des études ont montré que les agents antihypertenseurs qui ciblent le système rénine-angiotensine préviennent le déclin rénal plus que les autres agents, même en atteignant des objectifs de TA similaires.19 Ces résultats ont été observés principalement chez les patients présentant une protéinurie, alors que les avantages étaient moins importants pour ceux qui ne présentaient pas de protéinurie. Sur la base de ces résultats, les lignes directrices recommandent le traitement par un inhibiteur de l’ECA ou un ARA comme traitement de première intention pour les personnes diabétiques ou celles qui présentent une néphropathie non diabétique, une HTN et une protéinurie. Les données indiquent que les inhibiteurs de l’ECA et les ARA sont aussi efficaces l’un que l’autre pour abaisser la PA et réduire la protéinurie.20 Une récente méta-analyse suggère que le traitement par inhibiteur de l’ECA pourrait être plus avantageux que le traitement par ARA pour le traitement de l’HTN en raison d’une réduction de 10 % de la mortalité toutes causes confondues.21 Ces résultats ont été déterminés pour des patients souffrant d’HTN et ne s’appliquaient pas aux patients présentant d’autres comorbidités comme l’IRC. Par conséquent, le choix d’un agent plutôt qu’un autre dépendra de facteurs spécifiques au patient, tels que les effets secondaires potentiels et le coût. Le traitement par un inhibiteur de l’ECA et un ARA n’est pas recommandé, car il a été démontré que cette association aggrave la fonction rénale. L’association d’un IEC et d’un ARA n’a pas réduit la mortalité ou la morbidité cardiovasculaire par rapport à la monothérapie par un IEC20,21
Les IEC et les ARA sont généralement bien tolérés. Les inhibiteurs de l’ECA peuvent provoquer une toux sèche, qui nécessite malheureusement souvent une modification du traitement. Les ARA ne sont pas associés à une toux sèche. L’œdème de Quincke est très rare ; toutefois, les patients qui commencent à prendre des inhibiteurs de l’ECA ou des ARA doivent être informés des signes et des symptômes qui peuvent être associés à l’œdème de Quincke.Informez les patients que l’œdème de Quincke est peu probable, mais que s’ils ressentent un gonflement du visage (incluant souvent les paupières) et/ou des extrémités, ils doivent interrompre le traitement et consulter immédiatement un médecin.18
Thiazide vs diurétiques à boucles : Pour les patients sans protéinurie, un traitement de première intention privilégié n’a pas été clairement établi, et d’autres agents, comme un thiazide, peuvent être envisagés. Les patients atteints d’IRC et d’HTN présentent souvent une rétention ou une surcharge liquidienne. Par conséquent, les diurétiques sont souvent nécessaires dans leur régime de traitement. Les diurétiques de l’anse sont recommandés pour les patients atteints d’IRC aux stades 1 à 3 (DFG ≥30 ml/min) et ont été reconnus comme des agents efficaces pour la réduction de la PA et du risque de MCV.22 Les diurétiques de l’anse sont recommandés pour les patients atteints d’IRC aux stades 4 ou 5 (DFG <30 ml/min), car ils se sont avérés plus efficaces pour réduire le volume de liquide extracellulaire chez les patients dont le DFG est sévèrement réduit.18 Cependant, l’effet à long terme des diurétiques de l’anse sur les résultats cardiovasculaires n’a pas été clairement établi.23
Les diurétiques thiazidiques (chlorthalidone, hydrochlorothiazide) et les diurétiques de l’anse (bumétanide, furosémide, torsemide) provoquent tous une hyperuricémie (augmentation de la miction). Cette augmentation de la perte de liquide peut conduire à un déséquilibre électrolytique. Il est important que les patients sous ces médicaments fassent l’objet d’une surveillance de leurs électrolytes afin de s’assurer qu’ils ne présentent pas d’anomalies électrolytiques telles qu’une hyperkaliémie ou une hypomagnésémie. Une hypotension orthostatique peut survenir en réponse à n’importe quel agent antihypertenseur ; toutefois, elle est fréquente avec les diurétiques. Il est important de conseiller les patients qui commencent un traitement diurétique sur la nécessité de se lever lentement à partir d’une position assise ou couchée.24,25
Bloqueurs des canaux calciques : Les bloqueurs des canaux calciques (BCC) sont considérés comme un traitement de deuxième ou de troisième intention dans le traitement de l’HTN chez les patients atteints d’IRC.8,9Bien qu’il puisse n’y avoir aucune différence dans l’effet sur la baisse de la PA entre les BCC non dihydropyridiniques (BCC ND ; par exemple, diltiazem, vérapamil) et les BCC dihydropyridiniques (par exemple, amlodipine, nifédipine), il a été démontré que les ND-CCB réduisaient significativement la protéinurie, qu’ils soient utilisés seuls ou en association avec un IEC ou un ARA26 . En raison de leur potentiel de réduction de la protéinurie, en plus de leurs effets antihypertenseurs, les ND-CCB devraient être considérés comme un traitement de deuxième ou troisième intention chez les patients atteints d’IRC diabétique ou d’IRC non diabétique présentant une protéinurie. Les inhibiteurs calciques de type dihydropyridine peuvent être utilisés comme agents de deuxième intention chez les patients atteints d’IRC non diabétique sans protéinurie. Les effets indésirables courants comprennent l’œdème et la constipation avec les inhibiteurs calciques non nucléosidiques (en particulier le vérapamil) et les bouffées vasomotrices et l’œdème périphérique avec les agents dihydropyridiniques.18
Antagonistes de l’aldostérone : L’aldostérone joue un rôle gravement délétère dans la progression de l’IRC. Les antagonistes des récepteurs de l’aldostérone (par exemple, la spironolactone, l’éplérénone) peuvent avoir une place dans le rôle du traitement de l’IRC lorsque les objectifs de PA n’ont pas été atteints avec le traitement de première et de deuxième intention. Ces agents ont montré dans des essais humains qu’ils permettaient une réduction de la protéinurie lorsqu’ils étaient ajoutés à un inhibiteur de l’ECA ou à un ARA.27,28
Les antagonistes de l’aldostérone sont des diurétiques épargneurs de potassium, qui augmentent le risque d’hyperkaliémie, en particulier s’ils sont pris avec un inhibiteur de l’ECA ou un ARA. Il est important que les patients qui commencent à prendre des diurétiques d’épargne potassique fassent vérifier leur taux de potassium pour s’assurer qu’ils ne présentent pas d’anomalies électrolytiques. Les symptômes de l’hyperkaliémie incluent l’arythmie cardiaque et une faiblesse musculaire sévère.Malheureusement, l’hyperkaliémie peut se présenter de manière asymptomatique, ce qui souligne l’importance de la surveillance.18,27
Inhibiteur de la rénine : L’aliskirène est le seul inhibiteur de la rénine actuellement disponible sur le marché. Il est indiqué pour le traitement de l’HTN en monothérapie ou en association avec le valsartan. Les données récentes de l’essai ALTITUDE ont conduit à la contre-indication de son utilisation avec les inhibiteurs de l’ECA ou les ARA chez les patients souffrant de diabète ou d’insuffisance rénale (DFG <60 ml/min) en raison du risque accru d’insuffisance rénale, d’hypotension et d’hyperkaliémie.29 L’aliskirène peut être envisagé si le patient ne peut pas prendre un inhibiteur de l’ECA ou un ARA ; cependant, son utilisation ne peut être recommandée chez les patients souffrant d’insuffisance rénale de stade 4 ou 5.30
Bêta-bloquants : Les données qui évaluent l’effet des bêta-bloquants sur la progression de l’IRC et de la protéinurie sont limitées.27 Bien que les bêta-bloquants ne soient pas inclus dans le TABLEAU 2, ces agents peuvent être envisagés comme traitement de deuxième ou troisième intention si le patient a une indication impérieuse pour un bêta-bloquant, comme une maladie coronarienne ou une insuffisance cardiaque chronique.18
Recommandations non pharmacologiques
Chronothérapie : Ce type de thérapie prend en compte les schémas circadiens de la PA et instaure l’administration de médicaments antihypertenseurs en respectant les schémas quotidiens, en abandonnant l’administration de tous les médicaments antihypertenseurs le matin. Des essais ont démontré une amélioration du contrôle de la PA sur 24 heures chez les patients administrant des inhibiteurs calciques le soir plutôt que le matin.31,32 D’autres études ont identifié un bénéfice de l’administration nocturne d’autres médicaments antihypertenseurs tels que les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) ou les ARA.33,34 La chronothérapie peut être envisagée pour ceux qui ne parviennent pas à atteindre leur objectif de PA en administrant tous les agents antihypertenseurs le matin. Si les patients prennent plus de deux agents antihypertenseurs, il peut être approprié d’administrer deux agents le matin et les agents supplémentaires le soir.
Modification du mode de vie : L’augmentation de l’activité physique, la perte de poids et les modifications du régime alimentaire sont recommandées pour tous les patients souffrant d’HTN.8 La modification du mode de vie demeure une composante essentielle du traitement de l’HTN, que les patients aient ou non besoin de médicaments pour atteindre leur objectif de TA. Le régime DASH (Dietary Approaches to Stop Hypertension) met l’accent sur une consommation accrue de fruits et de légumes, l’inclusion de produits laitiers à faible teneur en matières grasses et de protéines maigres, et une restriction des graisses saturées ; il a été démontré que ce régime alimentaire abaisse de manière significative la PA systolique, de façon presque équivalente à la réduction obtenue par une monothérapie antihypertensive.35 En outre, la diminution de la consommation de sodium et d’alcool a été établie comme une intervention efficace pour réduire la PA.8L’initiation à ces pratiques alimentaires saines tout en augmentant l’activité quotidienne augmente le bénéfice reçu du traitement antihypertenseur et peut jouer un rôle essentiel dans l’atteinte des objectifs de PA.
Résumé
L’interrelation de l’IRC et de l’HTN conduit à souligner davantage l’importance d’atteindre le contrôle de la PA et de diminuer la protéinurie, si elle est présente. Les agents qui réduisent la protéinurie en plus de la PA sont généralement de première intention, mais les patients ont souvent besoin de trois à quatre agents antihypertenseurs pour atteindre leurs objectifs et minimiser leur risque de MCV et d’IRT. En outre, les modifications d’un mode de vie sain doivent toujours être considérées comme une composante essentielle de tout régime thérapeutique antihypertenseur.
1. Coresh J, Selvin E, Stevens LA, et al. Prévalence de la maladie rénale chronique aux États-Unis. JAMA. 2007;298:2038-2047.
2. Collins AJ, Foley RN, Chavers B, et al. Rapport annuel des données 2011 du système de données rénales des États-Unis. Am J Kidney Dis. 2012;59(suppl 1):evii.
3. Matsushita K, van der Velde M, Astor BC, et al.Association of estimated glomerular filtration rate and albuminuria withall-cause and cardiovascular mortality in general population cohorts : acollaborative meta-analysis. Lancet. 2010;375:2073-2081.
4. Rashidi A, Sehgal AR, Rahman M, O’Connor AS. La maladie rénale chronique, le diabète sucré et l’infarctus du myocarde : des facteurs de risque équivalents pour la mortalité cardiovasculaire chez les patients de plus de 65 ans. Am J Cardiol. 2008;102:1668-1673.
5. Rao MV, Qiu Y, Wang C, Bakris G. Hypertension et IRC : Kidney Early Evaluation Program (KEEP) et National Health and NutritionExamination Survey (NHANES), 1999-2004. Am J Kidney Dis. 2008;51(suppl 2):S30-S37.
6. Botdorf J, Chaudhary K, Whaley-Connell A. Hypertension dans les maladies cardiovasculaires et rénales. Cardiorenal Med. 2011;1:183-192.
7. Segura J, Ruilope L. Hypertension chez les patients non diabétiques modérés à sévères atteints d’IRC. Adv Chronic Kidney Dis. 2011;18:23-27.
8. Chobanian AV, Bakris GL, Black HR, et al. The seventhreport of the Joint National Committee on Prevention, Detection,Evaluation, and Treatment of High Blood Pressure : the JNC 7 report. JAMA. 2003;289:2560-2572.
9. National Kidney Foundation. K/DOQI clinical practiceguidelines for chronic kidney disease : evaluation, classification, andstratification. Am J Kidney Dis. 2002;39(suppl 1):S1-S266.
10. Association américaine du diabète. Normes de soins médicaux en matière de diabète-2012. Diabetes Care. 2012;35(suppl 1):S1-S63.
11. Bakris GL, Williams M, Dworkin L, et al. Préserver la fonction rénale chez les adultes atteints d’hypertension et de diabète : une approche consensuelle. Groupe de travail des comités exécutifs de la National Kidney Foundation Hypertension and Diabetes. Am J Kidney Dis. 2000;36:646-661.
12. Keane WF, Eknoyan G. Proteinuria, albuminuria, risk,assessment, detection, elimination (PARADE) : a position paper for theNational Kidney Foundation. Am J Kidney Dis. 1999;33:1004-1010.
13. Yoshioka T, Rennke HG, Salant DJ, et al. Role ofabnormally high transmural pressure in the permselectivity defect ofglomerular capillary wall : a study in early passive Heymann nephritis. Circ Res. 1987:61:531-538.
14. Sarnak M, Levey A, Schoolwerth A, et al. Kidneydisease as a risk factor for the development of cardiovascular disease : astatement from the American Heart Association Councils on Kidney inCardiovascular Disease, High Blood Pressure Research, ClinicalCardiology, and Epidemiology and Prevention. Circulation. 2003;108:2154-2169.
15. Upadhyay A, Earley A, Haynes SM, Uhlig K. Systematicreview : blood pressure target in chronic kidney disease and proteinuriaas an effect modifier. Ann Intern Med. 2011;154:541-548.
16. Cushman C, Evan GW Byington RP, et al. The ACCORDstudy group. Contrôle intensif de la pression artérielle dans le diabète de type 2mellitus. N Engl J Med. 2010;363:1575-1585.
17. Brenner BM, Cooper ME, De Zeeuw D, et al. Effets du losartan sur les résultats rénaux et cardiovasculaires dans le diabète de type 2 et la néphropathie. N Engl J Med. 2001;345:861-869.
18. Kidney Disease Outcomes Quality Initiative (K/DOQI).K/DOQI clinical practice guidelines on hypertension and antihypertensiveagents in chronic kidney disease. Am J Kidney Dis. 2004;43(suppl 1):S1-S290.
19. Remuzzi G, Chiurchiu C, Ruggenenti P. Proteinuria predicting outcome in renal disease : nondiabetic nephropathies (REIN). Kidney Int Suppl. 2004;66:S90-S96.
20. Sharma P, Blackburn RC, Parke CL, et al.Inhibiteurs de l’enzyme de conversion de l’angiotensine et bloqueurs des récepteurs de l’angiotensine pour les adultes atteints de néphropathie chronique non diabétique précoce (stade 1 à 3). Cochrane Database Syst Rev. 2011 ;(10):CD007751.
21. van Vark LC, Bertrand M, Akkerhuis KM, et al.Angiotensin-converting enzyme inhibitors reduce mortality inhypertension : a meta-analysis of randomized clinical trials ofrenin-angiotensin-aldosterone system inhibitors involving 158,998patients. Eur Heart J. 2012 Apr 17 ; Epub ahead of print.
22. Principaux résultats chez les patients hypertendus à haut risque randomisés entre un inhibiteur de l’enzyme de conversion de l’angiotensine ou un inhibiteur calcique et un diurétique : l’essai Antihypertensive and Lipid-Lowering Treatmentto Prevent Heart Attack Trial (ALLHAT). JAMA. 2002;288:2981-2997.
23. Musini VM, Wright JM, Bassett K, Jauca CD. Efficacité de la baisse de la pression artérielle des diurétiques de l’anse pour l’hypertension primaire. Cochrane Database Syst Rev. 2009 ;(4):CD003825.
24. Notice d’utilisation de Microzide (capsules orales d’hydrochlorothiazide). Watson Pharma, Inc : Morristown, NJ ; 2011.
25. Notice d’emballage des comprimés oraux de chlorthalidone. Mylan Pharmaceuticals, Inc : Morgantown, WV ; 2006.
26. Bakris GL, Weir MR, Secic M, et al. Differentialeffects of calcium antagonist subclasses on markers of nephropathyprogression. Kidney Int. 2004;65:1991-2002.
27. Navaneethan SD, Nigwekar SU, Sehgal AR, et al.Aldosterone antagonists for preventing the progression of chronic kidneydisease. Clin J Am Soc Nephrol. 2009;4:542-551.
28. Mehdi UF, Adams-Huet B, Raskin P, et al.Addition ofangiotensin receptor blockade or mineralocorticoid antagonism to maximalangiotensin-converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol. 2009;20:2641-2650.
29. Médicaments contenant de l’aliskirène : communication sur la sécurité des médicaments-nouvelle mise en garde et contre-indication. MedWatch.20 avril 2012.www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm301120.htm?source=govdelivery;4/20/2012.Consulté le 1er mai 2012.
30. Trimarchi H. Rôle de l’aliskiren dans le contrôle de la pression artérielle et la rénoprotection. Int J Nephrol Renovasc Dis. 2011;4:41-48.
31. Portaluppi F, Vergnani L, Manfredini R, et al.Effet dépendant du temps de l’isradipine sur l’hypertension nocturne inchronique insuffisance rénale. Am J Hypertens. 1995;8:719-726.
32. Hermida RC, Calvo C, Ayala DE, et al. Dose andadministration-time dependent effects of nifedipine GITS on ambulatoryblood pressure in hypertensive subjects. Chronobiol Int. 2007;24:471-493.
33. Hermida RC, Ayala DE. Chronothérapie avec l’inhibiteur de l’enzyme de conversion de l’angiotensine ramipril dans l’hypertension essentielle : amélioration du contrôle de la pression artérielle avec une dose au coucher. Hypertension. 2009;54:40-46.
34. Hermida RC, Calvo C, Ayala DE, et al. Administrationtime-dependent effects of valsartan on ambulatory blood pressure inhypertensive subjects. Hypertension. 2003;42:283-290.
35. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects onblood pressure of reduced dietary sodium and the Dietary Approaches toStop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group.N Engl J Med. 2001;344:3-10.