Dénomination générique : bromure de néostigmine
Formation posologique : comprimé
Médicament revu par Drugs.com. Dernière mise à jour le 21 avril 2020.
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Grossesse
- Plus
Avis de non-responsabilité : Ce médicament n’a pas été jugé sûr et efficace par la FDA, et cet étiquetage n’a pas été approuvé par la FDA. Pour plus d’informations sur les médicaments non approuvés, cliquez ici.
Le nom de marque Prostigmin a été abandonné aux États-Unis. Si des versions génériques de ce produit ont été approuvées par la FDA, il peut y avoir des équivalents génériques disponibles.
- Prostigmin Description
- Prostigmine – Pharmacologie clinique
- Indications et utilisation de la Prostigmine
- Contra-indications
- Mises en garde
- Précautions
- Généralités:
- Interactions médicamenteuses:
- Carcinogenèse, mutagenèse et altération de la fertilité :
- Grossesse:
- Mères allaitantes :
- Utilisation pédiatrique:
- Réactions indésirables
- Surdosage
- Dosage et administration de la Prostigmine
- Comment est fourni Prostigmin
- Panneau d’affichage principal – étiquette 15 mg
- Plus d’informations sur Prostigmine (néostigmine)
- Ressources professionnelles
- Guides de traitement associés
Prostigmin Description
Prostigmin (bromure de néostigmine), un agent anticholinestérasique, est disponible pour une administration orale en comprimés de 15 mg. Chaque comprimé contient également de la gélatine, du lactose, de l’amidon de maïs, de l’acide stéarique, du sucre et du talc.
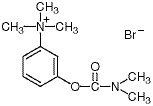
Chimiquement, le bromure de néostigmine est du bromure de (m-hydroxy-phényl)triméthylammonium diméthylcarbamate. C’est une poudre blanche, cristalline, amère, soluble 1:1 dans l’eau, avec un poids moléculaire de 303,20 et la formule structurelle suivante :
Prostigmine – Pharmacologie clinique
La néostigmine inhibe l’hydrolyse de l’acétylcholine en entrant en compétition avec l’acétylcholine pour la fixation à l’acétylcholinestérase aux sites de transmission cholinergique. Il renforce l’action cholinergique en facilitant la transmission des impulsions à travers les jonctions neuromusculaires. Elle a également un effet cholinomimétique direct sur les muscles squelettiques et éventuellement sur les cellules ganglionnaires autonomes et les neurones du système nerveux central. La néostigmine subit une hydrolyse par la cholinestérase et est également métabolisée par des enzymes microsomales dans le foie. La liaison protéique à l’albumine sérique humaine varie de 15 à 25 %.
Le bromure de néostigmine est faiblement absorbé par le tractus gastro-intestinal après administration orale. En règle générale, 15 mg de bromure de néostigmine par voie orale équivalent à 0,5 mg de méthylsulfate de néostigmine par voie parentérale, en raison de la faible absorption du comprimé par le tractus intestinal. Dans une étude menée chez des patients myasthéniques à jeun, le degré d’absorption a été estimé à 1 à 2 % de la dose orale unique de 30 mg ingérée. Les concentrations maximales dans le plasma sont survenues 1 à 2 heures après l’ingestion du médicament, avec des variations individuelles considérables. La demi-vie a varié de 42 à 60 minutes avec une demi-vie moyenne de 52 minutes.
Indications et utilisation de la Prostigmine
La Prostigmine est indiquée pour le traitement symptomatique de la myasthénie grave. Sa plus grande utilité est dans le traitement prolongé où il n’y a pas de difficulté à avaler. En cas de crise myasthénique d’actuation où la difficulté à respirer et à avaler est présente, la forme parentérale (néostigmine méthylsulfate) doit être utilisée. Le patient peut être transféré à la forme orale dès qu’elle peut être tolérée.
Contra-indications
La prostigmine est contre-indiquée chez les patients présentant une hypersensibilité connue au médicament. En raison de la présence de l’ion bromure, elle ne doit pas être utilisée chez les patients ayant des antécédents de réaction aux bromures. Il est contre-indiqué chez les patients présentant une péritonite ou une obstruction mécanique des voies intestinales ou urinaires.
Mises en garde
La prostigmine doit être utilisée avec prudence chez les patients souffrant d’épilepsie, d’asthme bronchique, de bradycardie, d’occlusion coronaire récente, de vagotonie, d’hyperthyroïdie, d’arythmie cardiaque ou d’ulcère gastroduodénal. En règle générale, 15 mg de bromure de néostigmine par voie orale équivalent à 0,5 mg de méthylsulfate de néostigmine par voie parentérale, en raison de la faible absorption du comprimé par le tractus intestinal. Des doses importantes doivent être évitées dans les situations où il pourrait y avoir une augmentation du taux d’absorption à partir du tractus intestinal. Il doit être utilisé avec prudence en cas de co-administration avec des médicaments anticholinergiques, afin d’éviter une réduction de la mobilité intestinale.
Précautions
Généralités:
Il est important de différencier la crise myasthénique de la crise cholinergique provoquée par un surdosage de Prostigmin. Ces deux affections entraînent une faiblesse musculaire extrême mais nécessitent un traitement radicalement différent. (Voir la section SURDOSAGE.)
Interactions médicamenteuses:
Certains antibiotiques, en particulier la néomycine, la streptomycine et la kanamycine, ont une action bloquante non dépolarisante légère mais certaine qui peut accentuer le bloc neuromusculaire. Ces antibiotiques ne doivent être utilisés chez le patient myasthénique que lorsqu’ils sont définitivement indiqués, et il convient alors d’ajuster soigneusement la posologie des anticholinestérasiques adjuvants.
Les anesthésiques locaux et certains anesthésiques généraux, les agents antiarythmiques et d’autres médicaments qui interfèrent avec la transmission neuromusculaire doivent être utilisés avec prudence, voire pas du tout, chez les patients atteints de myasthénie ; la dose de Prostigmin peut devoir être augmentée en conséquence.
Carcinogenèse, mutagenèse et altération de la fertilité :
Il n’y a pas eu d’études avec la Prostigmine permettant d’évaluer son potentiel cancérigène ou mutagène. Aucune étude sur l’effet de la Prostigmine sur la fertilité et la reproduction n’a été réalisée.
Grossesse:
Effets tératogènes : Catégorie de grossesse C
Il n’existe pas d’études adéquates ou bien contrôlées sur la Prostigmine, que ce soit chez les animaux de laboratoire ou chez les femmes enceintes. On ne sait pas si la Prostigmine peut causer des dommages au fœtus lorsqu’elle est administrée à une femme enceinte ou si elle peut affecter la capacité de reproduction. Prostigmin ne doit être administré à une femme enceinte que si cela est clairement nécessaire.
Effets non tératogènes :
Les anticholinestérasiques peuvent provoquer une irritabilité utérine et induire un travail prématuré lorsqu’ils sont administrés par voie intraveineuse à des femmes enceintes proches du terme.
Mères allaitantes :
On ne sait pas si Prostigmin est excrété dans le lait maternel. Comme de nombreux médicaments sont excrétés dans le lait maternel et en raison du risque d’effets indésirables graves de la Prostigmine chez les nourrissons allaités, il convient de décider de l’arrêt de l’allaitement ou de l’arrêt du médicament, en tenant compte de l’importance du médicament pour la mère.
Utilisation pédiatrique:
La sécurité et l’efficacité chez les enfants n’ont pas été établies.
Réactions indésirables
Les effets secondaires sont généralement dus à une exagération des effets pharmacologiques dont la salivation et la fasciculation sont les plus fréquents. Des crampes intestinales et des diarrhées peuvent également survenir.
Les réactions indésirables supplémentaires suivantes ont été rapportées après l’utilisation du bromure de néostigmine ou du méthylsulfate de néostigmine :
Allergique : Réactions allergiques et anaphylaxie.
Neurologique : Vertiges, convulsions, perte de conscience, somnolence, céphalées, dysarthrie, myosis et modifications visuelles.
Cardiovasculaire : Des arythmies cardiaques (incluant bradycardie, tachycardie, bloc A-V et rythme nodal) et des modifications non spécifiques de l’ECG ont été rapportées, ainsi que des arrêts cardiaques, des syncopes et des hypotensions. Ces effets ont été principalement notés après l’utilisation de la forme injectable de Prostigmin.
Respiratoire : Augmentation des sécrétions orales, pharyngées et brochiales, et dyspnée. Une dépression respiratoire, un arrêt respiratoire et un bronchospasme ont été rapportés après l’utilisation de la forme injectable de Prostigmin.
Dermatologique : Éruption cutanée et urticaire.
Gastro-intestinal : Nausées, vomissements, flatulences et augmentation du péristaltisme.
Génito-urinaire : Fréquence urinaire.
Musculo-squelettique : Crampes et spasmes musculaires, arthralgie.
Divers : Diaphorèse, bouffées vasomotrices et faiblesse.
Surdosage
Le surdosage de Prostigmine peut provoquer une crise cholinergique, qui se caractérise par une faiblesse musculaire croissante, et par l’atteinte des muscles de la respiration, peut entraîner la mort. La crise myasthénique, due à une augmentation de la sévérité de la maladie, est également accompagnée d’une faiblesse musculaire extrême et peut être difficile à distinguer de la crise cholinergique sur une base symptomatique. Cependant, cette différenciation est extrêmement importante car l’augmentation de la dose de Prostigmin ou d’autres médicaments de cette classe, en présence d’une crise cholinergique ou d’un état réfractaire ou “insensible”, pourrait avoir de graves conséquences. Les deux types de crises peuvent être différenciés par l’utilisation de Tensilon® (chlorure d’édrophonium) ainsi que par le jugement clinique.
Le traitement des deux états diffère radicalement. Alors que la présence d’une crise myasthénique nécessite un traitement anticholinestérasique plus intensif, la crise cholinergique appelle le retrait rapide de tous les médicaments de ce type. L’utilisation immédiate d’atropine dans la crise cholinergique est également recommandée.
L’atropine peut également être utilisée pour abolir ou minimiser les effets secondaires gastro-intestinaux ou d’autres réactions muscariniques ; mais une telle utilisation, en masquant les signes de surdosage, peut conduire à l’induction par inadvertance d’une crise cholinergique.
La DL50 du méthylsulfate de néostigmine chez la souris est de 0,3±0,02 mg/kg par voie intraveineuse, de 0,54±0.03 mg/kg par voie sous-cutanée, et 0,395±0,025 mg/kg par voie intramusculaire ; chez le rat, la DL50 est de 0,315±0,019 mg/kg par voie intraveineuse, 0,445±0,032 mg/kg par voie sous-cutanée, et 0,423±0,032 mg/kg par voie intramusculaire.
Dosage et administration de la Prostigmine
Le début d’action de la Prostigmine administrée par voie orale est plus lent que lorsqu’elle est administrée par voie parentérale, mais la durée d’action est plus longue et l’intensité d’action plus uniforme. La posologie nécessaire pour obtenir des résultats optimaux varie de 15 mg à 375 mg par jour. Dans certains cas, il peut être nécessaire de dépasser ces doses, mais il faut tenir compte de la possibilité d’une crise cholinergique. La dose moyenne est de 10 comprimés (150 mg) administrés sur une période de 24 heures. L’intervalle entre les doses est d’une importance capitale. Le schéma posologique doit être adapté à chaque patient et modifié en fonction des besoins. Souvent, le traitement est nécessaire jour et nuit. Des portions plus importantes de la dose quotidienne totale peuvent être administrées aux moments où le patient est plus enclin à la fatigue (après-midi, repas, etc.). Le patient doit être encouragé à tenir un registre quotidien de son état pour aider le médecin à déterminer un régime thérapeutique optimal.
Comment est fourni Prostigmin
Comprimés blancs sécables contenant 15 mg de bromure de néostigmine-bouteilles de 100 (NDC 0187-3100-10). Impression sur les comprimés : (avant) Prostigmin 15 ; (arrière) V.
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
(949) 461-6000
Rev. 02/08
Panneau d’affichage principal – étiquette 15 mg
NDC 0187-3100-10
Rx Only
Prostigmin®
(bromure de néostigmine)
15 mg
100 Comprimés
Chaque comprimé contient 15 mg de bromure de néostigmine
VALEANT™

| Prostigmin comprimé de bromure de néostigmine |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Étiqueteur – Valeant Pharmaceuticals North America LLC (042230623)
Plus d’informations sur Prostigmine (néostigmine)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations sur la posologie
- Interactions médicamenteuses
- Classe de médicaments : Stimulants musculaires cholinergiques
Ressources professionnelles
- Informations posologiques
- Méthylsulfate de néostigmine injectable (FDA)
.
Autres marques Bloxiverz
Guides de traitement associés
- Myasthénie grave
- Rétention urinaire
Avis médical
.