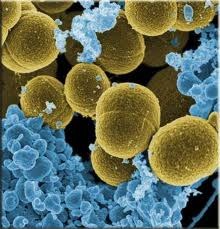
Classification
Taxons d’ordre supérieur :
Bactéries ; Firmicutes ; Bacilles ; Lactobacillales ; Streptococcaceae;
Espèce
Streptococcus oralis
Description et importance
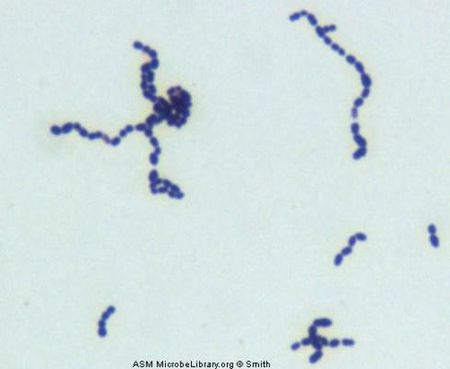
Streptococcus oralis est une bactérie commensale qui appartient au groupe Mitis, qui contient le principal agent pathogène humain S. pneumoniae, et se trouve dans la cavité buccale humaine (2). S. oralis est un composant du microbiote oral humain normal, et est capable de pathogénicité opportuniste. Comme d’autres streptocoques oraux apparentés, il présente une variation phénotypique et génétique considérable. (3) S. oralis est une bactérie Gram positif, non mobile, α-hémolytique qui forme des chaînes de cocci. Les conditions optimales pour la survie de S. oralis sont des températures comprises entre 30 et 35 degrés Celsius. (3, 5)
Structure du génome
Le génome de S. oralis consiste en un chromosome circulaire et a une longueur de 1 958 690 pb, ce qui le rend plus petit que les génomes de S. mitits B6 et S. pneumoniae. (2) Le contenu G+C de S. oralis est de 41,14 % et son pourcentage de codage est de 89,7. Il y a environ 1 909 séquences prédites codant pour des protéines, avec une longueur moyenne de codage de 921 pb, 61 ARNt, 4 loci d’ARNr et 9 gènes codant pour des ARN. (2) S. oralis est le plus étroitement apparenté à S. mitis et S. pneumoniae. Ils partagent plus de 99 % d’identité de séquence du gène de l’ARNr 16S, même si la similarité ADN-ADN pour l’ensemble du chromosome est estimée à moins de 60 %.(4) Comme le génome B6 de S. mitis, le génome de S. oralis présente un alignement en X frappant par rapport à “S. pneumoniae”. (2) Les principaux facteurs de pathogénicité du pneumocoque sont absents chez S. oralis, ce qui est similaire au génome de S. mitis B6. Le génome de S. oralis contient des îlots génétiques et des déterminants de la résistance aux antibiotiques qui sont représentatifs du génome de S. pneumoniae et d’autres espèces streptococciques. (2)
Structure cellulaire et métabolisme
Streptococcus oralis est un anaérobe facultatif gram positif et non mobile. S. oralis forme des colonies de grappes blanches sur une plaque de gélose de Wilkins-Chalgren. (9)
Puisque S. oralis est un anaérobie facultatif, il a étendu ses capacités métaboliques. Cela le rend capable de se développer dans des environnements plus défavorables et lui permet d’utiliser une plus grande gamme de nutriments. La dégradation des glycoprotéines est la principale source d’énergie de l’organisme. (9) Certaines souches de S. oralis peuvent produire une protéase IgA ainsi que de la neuraminidase, ce qui les rend incapables de fixer l’α-amylase. (3)
Pathologie
Auparavant considéré comme un pathogène opportuniste mineur, S. oralis est maintenant considéré comme un pathogène important qui affecte les personnes immunodéprimées et celles atteintes de malignité hématologique (cancers qui affectent le sang). (1,4) Chez ces personnes, S. oralis est connu pour créer des complications telles que l’endocardite bactérienne, le syndrome de détresse respiratoire de l’adulte et le choc streptococcique. Les pénicillines étaient autrefois un traitement standard pour les infections causées par S. oralis, mais l’émergence de la résistance antimicrobienne les a rendues moins efficaces. (1) Il présente des résultats de sensibilité aux antibiotiques qui sont très proches des résultats des autres organismes membres du groupe Mitis. S. oralis est apparenté à S. pneumoniae un cas courant d’otite moyenne, de septicémie, de pneumonie et de méningite chez les enfants qui entraîne un taux de mortalité important dans le monde entier. (4)
S. oralis est connu pour être l’une des premières bactéries à commencer à former le biofilm de la plaque dentaire. La recherche montre que le S.oralis est capable d’interagir avec Porphyromonas gingivalis, qui est considéré comme l’une des principales causes de la maladie parodontale. La maladie parodontale est considérée comme la maladie la plus courante affectant la cavité buccale humaine. (8)
Faits intéressants
S. oralis n’a été signalé comme causant une méningite que dans des cas où des travaux dentaires ont été récemment effectués. Cependant, en 2013, une femme de 81 ans, qui n’avait pas effectué de travaux dentaires récents, a été trouvée atteinte d’une méningite bactérienne après une intervention chirurgicale. La femme a été admise pour une chirurgie élective de remplacement total du genou, et avant l’opération, elle a reçu une anesthésie spinale. Au début de la surveillance postopératoire, la patiente a présenté des maux de tête et des nausées ; après plusieurs autres symptômes, on lui a fait une ponction lombaire et on a diagnostiqué une méningite bactérienne. Une culture du liquide céphalo-rachidien a révélé la présence de staphylocoques à Gram positif. Lors de tests supplémentaires, la bactérie s’est avérée être S. oralis, ce qui en fait le premier cas de S. oralis provoquant une méningite bactérienne à la suite d’une anesthésie rachidienne. (7)
S. oralis voit également son utilisation comme probiotique pour aider à soutenir une cavité buccale saine. La souche utilisée comme probiotique est modifiée, et elle contribue à aider à restaurer la bouche avec de bonnes bactéries et à éloigner les bactéries qui dégénèrent la santé buccale. Pour ce faire, S. oralis colonise les sites autour des dents, comme les gencives, et entre en compétition avec d’autres bactéries. (10)
1.Byers, H.L., E. Tarelli , K. A. Homer , et D. Beighton . “Isolation et caractérisation de la sialidase d’une souche de Streptococcus oralis .” Unité conjointe de recherche microbienne . 49. (2000) : 235-244. Web. 16 déc. 2013.
2.Reichmann , Peter, Michael Nuhn, et al. “Génome de Streptococcus oralis souche Uo5”. Journal of Microbiology . 193.11 (2011) : 2888-2889. Web. 16 déc. 2013.
3.Do, Thuy, Keith A. Jolley, et al. “Structure de la population de Streptococcus oralis .” Société de microbiologie générale . 155.8 (2009) : 2593-2602. Web. 16 déc. 2013.
4.Whalan , Rachel H. , Simon G. P. Funnell , et al. “Distribution et diversité génétique des lipoprotéines transporteurs ABC PiuA et PiaA au sein de Streptococcus pneumoniae et des streptocoques apparentés .” Journal of Microbiology . 188.3 (2006) : 1031-1038. Web. 16 déc. 2013.
5.LeVan, Adriana , et Deena Jacob. Coloration de Gram : Cocci à Gram positif . 2011. Photographie. Société américaine de microbiologie, College Park MD. Web. 16 déc. 2013.
6.Wilder , Jennifer, Michelle Ramanathan , et al. “Méningite à Streptococcus oralis après une anesthésie spinale .” Association des anesthésistes de Grande-Bretagne et d’Irlande . 0092. (2013) : n. page. Web. 16 déc. 2013.
7.Streptococcus oralis Uo5. 2011. Photographie. Bacmap Genome Atlas , Bethesday MD. Web. 16 déc. 2013. <http://bacmap.wishartlab.com/organisms/1303
8.Maeda, K. , H. Nagata, M. Kuboniwa, et al. “Identification et caractérisation des protéines clientes de Porphyromonas gingivalis qui se lient à la Glyceraldehyde-3-Phosphate Dehydrogenase de Streptococcus oralis.” Infection et immunité . 81.3 (2013) : 753-763. Web. 16 déc. 2013.
9.Tilley , DO, M Arman , A Smolenski, et al. “La glycoprotéine Ibα et le FcγRIIa jouent des rôles clés dans l’activation des plaquettes par la bactérie colonisatrice, Streptococcus oralis.” Journal of Thrombosis and Haemostasis . 11.5 (2013) : 941-950. Web. 16 déc. 2013.
10. “Comment les probiotiques oraux EvoraPro aident à la santé bucco-dentaire .” Evroa Oral Probiotics . N.p., n. d. Web. 16 déc. 2013.
Author
Page écrite par Allison Wall et Stephen Taylor, étudiants du Dr Angela Hahn. Université d’État de Bemidji, Bemidji, MN.