La sublimation est le processus par lequel une matière passe d’un solide gelé à un gaz sans passer par l’état liquide intermédiaire.
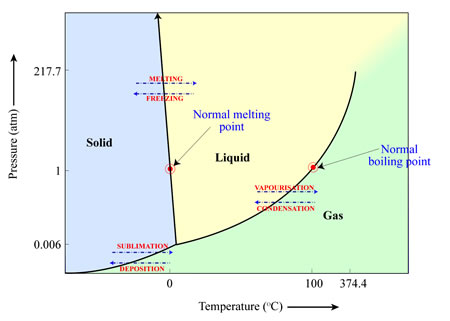
La sublimation (du solide au gaz), la fusion (du solide au liquide) ou la vaporisation (du liquide au gaz) d’une matière dépend de la température et de la pression de l’environnement dans lequel elle se trouve. Cela peut être illustré par un “diagramme de phase” tel que celui de l’eau ci-dessous. Dans ce cas, et avec les pressions (1 atmosphère) et les températures (25 degrés Celsius) auxquelles nous sommes habitués sur Terre, la glace d’eau fondra pour former de l’eau liquide, qui se vaporisera ensuite pour former de la vapeur d’eau. Cependant, si les pressions sont suffisamment basses (par exemple, les pressions que nous trouvons ailleurs dans le système solaire), la glace d’eau se transformera directement en vapeur d’eau au fur et à mesure que la température augmente, contournant ainsi le stade de l’eau liquide.
La sublimation se produit à de nombreux endroits dans le système solaire. Deux exemples sont :
- La sublimation de l’eau des noyaux cométaires lorsque la comète s’approche du Soleil’
- La sublimation des calottes polaires sur Mars pendant l’été martien.
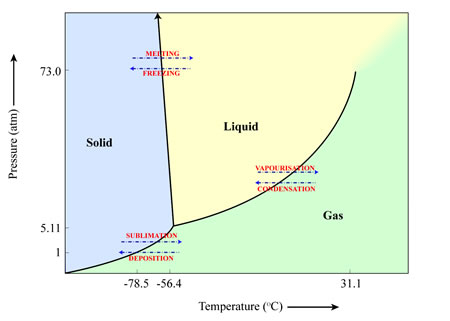
Un exemple de matériau qui se sublime ici sur Terre est le dioxyde de carbone (CO2) congelé – plus communément appelé “glace sèche”. Lorsqu’il est exposé à l’air à température ambiante à des pressions de 1 atmosphère, le CO2 congelé se transforme directement en CO2 gazeux.
.