Abstract
Le diagnostic d’une masse du cou peut présenter un défi. Chez l’adulte, le diagnostic le plus fréquent est la malignité, et les tumeurs primaires et métastatiques doivent être envisagées. D’autres options fréquentes sont les processus infectieux. Nous présentons le cas d’une patiente de 88 ans présentant une masse sous-mandibulaire avec des signes inflammatoires, ne répondant pas à une antibiothérapie, et dont la biopsie par aspiration à l’aiguille fine a révélé une lésion inflammatoire. La masse s’est développée pendant un mois avec une anorexie associée, ce qui a entraîné l’admission pour un diagnostic avec une biopsie ouverte. Après l’admission, un carcinome invasif du sein droit a été diagnostiqué, et la culture mycobactérienne de la biopsie de la masse submandibulaire était positive pour Mycobacterium tuberculosis. L’immunosénescence les personnes âgées contribue à la vulnérabilité aux cancers mais aussi aux infections qui peuvent se présenter de manière atypique et ainsi entraîner un retard de diagnostic.
Introduction
Le diagnostic différentiel des masses du cou est extrêmement difficile, car plusieurs facteurs doivent être pris en compte. La principale option diagnostique chez les adultes est la malignité, qu’elle soit primaire, métastatique à partir de tumeurs des voies respiratoires supérieures ou du tube digestif, ou le lymphome . Des néoplasmes bénins tels que des lipomes, des fibromes et des hémangiomes peuvent également être trouvés.
Seventy-five percent of the neck masses in patients over 40 years of age are malignant , and the risk increases with age . La taille de la lésion et la durée des symptômes sont d’autres prédicteurs importants du risque de malignité , ainsi que l’exposition chronique au soleil, le tabagisme, la consommation d’alcool, une mauvaise dentition, les expositions environnementales et les antécédents familiaux .
Les caractéristiques physiques de la masse sont également importantes pour le diagnostic différentiel. Des masses solides, dures ou fixes, avec des limites irrégulières sont suggestives de malignités solides ; des masses multiples molles et caoutchouteuses suggèrent un lymphome ; des masses avec des signes inflammatoires suggèrent des causes infectieuses .
Les masses inflammatoires peuvent résulter de l’inflammation des ganglions lymphatiques (adénite cervicale), qui sont généralement autolimitées et se résolvent spontanément . Une inflammation chronique des glandes submandibulaires ou parotides avec une sialadénite chronique est également possible .
Les causes infectieuses peuvent être de nature virale, bactérienne ou fongique . Les infections virales telles que le cytomégalovirus (CMV), l’Epstein-Barrvirus (EBV), la rougeole, l’adénovirus, l’échovirus, le rhinovirus et le virus respiratoire syncitial (RSV) se présentent généralement avec des ganglions lymphatiques multiples avec adénite cervicale. Les infections bactériennes peuvent provoquer une nécrose, avec formation d’abcès, drainage spontané et même formation de fistules chroniques. D’autres agents doivent également être envisagés à savoir les mycobactéries , la maladie des griffes du chat par Bartonella , l’actinomycose , Toxoplasma gondii .
D’autres causes moins fréquentes sont la goutte , le pseudo-tumeur inflammatoire , la maladie de Kimura , la maladie de Castleman et la sarcoïdose .
Le diagnostic est généralement fait par cytologie par aspiration à l’aiguille fine, qui est une méthode rapide et sensible . Si le diagnostic n’est pas clair, une biopsie ouverte peut être nécessaire. Les tests de laboratoire varient en fonction de la présentation, mais doivent inclure les paramètres inflammatoires, notamment la numération leucocytaire, la vitesse de sédimentation des érythrocytes (VS), la protéine C-réactive (CRP), la sérologie virale et bactérienne en fonction de l’histoire et de l’examen cliniques et le test cutané à la tuberculine . La caractérisation de la masse peut se faire à l’aide d’une échographie qui permet de différencier les lésions kystiques, les tumeurs des glandes salivaires, les ganglions lymphatiques réactifs ou malins à l’aide de critères tels que la taille et la vascularisation . La tomodensitométrie (CT) et l’imagerie par résonance magnétique (IRM) permettent également de caractériser les masses en fonction de leur taille et de leurs anomalies morphologiques (nécrose centrale, amas graisseux et hétérogénéité). La tomographie par émission de positrons peut être utilisée pour étudier les masses du cou car elle détecte une augmentation du métabolisme, mais elle n’est pas recommandée en tant que test autonome car elle ne permet pas de distinguer les lésions inflammatoires des lésions néoplasiques. Si une malignité est suspectée, d’autres études doivent être réalisées, y compris un scanner du corps entier et des études endoscopiques des voies respiratoires supérieures et du tube digestif .
Rapport de cas
Nous présentons le cas d’une femme fragile de 88 ans vivant dans une maison de retraite, qui s’est présentée aux urgences en raison d’une évolution progressive de 3 à 4 semaines de prostration, d’anorexie et d’une masse submandibulaire droite avec des signes inflammatoires. Elle était suivie par le service de chirurgie maxillo-faciale, qui avait effectué une cytologie par aspiration à l’aiguille fine de la masse, laquelle a révélé des cellules inflammatoires, négatives pour les cellules néoplasiques. De plus, elle avait déjà été médicamentée avec de l’amoxicilline-acide clavulanique par voie orale (875 mg/125 mg 3id pendant 7 jours) sans amélioration.
Ses antécédents médicaux comprenaient une hypertension essentielle, une bradycardie sinusale, une artériopathie périphérique, des troubles cognitifs légers et une dépression. Elle était polymédicamentée avec de l’aspirine, de l’olmésartan, de la pentoxifylline, de la paroxétine et de l’alprazolam.
À l’examen, elle était obèse, présentait une masse sous-mandibulaire non sensible de 3 × 3 cm, solide mais caoutchouteuse, avec des signes inflammatoires, sans exsudat (figure 1). Elle restait afébrile sans autre signe clinique pertinent.
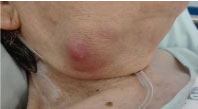 Figure 1 : Photo de la masse submandibulaire droite. View Figure 1
Figure 1 : Photo de la masse submandibulaire droite. View Figure 1
Considérant la progression de la maladie, le patient a été admis pour des examens supplémentaires, y compris une biopsie ouverte de la masse, et a été mis sous traitement empirique avec de l’amoxicilline-acide clavulanique par voie intraveineuse (1000 mg/200 mg pendant 9 jours supplémentaires) et de la clindamycine (600 mg 4id pendant 7 jours), également sans amélioration clinique.
Les analyses sanguines n’ont montré qu’une anémie hypochrome microcytaire avec carence en fer et des paramètres inflammatoires négatifs (tableau 1).
Tableau 1 : bilan sanguin du patient.Voir tableau 1
Une tomodensitométrie (TDM) corps entier a révélé de multiples ganglions cervicaux nécrotiques, les plus gros dans les fosses supraclaviculaires gauches et un nodule dans la glande mammaire droite, irrégulier avec un signe hyperatténuant évocateur de vascularisation (figure 2 et figure 3).
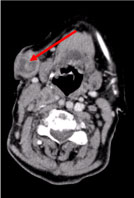 Figure 2 : TDM du cou : Multiples ganglions cervicaux nécrosés, le plus gros sous-cutané, de 27 mm de diamètre (flèche). Voir Figure 2
Figure 2 : TDM du cou : Multiples ganglions cervicaux nécrosés, le plus gros sous-cutané, de 27 mm de diamètre (flèche). Voir Figure 2
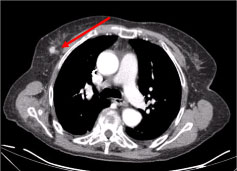 Figure 3 : TDM thoracique : Lésion de 10 mm sur la glande mammaire droite, nodulaire irrégulière, avec un signe d’hyperatténuation évocateur de vascularisation (flèche). View Figure 3
Figure 3 : TDM thoracique : Lésion de 10 mm sur la glande mammaire droite, nodulaire irrégulière, avec un signe d’hyperatténuation évocateur de vascularisation (flèche). View Figure 3
Une biopsie ouverte a été réalisée, qui a montré une infiltration des tissus mous par des leucocytes nucléaires polymorphes et des histiocytes et une vascularisation. Les colorations de Gram, Grocott, Ziehl-Neelsen et PAS étaient négatives ; le test basé sur la réaction en chaîne par polymérase (PCR) pour la détection de Mycobacterium tuberculosis dans les tissus était également négatif.
La patiente est sortie de l’hôpital avec un suivi ultérieur dans les cliniques de chirurgie mammaire et de chirurgie maxillo-faciale.
A la clinique de chirurgie mammaire, une biopsie par carottage échoguidée de la lésion mammaire a été réalisée. Un carcinome mammaire invasif NOS, grade 1 a été diagnostiqué. La tumeur était ER-positive (90 %), PR-positive (90 %), HER2 2+ par immunohistochimie, ISH négatif, avec un indice de prolifération (Ki67) de 10 % (sous-type moléculaire luminal A) (Figure 4). Elle a été stadifiée cT1N0M0. A ce moment, la patiente a été mise sous tamoxifène.
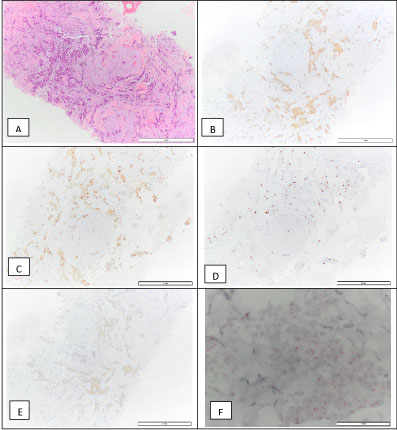 Figure 4 : biopsie de carcinome invasif du sein : H&E (A), positif pour le récepteur des œstrogènes – 90% (B), positif pour le récepteur de la progestérone – 90% (C), Ki67 – 10% (D), HER2 2+ (E), et une amplification HER2 D-ISH négative (F), ce qui est compatible avec un sous-type moléculaire luminal A. View Figure 4
Figure 4 : biopsie de carcinome invasif du sein : H&E (A), positif pour le récepteur des œstrogènes – 90% (B), positif pour le récepteur de la progestérone – 90% (C), Ki67 – 10% (D), HER2 2+ (E), et une amplification HER2 D-ISH négative (F), ce qui est compatible avec un sous-type moléculaire luminal A. View Figure 4
Deux mois plus tard, la culture mycobactérienne de la biopsie ouverte était positive pour Mycobacterium tuberculosis complex, sensible à tous les antibiotiques de première ligne. Le patient a initié un traitement avec des agents antituberculeux de première ligne (300 mg d’isoniazide, 600 mg de rifampicine, 1500 mg de pyrazinamide et 1200 mg d’éthambutol pendant 2 mois, suivi de 4 mois de 300 mg d’isoniazide et 600 mg de rifampicine) et a été référé à la clinique de la tuberculose pour un suivi.
Le patient est décédé 1 an après le diagnostic initial.
Discussion
Comme discuté précédemment, le diagnostic d’une masse cervicale est affecté par plusieurs facteurs. L’âge et la fragilité sont des facteurs majeurs à considérer.
Le vieillissement est associé à une diminution de la réponse immunitaire, souvent décrite comme l’Immunosénescence . Il affecte à la fois les systèmes adaptatif et inné, de manière différente . La fonction du système immunitaire adaptatif est souvent réduite, généralement par une diminution de l’activité des lymphocytes T . D’autre part, le système immunitaire inné a été décrit comme étant excessif en raison d’un manque de pouvoir de régulation, ce qui peut entraîner un état apro-inflammatoire, qui est également préjudiciable. L’immunosénescence a été associée à une augmentation de la fréquence et de la gravité des infections, à une moindre surveillance immunitaire des cellules malignes et à une moindre efficacité de la vaccination.
L’immunosénescence contribue donc à l’augmentation des diagnostics de cancer chez les personnes âgées, avec un âge médian de 70 ans au moment du diagnostic. D’autres facteurs jouent un rôle, comme l’augmentation du temps d’exposition à la carcinogenèse ou la plus grande sensibilité des cellules âgées à la carcinogenèse, mais aussi l’augmentation de la réponse inflammatoire paradoxale.
Les infections sont plus fréquentes chez les personnes âgées, en particulier les infections des voies respiratoires, avec une grande mortalité associée. La tuberculose est un problème de santé publique important qui touche 9,6 millions de personnes dans le monde et qui a augmenté dans la population âgée de plus de 65 ans. Il a été suggéré que la tuberculose chez les personnes âgées résulte souvent de la réactivation d’une tuberculose latente, lorsque la réponse immunitaire cellulaire s’affaiblit. Cependant, elle peut également résulter d’une primo-infection ou d’une réinfection chez un patient précédemment traité. D’autres facteurs augmentent le risque de tuberculose chez les personnes âgées, comme le fait de résider dans une maison de retraite, qui multiplie le risque par 2 ou 3 . Certaines comorbidités, comme le diabète sucré, la bronchopneumopathie chronique obstructive, les maladies hépatiques, les tumeurs malignes et les maladies cardiovasculaires ; les traitements immunosuppresseurs avec des corticoïdes et des anti TNF ; et la malnutrition .
La tuberculose chez les personnes âgées a une présentation clinique atypique . La présentation principale est toujours pulmonaire dans 75% des cas , mais les sites extrapulmonaires sont plus fréquents . Les symptômes spécifiques aux organes sont moins fréquents, et les patients présentent des symptômes plus vagues, tels que l’asthénie et les troubles cognitifs. Le diagnostic est également plus difficile car les personnes âgées présentent fréquemment des anomalies chroniques, telles que des enzymes hépatiques anormales, une hypoalbuminémie, une hyponatrémie, une hypokaliémie et une anémie. Radiographiquement, il y a moins de changements chroniques. Le test cutané à la tuberculine est souvent indéterminé en raison de l’anergie, et il est nécessaire de le répéter en profitant de l’effet de rappel. Les cultures de spécimens peuvent être négatives. Le traitement est également un défi chez les personnes âgées, en raison d’une moins bonne observance et d’une polypharmacie avec un risque accru de toxicité, en particulier d’hépatotoxicité . La mortalité est également significativement plus élevée ; jusqu’à 10 fois .
Ce rapport de cas illustre les défis du diagnostic d’une masse du cou chez les personnes âgées. Les signes inflammatoires locaux évoquaient une infection, mais les symptômes systémiques faisaient suspecter une malignité. Rétrospectivement, nous pouvons affirmer que plusieurs signes et tests de laboratoire pouvaient suggérer une tuberculose, comme les signes inflammatoires, la résistance aux antibiotiques, l’anémie et l’hyponatrémie. Le diagnostic simultané de carcinome mammaire invasif était une découverte fortuite. Cependant, il est raisonnable de supposer que le cancer peut avoir contribué à l’immunosénescence, facilitant la réactivation de la tuberculose latente.
Soutien financier
Il n’y a pas eu de soutien financier.
Contribution des auteurs
Tous les auteurs ont contribué de manière égale.
- Gleeson M, Herbert A, Richards A (2000) Gestion des masses latérales du cou chez les adultes. BMJ 320 : 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66 : 831-838.
- Armstrong WB, Giglio MF (1998) Cette bosse dans le cou a-t-elle quelque chose à craindre ? Postgrad Med 104.
- Bhattacharyya N (1999) Facteurs prédictifs de néoplasie et de malignité dans une masse du cou. Arch Otolaryngol Head Neck Surg 125 : 303-307.Bhattacharyya N (1999) Facteurs prédictifs de néoplasie et de malignité dans une masse du cou. Arch Otolaryngol Head Neck Surg 125 : 303-307.
- Barnes L (1996) Pathologie de la tête et du cou : Considérations générales. (3rd edn), In : Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1 : 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana, et B. bacilliformis : pathogènes historiques d’importance émergente. Microbes Infect 2 : 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Spectre clinique dans 107 cas de lymphadénopathie toxoplasmique. Rev Infect Dis 9 : 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33 : 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Pseudotumeur inflammatoire de l’espace parapharyngé : rapport de cas et revue de la littérature. Head Neck 14 : 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimura’s disease : two case reports and a literature review. Ann Otol Rhinol Laryngol 107 : 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castleman’s disease) : a report of five cases. Otolaryngol Head Neck Surg 113 : 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologic manifestations of sarcoidosis : presentation and diagnosis. Laryngoscope 107 : 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8 : 91-97.
- Ponnappan S, Ponnappan U (2011) Vieillissement et fonction immunitaire : des mécanismes moléculaires aux interventions. Antioxid Redox Signal 14 : 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Immunosenescence of ageing. J Catholic 211 : 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) Le système immunitaire vieillissant et sa relation avec le cancer. Aging health 7 : 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Effets du vieillissement sur les leucocytes humains (partie I) : immunophénotypage des cellules immunitaires innées. Age (Dordr) 37 : 92.
- Mcelhaney JE, Effros RB (2009) Immunosénescence : que signifie-t-elle pour les résultats de santé chez les personnes âgées ? Curr Opin Immunol 21 : 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) La survie et l’incidence du cancer à partir du programme Surveillance, Epidemiology, and End Results (SEER). Oncologist 8 : 541-552.
- Finkel T, Serrano M, Blasco MA (2007) The common biology of cancer and ageing. Nature 448 : 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, vieillissement et cancer. Mech Ageing Dev 130 : 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2 : 801-810.
- Bellmann-Weiler R, Weiss G (2009) Pitfalls in the diagnosis and therapy of infections in elderly patients–a mini-review. Gerontology 55 : 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) Le cadre stratégique de la lutte et de la prévention de la tuberculose chez les personnes âgées : un examen de la portée vers les objectifs de End TB. Infect Dis Poverty 6 : 70.
- Byng-Maddick R, Noursadeghi M (2016) La tuberculose menace-t-elle nos populations vieillissantes ? BMC Infect Dis 16 : 119.
- Negin J, Abimbola S, Marais BJ (2015) La tuberculose chez les personnes âgées – il est temps de s’en rendre compte. Int J Infect Dis 32 : 135-137.
- Rajagopalan S (2001) Tuberculose et vieillissement : un problème de santé mondial. Clin Infect Dis 33 : 1034-1039.
- Rajagopalan S (2016) La tuberculose chez les personnes âgées. Clin Geriatr Med 32 : 479-491.
- Chan E (2006) La tuberculose chez les personnes âgées : Maintenir un indice de suspicion élevé. Journal of Respiratory Diseases 27 : 307-315.
- Jeon CY, Murray MB (2008) Le diabète sucré augmente le risque de tuberculose active : une revue systématique de 13 études observationnelles. PLoS Med 5 : e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, et al. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5 : e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, et al. (2015) Risque accru d’infections mycobactériennes associé aux médicaments antirhumatismaux. Thorax 70 : 677-682.
- Morris CD (1990) Pulmonary tuberculosis in the elderly : a different disease ? Thorax 45 : 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) Does aging modify pulmonary tuberculosis ? A meta-analytical review. Chest 116 : 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77 : 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberculosis in the geriatric patient. J Am Geriatr Soc 31 : 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Caractéristiques cliniques et résultats du traitement de la tuberculose chez les personnes âgées : une étude cas-témoin. BMC Infect Dis 13 : 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119 : 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Mortalité parmi les patients atteints de tuberculose aux Pays-Bas au cours de la période 1993-1995. Eur Respir J 11 : 816-820.
Citation
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) Une masse submandibulaire chez un patient âgé. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064
.