Nyomás, térfogat és hőmérséklet összefüggései valós gázokban
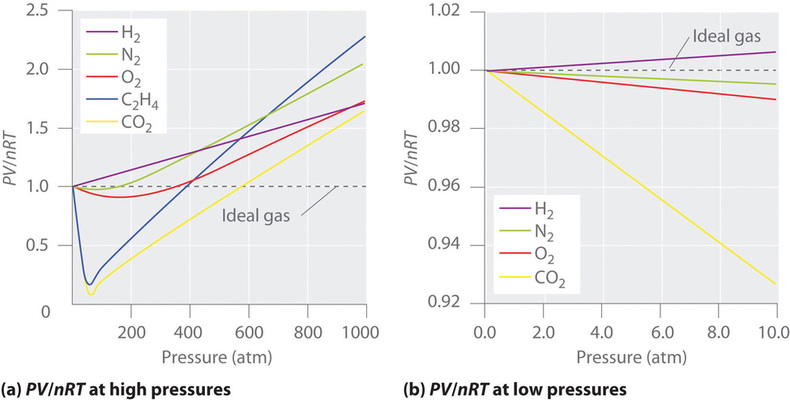
Egy ideális gáz esetében az \(PV/nRT\) és az \(P\) függvényének ábrázolása vízszintes egyenest ad, amelynek metszéspontja 1 az \(PV/nRT\) tengelyen. A valós gázok azonban jelentős eltéréseket mutatnak az ideális gázoktól elvárt viselkedéstől, különösen nagy nyomáson (\(\(\PageIndex{1a}\) ábra). Csak viszonylag alacsony nyomáson (1 atm alatt) közelítik meg a valós gázok az ideális gáz viselkedését (\(\PageIndex{1b}\) ábra).
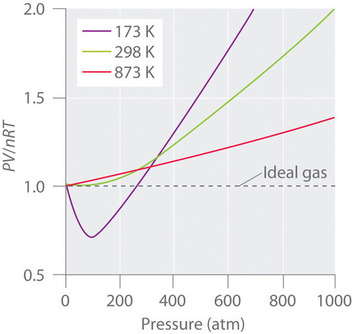
A valós gázok magasabb hőmérsékleten is jobban megközelítik az ideális gáz viselkedését, amint azt a \(\(\PageIndex{2}\) ábra \(N_2\) esetében mutatja. Miért viselkednek a valódi gázok magas nyomáson és alacsony hőmérsékleten ennyire eltérően az ideális gázoktól? Ilyen körülmények között az ideális gáztörvény két alapfeltevése – nevezetesen, hogy a gázmolekulák térfogata elhanyagolható, és hogy a molekulák közötti kölcsönhatások elhanyagolhatóak – már nem érvényes.
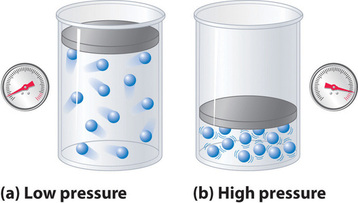
Mivel az ideális gáz molekuláiról feltételezzük, hogy térfogata nulla, a mozgásukhoz rendelkezésre álló térfogat mindig megegyezik a tartály térfogatával. Ezzel szemben egy valódi gáz molekulái kis, de mérhető térfogattal rendelkeznek. Kis nyomáson a gázmolekulák viszonylag távol vannak egymástól, de ahogy a gáz nyomása növekszik, a molekulák közötti távolságok egyre kisebbek lesznek (\(\(\PageIndex{3}\) ábra). Ennek eredményeképpen a molekulák által elfoglalt térfogat jelentős lesz a tartály térfogatához képest. Következésképpen a gáz által elfoglalt teljes térfogat nagyobb, mint az ideális gáztörvény által megjósolt térfogat. Így nagyon nagy nyomáson a PV/nRT kísérletileg mért értéke nagyobb, mint az ideális gáztörvény által megjósolt érték.
Mellett minden molekulát erők kombinációja vonz egymáshoz. Ezek az erők különösen fontossá válnak a gázok esetében alacsony hőmérsékleten és nagy nyomáson, ahol a molekulák közötti távolságok rövidebbek. A molekulák közötti vonzások csökkentik a tartály falával való ütközések számát, és ez a hatás a vonzó kölcsönhatások számának növekedésével egyre hangsúlyosabbá válik. Mivel a molekulák közötti átlagos távolság csökken, a gáz által a tartály falára gyakorolt nyomás csökken, és a megfigyelt nyomás kisebb a vártnál (\(\(\PageIndex{4}\) ábra). Így, ahogy az \(\PageIndex{2}\) ábrán látható, alacsony hőmérsékleten az \(PV/nRT\) arány kisebb, mint az ideális gázra előre jelzett, ez a hatás különösen az összetett gázok és az egyszerű gázok esetében válik nyilvánvalóvá alacsony hőmérsékleten. Nagyon magas nyomáson a nem nulla molekulatérfogat hatása dominál. E hatások közötti verseny felelős az \(PV/nRT\) és az \(P\) diagramon sok gáz esetében megfigyelhető minimumért.
A nem nulla molekulatérfogat miatt a tényleges térfogat nagy nyomáson nagyobb, mint az előrejelzett; a molekulák közötti vonzóerők miatt a nyomás kisebb, mint az előrejelzett.
Magas hőmérsékleten a molekuláknak elegendő mozgási energiájuk van a molekulák közötti vonzóerők legyőzéséhez, és a nem nulla molekulatérfogat hatásai dominálnak. Ezzel szemben a hőmérséklet csökkenésével a gázmolekulák kinetikus energiája csökken. Végül elérjük azt a pontot, amikor a molekulák már nem tudják legyőzni a molekulák közötti vonzóerőket, és a gáz cseppfolyósodik (folyadékká sűrűsödik).