Mi az a poláris kovalens kötés?
A kovalens kötés akkor jön létre, amikor két atom elektronokat oszt meg egymás között. A kovalens kötés valószínűleg poláros, ha az elektronok egyenlőtlenül oszlanak meg. A ferdeség a két atom elektronegativitásának különbsége miatt keletkezik. Az elektronegativitás egy atom kötő elektronpár vonzására való hajlamának mértékegysége. Ezt a Pauling-skála néven ismert skálával mérik, és 0,7-től 4-ig terjed. Az alábbi táblázat az elektronegativitás-különbség miatt kialakuló kémiai kötés típusát mutatja be.
| Kémiai kötés típusa | Elektronegativitáskülönbség |
|---|---|
| Nem poláros kovalens | 0 |
| Kissé poláros kovalens | 0 .1-0,4 |
| Poláris kovalens | 0,5-2 |
| Ionikus | > 2 |
Minél jelentősebb az elektronegativitásbeli különbség, annál nagyobb a polaritás és a kötés erőssége. A poláros kovalens kötések tehát köztes kötéserősségűek.
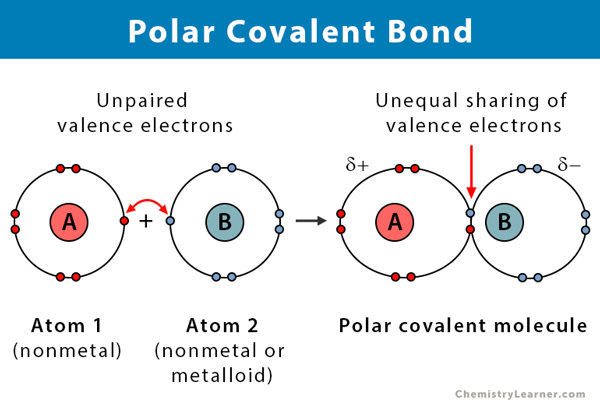
A poláros kovalens kötések tulajdonságai
Íme néhány tény a poláros kovalens kötésekről.
- Két nemfém között vagy egy nemfém és egy metalloid között jön létre
- Egy vegyületben az elektronok egyenlőtlen megosztása
- Az atomok közötti elektronegativitás különbség 0 között van.1 és 2
- A kötés egyik vége pozitívan, a másik vége negatívan töltött
- Poláris vegyületek poláris oldószerben oldódnak
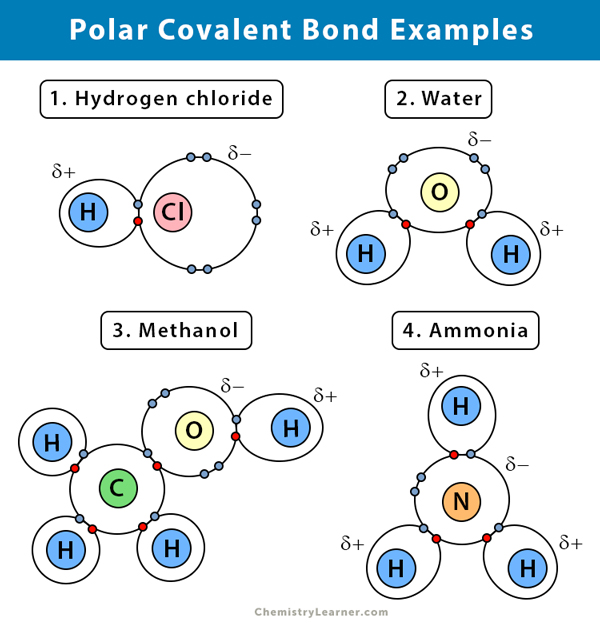
Példák poláris kovalens kötésekre
Itt van néhány példa poláris kovalens kötésre a két kötő atom közötti elektronegativitás különbséggel :
| Vegyület neve | Molekuláris képlet | Kötés | Elektronegativitás különbség |
|---|---|---|---|
|
Víz |
H2O |
O-H |
|
| Hidrogén-fluorid | HF | H-F | 1.9 |
| Hidrogén-klorid | HCl |
H-Cl |
0.9 |
|
Hidrogén-bromid |
HBr |
H-Br |
|
|
Ammónia |
NH3 |
N-H |
|
|
Kén-dioxid |
SO2 | S=O | 1 |
| Szulfhidrogén | H2S | H-S | 0.4 |
| Metanol | CH3OH | O-H | 1,4 |
Az alábbiakban néhány vegyület poláris kovalens kötésének magyarázatát adjuk meg.
Víz (H2O)
A víz poláris oldószer. A poláros kovalens kötés akkor jön létre, amikor az oxigén (O) atom, mivel elektronegatívabb, mint a hidrogén, a megosztott elektronokat maga felé húzza. Ennek eredményeként az oxigénatomhoz részleges negatív töltés kapcsolódik. A hidrogének (H) viszont lényegében protonok, és részleges pozitív töltés kapcsolódik hozzájuk.
Hidrogén-klorid (HCl)
A hidrogén-klorid poláros kovalens vegyület, mivel a klóratom (Cl) elektronegatívabb, mint a hidrogén (H) atom. Tehát a klór részben negatív, míg a hidrogén részben pozitív töltést hordoz.
Ammónia (NH3)
Ammónia poláris molekula. A központi atom, a nitrogén (N) három hidrogén (H) atomhoz kapcsolódik. Mivel az N elektronegatívabb, mint a H, az elektronok hajlamosak az N atom körül lógni.
Hidrogén-bromid (HBr)
A hidrogén (H) és a bróm (Br) elektronegativitása közötti különbség nem túl nagy. Ezért a HBr gáz kovalens kötéssel polarizált, és a hidrogénatomnak enyhe pozitív, a brómnak pedig enyhe negatív töltése van. Ennek eredményeként az elektronpárt a bróm vonzza.
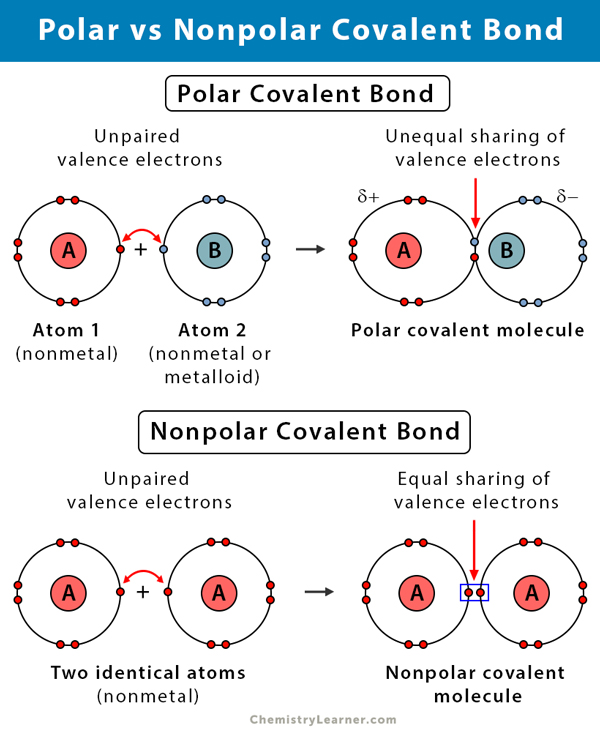
Különbség a poláris és nem poláris kovalens kötések között
A következő táblázatban összehasonlítjuk és szembeállítjuk a poláris és nem poláris kovalens kötéseket.
Poláris kovalens kötés vs. Nem poláris kovalens kötés |
||
| Poláris | Nonpoláris | |
|---|---|---|
|
Atomtípusok |
Két nemfém között. Különböző elektronegativitású |
Két azonos elektronegativitású nemfém között |
|
Elektronegativitáskülönbség |
0.1 – 2 |
|
|
Elektroneloszlás |
Aszimmetrikus. Egyenlőtlen elosztás. |
Szimmetrikus. Egyenlő megosztottság. |
|
A megosztott elektronok eltolódása |
Az elektronegatívabb atom felé, így az a rész negatívvá válik |
Nincs eltolódás. Elektromosan semleges. |
|
Dipólusmomentum |
Nem-nulla |
Nulla |
|
Más típusú kötések jelenléte a vegyületekben |
Hidrogénkötés |
Van der Waals kötés |
|
Affinitás a vízhez |
Hidrofil |
Hidrofób |
|
A vegyületek fizikai tulajdonságai |
magas olvadás- és forráspont |
alacsony olvadás- és forráspont |
|
Folyadékok illékonysága |
alacsony illékonyság |
magas illékonyság |
|
Vegyületek oldhatósága |
Poláris oldószerekben oldódik |
Nem poláris oldószerekben oldódik |
|
Példák |
Víz (H2O), Ammónia (NH3) és hidrogén-klorid (HCl) |
Hidrogén (H2), oxigén (O2) és nitrogén (N2) |
.