Abstract
A nyaki tömeg diagnózisa kihívást jelenthet. Felnőtteknél a leggyakoribb diagnózis a rosszindulatú daganat, és mind a primer, mind az áttétes daganatokat figyelembe kell venni. További gyakori lehetőség a fertőző folyamatok. Egy 88 éves nőbeteg esetét mutatjuk be, akinél gyulladásos tünetekkel járó, antibiotikum-terápiára nem reagáló submandibularis tömeget találtunk, és a finom tűs aspirációs biopszia gyulladásos elváltozást mutatott. A tömeg egy hónap alatt alakult ki, amihez anorexia társult, ami a nyílt biopsziával történő diagnózis felállításához vezetett. A felvételt követően a jobb emlő invazív karcinómáját diagnosztizálták, és a submandibularis tömegből vett biopszia mycobakteriális tenyésztése Mycobacterium tuberculosisra pozitív volt. Az idősek immunszcenciája hozzájárul a rákos megbetegedésekkel szembeni sérülékenységhez, de a fertőzésekkel szemben is, amelyek atipikusan jelentkezhetnek, és így késleltetett diagnózist eredményezhetnek.
Bevezetés
A nyaki daganatok differenciáldiagnózisa rendkívül nagy kihívást jelent, mivel számos tényezőt kell figyelembe venni. Felnőtteknél a fő diagnosztikai lehetőség a rosszindulatú daganat, akár primer, akár a felső légúti vagy emésztőrendszeri daganatokból áttétes, akár limfóma . Jóindulatú daganatok, például lipómák, fibromák és hemangiómák is előfordulhatnak.
A 40 év feletti betegek nyaki daganatainak 75 százaléka rosszindulatú , és a kockázat az életkor előrehaladtával nő . Az elváltozás mérete és a tünetek időtartama a rosszindulatúság kockázatának további fontos előrejelzői , valamint a krónikus napozás, a dohányzás, az alkoholfogyasztás, a rossz fogazat, a környezeti hatások és a családi anamnézis .
A tömeg fizikai jellemzői szintén fontosak a differenciáldiagnózis szempontjából. A szilárd, kemény vagy rögzített, szabálytalan határokkal rendelkező tömör, szilárd rosszindulatú daganatra utalnak; a többszörös lágy és gumiszerű tömegek limfómára utalnak; a gyulladásos tünetekkel rendelkező tömegek fertőző okokra utalnak .
A gyulladásos tömegek a nyirokcsomók gyulladásából (nyaki adenitis) eredhetnek, amelyek általában önkorlátozóak és spontán megszűnnek . A submandibularis vagy parotis mirigyek krónikus gyulladása krónikus sialadenitisszel szintén lehetséges .
A fertőzéses okok lehetnek vírusos, bakteriális vagy gombás jellegűek . Az olyan vírusfertőzések, mint a citomegalovírus (CMV), Epstein-Barrvirus (EBV), kanyaró, adenovírus, echovírus, rhinovírus és a légúti szincitális vírus (RSV) általában több nyirokcsomó nyaki adenitiszével járnak. A bakteriális fertőzések nekrózist okozhatnak, tályogképződéssel, spontán lefolyással és akár krónikus sipolyképződéssel . Más kórokozókat is figyelembe kell venni, nevezetesen a mycobacteriumot , a Bartonella által okozott macskakarmolásos betegséget , az actinomycosis-t , a Toxoplasma gondii-t .
Egyéb ritkább okok a köszvény , a gyulladásos pseudotumor , a Kimura-kór , a Castleman-kór és a szarkoidózis .
A diagnózis általában finom tűs aspirációs citológiával történik, amely gyors és érzékeny módszer . Ha a diagnózis nem egyértelmű, szükség lehet nyílt biopsziára . A laboratóriumi vizsgálatok a megjelenéstől függően változnak, de tartalmazniuk kell a gyulladásos paramétereket, beleértve a leukocitaszámot, az eritrociták süllyedési sebességét (ESR), a C-reaktív fehérjét (CRP), a vírus- és bakteriális szerológiát a klinikai anamnézis és vizsgálat szerint, valamint a tuberkulin bőrtesztet . A tömeg jellemzése ultrahanggal végezhető, amely megkülönbözteti a cisztás elváltozásokat, nyálmirigy-tumorokat, reaktív vagy rosszindulatú nyirokcsomókat olyan kritériumok alapján, mint a méret és az érképződés . A számítógépes tomográfia (CT) és a mágneses rezonanciás képalkotás (MRI) tovább segít a daganatok jellemzésében a méret és a morfológiai eltérések (központi nekrózis, zsírszövetek és heterogenitás) alapján. A pozitronemissziós tomográfia használható a nyaki tömegek vizsgálatára, mivel kimutatja a fokozott anyagcserét , azonban önálló vizsgálatként nem ajánlott, mivel nem különbözteti meg a gyulladásos és a daganatos elváltozásokat . Rosszindulatúság gyanúja esetén további vizsgálatokat kell végezni, beleértve a teljes test CT-vizsgálatát és a felső légúti és emésztőrendszeri endoszkópos vizsgálatokat .
Egy eset beszámolója
Egy 88 éves, idősek otthonában élő, törékeny nő esetét mutatjuk be, aki 3-4 hetes progresszív lefolyású prostráció, anorexia és egy gyulladásos tünetekkel járó jobb submandibularis tömeg miatt jelentkezett a sürgősségi osztályon. A nőt a száj- és állcsontsebészeti osztályon vizsgálták, ahol finom tűs aspirációs citológiai vizsgálatot végeztek a tömegen, amely gyulladásos sejteket mutatott ki, amelyek negatívak voltak daganatos sejtekre. Továbbá már korábban is szájon át szedett amoxicillin-clavulánsavval (875 mg/125 mg 3id 7 napon át) kezelték, javulás nélkül.
A kórtörténetében esszenciális hipertónia, sinusbradycardia, perifériás artériás betegség, enyhe kognitív zavar és depresszió szerepelt. Polimedikálták aszpirinnel, olmezartánnal, pentoxifyllinnel, paroxetinnel és alprazolammal.
A vizsgálat során elhízott volt, 3 × 3 cm-es, nem érzékeny, tömör, de gumiszerű submandibularis tömeget mutatott, gyulladásos tünetekkel, váladék nélkül (1. ábra). Lázmentes maradt, más releváns klinikai tünet nem volt.
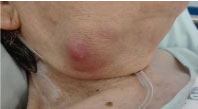 1. ábra: A jobb oldali submandibularis tömeg fényképe. Az 1. ábra megtekintése
1. ábra: A jobb oldali submandibularis tömeg fényképe. Az 1. ábra megtekintése
A betegség progressziójára való tekintettel a beteget további vizsgálatokra, többek között a tömeg nyílt biopsziájára vették fel, és empirikus kezelést kezdtek intravénás amoxicillin-clavulánsavval (1000 mg/200 mg további 9 napig) és klindamicinnel (600 mg 4id 7 napig), szintén klinikai javulás nélkül.
A vérvizsgálatok csak mikrocitikus hipokróm anémiát mutattak ki vashiánnyal és negatív gyulladásos paraméterekkel (1. táblázat).
1. táblázat: A beteg vérképe.1. táblázat megtekintése
A teljes test számítógépes tomográfiája (CT) több nekrotikus nyaki nyirokcsomót mutatott ki, a legnagyobbat a bal supraclavicularis fossae-ban, valamint egy csomót a jobb emlőmirigyben, szabálytalanul, érképződésre utaló hyperattenuáló jellel (2. ábra és 3. ábra).
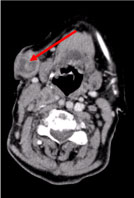 2. ábra: Nyaki CT-vizsgálat: Többszörös nekrotikus nyaki nyirokcsomók, a legnagyobb szubkután, 27 mm átmérőjű (nyíl). 2. ábra megtekintése
2. ábra: Nyaki CT-vizsgálat: Többszörös nekrotikus nyaki nyirokcsomók, a legnagyobb szubkután, 27 mm átmérőjű (nyíl). 2. ábra megtekintése
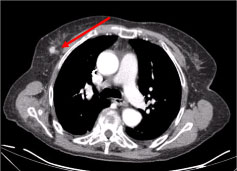 3. ábra: Mellkas CT-vizsgálat: 10 mm-es elváltozás a jobb oldali emlőmirigyben, csomósan szabálytalan, érképződésre utaló hiperhígulásos jel (nyíl). 3. ábra megtekintése
3. ábra: Mellkas CT-vizsgálat: 10 mm-es elváltozás a jobb oldali emlőmirigyben, csomósan szabálytalan, érképződésre utaló hiperhígulásos jel (nyíl). 3. ábra megtekintése
Nyílt biopsziát végeztek, amely polimorf nukleáris leukociták és histiociták lágyrész-infiltrációját és vasculitist mutatott. A Gram-, Grocott-, Ziehl-Neelsen- és PAS-festés negatív volt; a Mycobacterium tuberculosis kimutatására szolgáló polimeráz láncreakción (PCR) alapuló vizsgálat a szövetekben szintén negatív volt.
A beteget elbocsátották, további követés mellett az emlő- és állcsontsebészeti klinikán.
A mellsebészeti klinikán ultrahangvezérelt magtű biopsziát végeztek az emlőelváltozásból. Invazív emlőkarcinóma NOS, 1-es fokozatot diagnosztizáltak. A daganat ER-pozitív (90%), PR-pozitív (90%), immunhisztokémia szerint HER2 2+, ISH negatív, a proliferációs index (Ki67) 10% volt (luminalis A molekuláris altípus) (4. ábra). Stádiumbeosztása cT1N0M0 volt. Ekkor a beteg tamoxifent kezdett kapni.
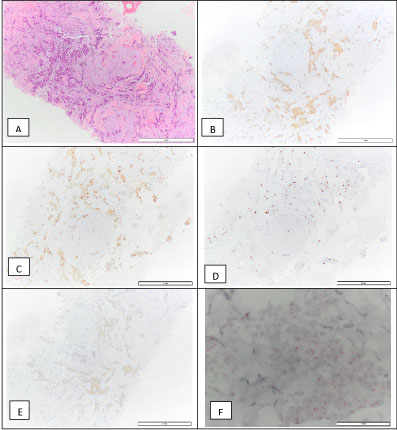 4. ábra: Az emlő invazív karcinóma biopsziája: H&E (A), pozitív az ösztrogénreceptorra – 90% (B), pozitív a progeszteronreceptorra – 90% (C), Ki67 – 10% (D), HER2 2+ (E) és negatív D-ISH HER2 amplifikáció (F), ami összeegyeztethető a luminalis A molekuláris altípussal. 4. ábra megtekintése
4. ábra: Az emlő invazív karcinóma biopsziája: H&E (A), pozitív az ösztrogénreceptorra – 90% (B), pozitív a progeszteronreceptorra – 90% (C), Ki67 – 10% (D), HER2 2+ (E) és negatív D-ISH HER2 amplifikáció (F), ami összeegyeztethető a luminalis A molekuláris altípussal. 4. ábra megtekintése
Két hónappal később a nyitott biopszia mycobakteriális tenyésztése Mycobacterium tuberculosis complexre pozitív volt, amely minden első vonalbeli antibiotikumra érzékeny. A beteg első vonalbeli antituberkulotikumokkal (300 mg izoniazid, 600 mg rifampicin, 1500 mg pirazinamid és 1200 mg etambutol 2 hónapig, majd 4 hónapig 300 mg izoniazid és 600 mg rifampicin) kezdte meg a terápiát, és utókezelésre a tuberkulózis klinikára utalták.
A beteg az eredeti diagnózis felállítása után 1 évvel meghalt.
Elbeszélgetés
Amint azt korábban tárgyaltuk, a nyaki tömeg diagnózisát több tényező befolyásolja. Az életkor és a gyengeség a fő tényezők, amelyeket figyelembe kell venni.
Az öregedés az immunválasz csökkenésével jár, amelyet gyakran immunoseneszcenciaként írnak le . Ez mind az adaptív, mind a veleszületett rendszert érinti, eltérő módon . Az adaptív immunrendszer működése gyakran csökken, általában a T-sejtek aktivitásának csökkenésével . Másrészt a veleszületett immunrendszert a szabályozóerő hiánya miatt túlzottnak írták le, ami pro-gyulladásos állapotot eredményezhet, ami szintén káros . Az immunöregedést összefüggésbe hozták a fertőzések gyakoriságának és súlyosságának növekedésével , a rosszindulatú sejtek alacsonyabb immunfelügyeletével és a vakcinázás csökkent hatékonyságával .
Ezért az immunöregedés hozzájárul az időseknél a rák megnövekedett diagnózisához, a diagnózis felállításakor a medián életkor 70 év . Más tényezők is szerepet játszanak, mint például a karcinogenezisnek kitett hosszabb idő vagy az idősebb sejtek nagyobb fogékonysága a karcinogenezisre , de a fokozott paradox gyulladásos válasz is .
A fertőzések gyakoribbak az időseknél, különösen a légúti fertőzések , amelyekhez nagy mortalitás társul. A tuberkulózis fontos közegészségügyi probléma, amely világszerte 9,6 millió embert érint, és a 65 év feletti lakosság körében egyre növekszik . Azt feltételezik, hogy az időskori tuberkulózis gyakran a látens tuberkulózis reaktiválódásának eredménye, mivel a sejtes immunválasz csökken. A tuberkulózis azonban eredhet primer fertőzésből vagy korábban kezelt beteg újrafertőződéséből is . Más tényezők is növelik az idősek tuberkulózisának kockázatát, mint például az idősek otthonában való tartózkodás, ami 2-3-szorosára növeli a kockázatot . Egyes társbetegségek, mint a cukorbetegség , krónikus obstruktív tüdőbetegség , májbetegség, rosszindulatú daganatos és szív- és érrendszeri betegségek ; kortikoidokkal és TNF-ellenes szerekkel végzett immunszuppresszív terápia ; és alultápláltság .
Az idősek tuberkulózisa atipikus klinikai megjelenésű . A fő megjelenési forma az esetek 75%-ában még mindig a tüdő, de az extrapulmonális helyek gyakoribbak. A szervspecifikus tünetek ritkábbak, és a betegek több homályos tünetet mutatnak, mint például asztenia és kognitív károsodás . A diagnózis felállítása is nehezebb, mivel az időseknél gyakoriak a krónikus eltérések, mint például a kóros májenzimek, hypoalbuminaemia, hyponatraemia, hypokalaemia, anaemia . Radiográfiailag kevesebb a krónikus elváltozás . A tuberkulin bőrteszt az anergia miatt gyakran bizonytalan, és a lökéshatást kihasználva ismétlésre van szükség . A mintatenyésztés negatív lehet . A kezelés az idősek esetében is kihívást jelent a rosszabb compliance és a polifarmácia miatt, ami a toxicitás, különösen a hepatotoxicitás fokozott kockázatával jár . A halálozás is jelentősen magasabb, akár 10-szeresére is emelkedhet .
Ez az esetismertetés jól szemlélteti az időseknél a nyaki tömeg diagnosztizálásának kihívásait. A helyi gyulladásos tünetek fertőzésre utaltak, de a szisztémás tünetek felvetették a malignitás gyanúját. Utólag azt állíthatjuk, hogy több jel és laboratóriumi vizsgálat is utalhatott tuberkulózisra, mint például a gyulladásos tünetek, az antibiotikumokkal szembeni rezisztencia, a vérszegénység és a hyponatremia. Az invazív emlőkarcinóma egyidejű diagnózisa véletlen lelet volt. Ugyanakkor ésszerű feltételezni, hogy a rák hozzájárulhatott az immunreneszcenciához, elősegítve a látens tuberkulózis reaktiválódását.
Finanszírozási támogatás
Finanszírozási támogatás nem volt.
A szerzők hozzájárulása
Minden szerző egyenlő mértékben járult hozzá.
- Gleeson M, Herbert A, Richards A (2000) Management of lateral neck masses in adults. BMJ 320: 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66: 831-838.
- Armstrong WB, Giglio MF (1998) Van-e ok aggodalomra ez a csomó a nyakon? Postgrad Med 104.
- Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.
- Barnes L (1996) Pathology of the head and neck: Általános megfontolások. (3. edn), In: A nyak és a nyak, valamint a nyak és a nyak és a nyak és a nyakszirtek sebészete: Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1: 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana, and B. bacilliformis: historical pathogens of emerging significance. Microbes Infect 2: 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 9: 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33: 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Inflammatory pseudotumor of the parapharyngeal space: case report and review of the literature. Head Neck 14: 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimura-kór: két esetismertetés és irodalmi áttekintés. Ann Otol Rhinol Laryngol 107: 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castleman’s disease): a report of five cases. Otolaryngol Head Neck Surg 113: 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologic manifestations of sarcoidosis: presentation and diagnosis. Laryngoscope 107: 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8: 91-97.
- Ponnappan S, Ponnappan U (2011) Aging and immun function: molecular mechanisms to interventions. Antioxid Redox Signal 14: 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Immunosenescence of ageing. J Pathol 211: 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) The aging immune system and its relationship with cancer. Aging health 7: 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Effects of aging on human leukocytes (part I): immunophenotyping of innate immune cells. Age (Dordr) 37: 92.
- Mcelhaney JE, Effros RB (2009) Immunosenescence: what does it mean to health outcomes in older adults? Curr Opin Immunol 21: 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) Cancer survival and incidence from the Surveillance, Epidemiology, and End Results (SEER) program. Oncologist 8: 541-552.
- Finkel T, Serrano M, Blasco MA (2007) A rák és az öregedés közös biológiája. Nature 448: 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, ageing and cancer. Mech Ageing Dev 130: 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2: 801-810.
- Bellmann-Weiler R, Weiss G (2009) Pitfalls in the diagnosis and therapy of infections in elderly patients–a mini-review. Gerontology 55: 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) The strategic framework of tuberculosis control and prevention in the elderly: a scoping review towards End TB targets. Infect Dis Poverty 6: 70.
- Byng-Maddick R, Noursadeghi M (2016) Does tuberculosis threaten our ageing populations? BMC Infect Dis 16: 119.
- Negin J, Abimbola S, Marais BJ (2015) Tuberculosis among older adults–time to take notice. Int J Infect Dis 32: 135-137.
- Rajagopalan S (2001) Tuberculosis and aging: a global health problem. Clin Infect Dis 33: 1034-1039.
- Rajagopalan S (2016) Tuberculosis in Older Adults. Clin Geriatr Med 32: 479-491.
- Chan E (2006) Tuberculosis in the elderly: Tartsunk magas gyanúindexet. Journal of Respiratory Diseases 27: 307-315.
- Jeon CY, Murray MB (2008) A diabetes mellitus növeli az aktív tuberkulózis kockázatát: 13 megfigyelési tanulmány szisztematikus áttekintése. PLoS Med 5: e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, et al. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5: e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, et al. (2015) Increased risk of mycobacterial infections associated with anti-rheumatic medications. Thorax 70: 677-682.
- Morris CD (1990) Pulmonary tuberculosis in the elderly: a different disease? Thorax 45: 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) Does aging modify pulmonary tuberculosis?: A meta-analytical review. Chest 116: 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77: 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberculosis in the geriatric patient. J Am Geriatr Soc 31: 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Clinical characteristics and treatment outcomes of tuberculosis in the elderly: a case control study. BMC Infect Dis 13: 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119: 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Mortality among tuberculosis patients in The Netherlands in the period 1993-1995. Eur Respir J 11: 816-820.
Citation
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) A Submandibular Mass in an Elderly Patient. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064