Relazioni di pressione, volume e temperatura nei gas reali
Per un gas ideale, un grafico di \(PV/nRT\) contro \(P\) dà una linea orizzontale con un’intercetta di 1 sull’asse \(PV/nRT\). I gas reali, tuttavia, mostrano deviazioni significative dal comportamento atteso per un gas ideale, in particolare alle alte pressioni (Figura \PageIndex{1a}). Solo a pressioni relativamente basse (meno di 1 atm) i gas reali si avvicinano al comportamento del gas ideale (Figura \PageIndex{1b}).
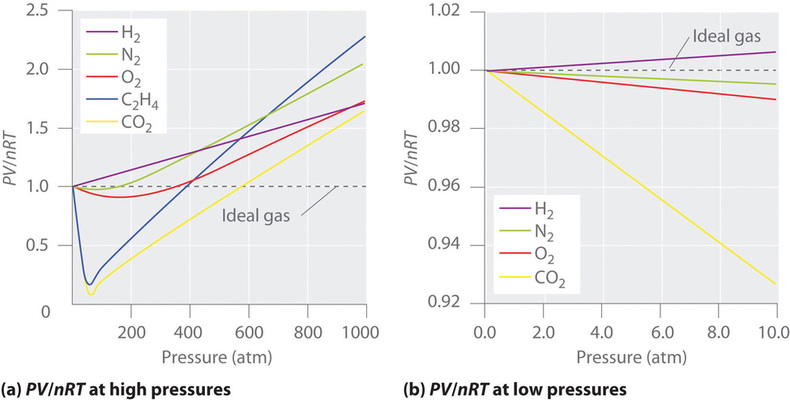
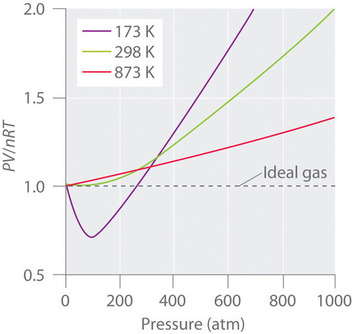
I gas reali si avvicinano anche al comportamento del gas ideale più da vicino a temperature più alte, come mostrato nella figura \PageIndex{2}\ per \N_2\. Perché i gas reali si comportano così diversamente dai gas ideali ad alte pressioni e basse temperature? In queste condizioni, le due assunzioni di base dietro la legge dei gas ideali – cioè che le molecole di gas hanno un volume trascurabile e che le interazioni intermolecolari sono trascurabili – non sono più valide.
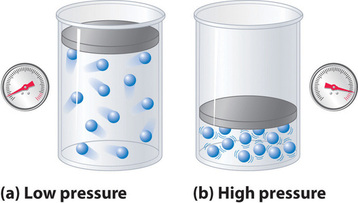
Perché si suppone che le molecole di un gas ideale abbiano volume zero, il volume a loro disposizione per il movimento è sempre uguale al volume del contenitore. Al contrario, le molecole di un gas reale hanno volumi piccoli ma misurabili. A basse pressioni, le molecole gassose sono relativamente distanti tra loro, ma all’aumentare della pressione del gas, le distanze intermolecolari diventano sempre più piccole (Figura \PageIndex{3}). Di conseguenza, il volume occupato dalle molecole diventa significativo rispetto al volume del contenitore. Di conseguenza, il volume totale occupato dal gas è maggiore di quello previsto dalla legge dei gas ideali. Così a pressioni molto elevate, il valore misurato sperimentalmente di PV/nRT è maggiore del valore previsto dalla legge dei gas ideali.
Inoltre, tutte le molecole sono attratte le une alle altre da una combinazione di forze. Queste forze diventano particolarmente importanti per i gas a basse temperature e alte pressioni, dove le distanze intermolecolari sono più brevi. Le attrazioni tra le molecole riducono il numero di collisioni con la parete del contenitore, un effetto che diventa più pronunciato all’aumentare del numero di interazioni attrattive. Poiché la distanza media tra le molecole diminuisce, la pressione esercitata dal gas sulla parete del contenitore diminuisce, e la pressione osservata è inferiore a quella prevista (Figura \PageIndex{4}). Quindi, come mostrato nella figura \PageIndex{2}, a basse temperature, il rapporto di \PV/nRT\ è inferiore a quello previsto per un gas ideale, un effetto che diventa particolarmente evidente per i gas complessi e per i gas semplici a basse temperature. A pressioni molto alte, l’effetto del volume molecolare non nullo predomina. La competizione tra questi effetti è responsabile del minimo osservato nel grafico \(PV/nRT\) contro \(P\) per molti gas.
Il volume molecolare nullo rende il volume reale maggiore di quello previsto alle alte pressioni; le attrazioni intermolecolari rendono la pressione minore di quella prevista.
Alle alte temperature, le molecole hanno sufficiente energia cinetica per superare le forze attrattive intermolecolari, e gli effetti del volume molecolare nullo predominano. Al contrario, man mano che la temperatura si abbassa, l’energia cinetica delle molecole del gas diminuisce. Alla fine, si raggiunge un punto in cui le molecole non possono più superare le forze attrattive intermolecolari, e il gas si liquefa (si condensa in un liquido).