
La precipitazione del carbonato di calcio (calce) è un problema comune di intasamento nei sistemi di microirrigazione. L’acqua con un pH di 7,5 o superiore e un livello di bicarbonato di almeno 2 meq/l (120 ppm) è suscettibile alla precipitazione del carbonato di calcio se livelli comparabili di calcio sono presenti naturalmente nel sistema o se un composto che contiene calcio viene iniettato nel sistema.
Cause della precipitazione del carbonato di calcio
Il grado in cui il carbonato di calcio si verifica in acqua a pressione atmosferica dipende dal pH e dalla temperatura dell’acqua. A valori di pH inferiori a circa 6, l’acqua contiene principalmente anidride carbonica dissolta e una piccola quantità di acido carbonico. A valori di pH compresi tra circa 6,5 e 10, il bicarbonato è dominante. A valori di pH superiori a circa 10,5, lo ione carbonato domina. Le cause della precipitazione includono quanto segue.
- Per le acque sotterranee, il pompaggio riduce la pressione dell’acqua mentre scorre nel pozzo. Questa riduzione rilascia gas di anidride carbonica dissolta, causando l’aumento del pH dell’acqua freatica, che a sua volta può causare la precipitazione di carbonato di calcio.
- L’evaporazione aumenta la concentrazione di sostanze chimiche che sono dissolte nell’acqua che rimane nell’emettitore. A causa della sua bassa solubilità in acqua, il carbonato di calcio precipita facilmente durante l’evaporazione.
- Il grado di solubilità del carbonato di calcio diminuisce all’aumentare della temperatura dell’acqua. La temperatura dell’acqua nei sistemi di microirrigazione di superficie può aumentare man mano che l’acqua scorre lungo i canali.
- L’iniezione di alcuni prodotti chimici come l’ammoniaca acquosa e la candeggina o l’iniezione di fertilizzanti o materiali contenenti calcio come il gesso possono causare la precipitazione.
Prevenzione e correzione dei problemi di intasamento
L’abbassamento del pH dell’acqua dissolve qualsiasi precipitato esistente di carbonato di calcio e previene la formazione di ulteriori sali di carbonato. Il trattamento usuale per la precipitazione del carbonato di calcio è di iniettare acido per acidificare l’acqua, abbassando il pH a 7 o meno. Gli acidi comuni usati a questo scopo includono acido solforico, acido muriatico e acido cloridrico. Altri acidi come l’acido citrico e l’acido nitrico possono essere usati, ma sono più costosi.
Un composto acido-fertilizzante come l’acido urea-solforico è più sicuro da usare che un acido puro. Tuttavia, l’iniezione continua di prodotti acidi contenenti azoto può causare problemi nel corso di una stagione per le colture che sono sensibili alle applicazioni eccessive di azoto, come mele e uva da vino.
I ricercatori hanno valutato altri composti come un fosfonato e materiali di acido fosfonico e li hanno trovati efficaci nel prevenire la precipitazione del carbonato di calcio.
I trattamenti raccomandati per prevenire l’intasamento sono i seguenti.
- Iniezione continua di acido per mantenere il pH dell’acqua tra 5 e 7.
- Iniezione intermittente di acido per mantenere il pH dell’acqua sotto 4 per almeno 30-60 minuti. La frequenza di iniezione dipende dal tasso di precipitazione dei carbonati. Quando si usano emettitori compensatori di pressione, verificare con il produttore prima di abbassare il pH a 4 o meno. L’ottone e tutti gli altri raccordi di metallo non inossidabile possono essere bucherellati.
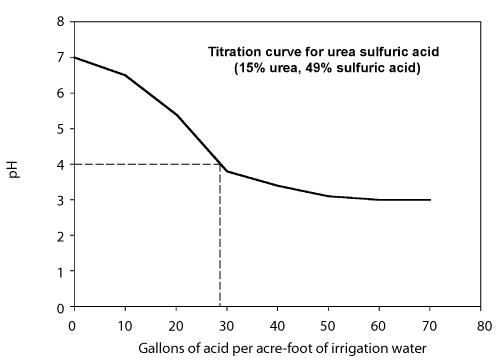
La quantità di acido necessaria per abbassare il pH al livello desiderato dipende dall’alcalinità dell’acqua e dal pH desiderato. Due approcci possono essere usati per determinare la quantità di acido necessaria. - Sviluppare una curva di titolazione che mostra la quantità di acido necessaria per abbassare il pH dell’acqua ad un valore desiderato per una particolare acqua di irrigazione. Questo viene fatto di solito da un laboratorio e richiede che si forniscano campioni dell’acqua e dell’acido. Il comportamento della titolazione dipende dall’alcalinità dell’acqua di irrigazione quindi la curva di titolazione può variare da una fonte di acqua all’altra. La figura 8 mostra una curva di titolazione usando una soluzione di urea-acido solforico contenente il 49% di acido solforico.
- Utilizzare un approccio per tentativi ed errori aggiungendo acido all’acqua con incrementi e misurando il pH, ripetendo fino a raggiungere il livello di pH desiderato. Per determinare il pH dell’acqua si possono usare cartine tornasole, kit di test colorimetrici per acquari e piscine, e misuratori di pH portatili. Numerose fonti vendono misuratori di pH tascabili; essi richiedono una calibrazione periodica usando soluzioni standard che possono anche essere acquistate.
Figura 8. Curva di titolazione per l’acido solforico ureico con il 49% di acido solforico.
Calcolo del tasso di iniezione
Una volta determinato quanto acido è necessario, è possibile calcolare il tasso di iniezione dell’acido utilizzando la seguente equazione:
IR = (A × Q × 60) ÷ 326,000
dove
IR = il tasso di iniezione in galloni all’ora (gph)
A = i galloni di acido per piede-acro di acqua necessari per abbassare il pH
Q = la portata del sistema di irrigazione in galloni al minuto (gpm)
Gli acri-piede di acqua possono essere determinati dalla formula Q × T × 60 ÷ 326,000, dove T è il tempo di irrigazione impostato in ore.
Monitorare il pH dell’acqua durante il processo di iniezione per assicurarsi che non vada molto al di sotto di 4. Tutte le acque sono “tamponate” in modo diverso dai sali che contengono; un’acqua può richiedere 10 gph mentre un’altra ne richiederà solo 2 gph.
Esempio
Calcolare il tasso di iniezione necessario per abbassare il pH a 4 usando un acido urea-sulfurico (49%). La figura sopra è la curva di titolazione. La portata del sistema è di 1.000 galloni al minuto.
Passo 1. Dalla curva di titolazione, nota che sono necessari 26 galloni di acido urea-solforico per acro-piede d’acqua per abbassare il pH a 4.
Step 2.
IR = (26 × 1.000 × 60) ÷ 326.000 = 4,8 gph
Misure di sicurezza
- Non mescolare direttamente acido e cloro. Questo causerà la formazione di gas di cloro velenoso.
- Non aggiungere acqua all’acido. Invece, aggiungere sempre l’acido all’acqua.