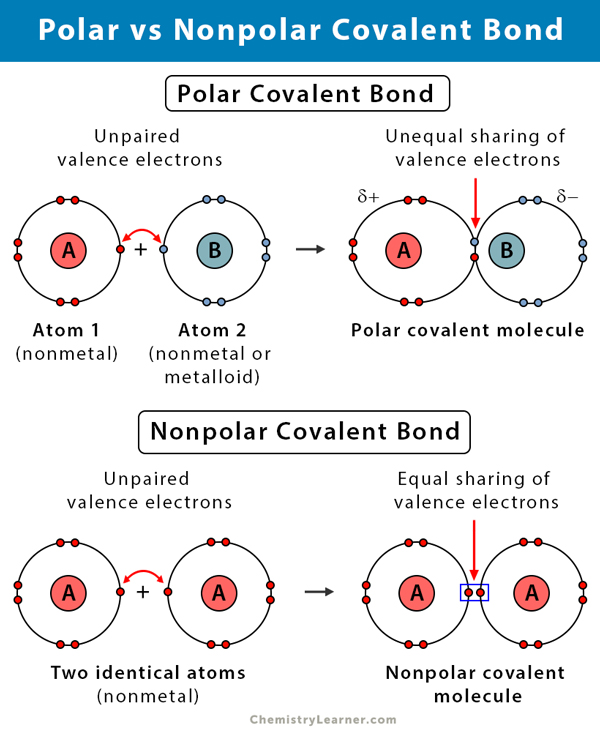
Che cos’è un legame covalente polare?
Un legame covalente si forma quando due atomi condividono elettroni tra loro. Il legame covalente è probabilmente polare quando gli elettroni sono condivisi in modo disuguale. L’asimmetria è dovuta alla differenza di elettronegatività dei due atomi. L’elettronegatività è una misura della tendenza di un atomo ad attrarre una coppia di elettroni di legame. Viene misurata utilizzando una scala nota come scala di Pauling e varia da 0,7 a 4. La seguente tabella spiega il tipo di legame chimico formato a causa di questa differenza di elettronegatività.
| Tipo di legame chimico | Differenza di elettronegatività |
|---|---|
| Covalente non polare | 0 |
| Covalente leggermente polare | 0.1 a 0,4 |
| Covalente polare | 0,5 a 2 |
| Ionico | > 2 |
Più significativa è la differenza di elettronegatività, maggiore è la polarità e la forza del legame. Quindi, i legami covalenti polari hanno una forza di legame intermedia.
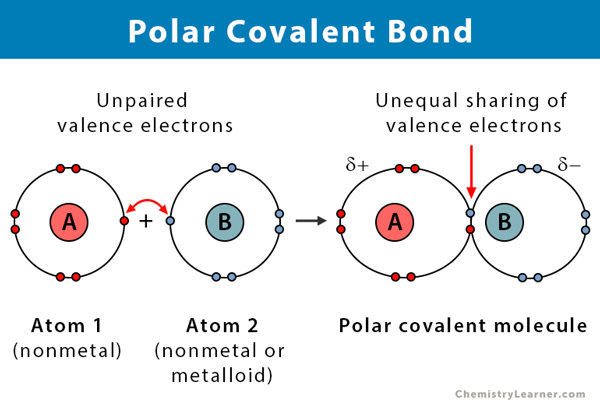
Proprietà dei legami covalenti polari
Ecco alcuni fatti sui legami covalenti polari.
- Si verifica tra due non metalli o tra un non metallo e un metalloide
- Ineguale condivisione di elettroni in un composto
- La differenza di elettronegatività tra atomi è tra 0.1 e 2
- Una estremità del legame è caricata positivamente, e l’altra estremità è caricata negativamente
- I composti polari si dissolvono in un solvente polare
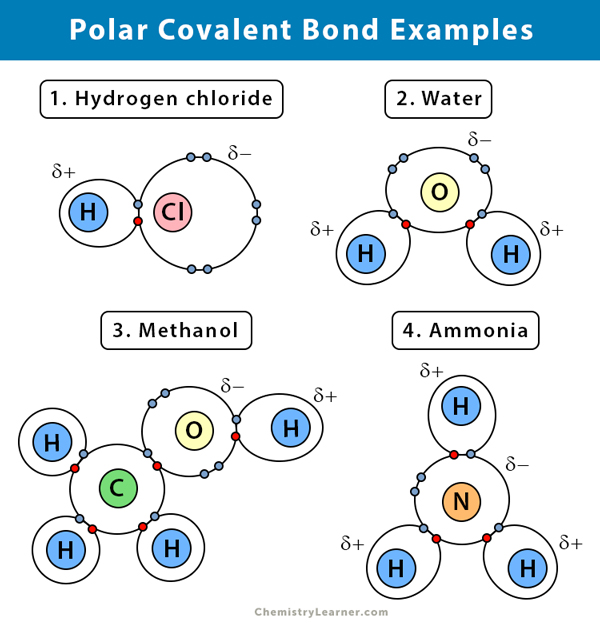
Esempi di legami covalenti polari
Ecco alcuni esempi di un legame covalente polare con la differenza di elettronegatività tra i due atomi di legame:
| Nome del composto | Formula molecolare | Bond | Elettronegatività differenza |
|---|---|---|---|
|
Acqua |
H2O |
O-H |
|
| Fluoruro di idrogeno | HF | H-F | 1.9 |
| Cloruro di idrogeno | HCl |
H-Cl |
0.9 |
|
Bromuro di idrogeno |
HBr |
H-Br |
|
|
Ammonia |
NH3 |
N-H |
|
|
Diossido di zolfo |
SO2 | S=O | 1 |
| Solfuro di idrogeno | H2S | H-S | 0.4 |
| Metanolo | CH3OH | O-H | 1.4 |
Di seguito è data una spiegazione del legame covalente polare in alcuni composti.
Acqua (H2O)
L’acqua è un solvente polare. Un legame covalente polare si crea quando l’atomo di ossigeno (O), essendo più elettronegativo dell’idrogeno, tira gli elettroni condivisi verso di sé. Di conseguenza, l’atomo di ossigeno ha una parziale carica negativa associata ad esso. Gli idrogeni (H), d’altra parte, sono essenzialmente protoni e hanno una parziale carica positiva associata ad essi.
Cloruro di idrogeno (HCl)
Il cloruro di idrogeno è un composto covalente polare poiché l’atomo di cloro (Cl) è più elettronegativo di quello dell’idrogeno (H). Quindi, il cloro porta una parziale carica negativa, mentre l’idrogeno porta una parziale carica positiva.
Ammonia (NH3)
L’ammoniaca è una molecola polare. L’atomo centrale, l’azoto (N), è legato a tre atomi di idrogeno (H). Dato che N è più elettronegativo di H, gli elettroni tenderanno a rimanere intorno all’atomo di N.
Bromuro di idrogeno (HBr)
La differenza di elettronegatività tra idrogeno (H) e bromo (Br) non è troppo alta. Pertanto, il gas HBr ha un legame covalente polarizzato, e l’atomo di idrogeno ha una leggera carica positiva, e il bromo ha una leggera carica negativa. Come risultato, la coppia di elettroni è attratta dal bromo.
Differenza tra legami covalenti polari e non polari
La seguente tabella confronta e contrasta i legami covalenti polari e non polari.
Legame covalente polare vs. Legame covalente non polare |
||
| Polare | Nonpolare | |
|---|---|---|
|
Tipi di atomi |
Tra due non metalli con diversa elettronegatività |
Tra due non metalli con la stessa elettronegatività |
|
Differenza di elettronegatività |
0.1 – 2 |
|
|
Distribuzione degli elettroni |
Asimmetrica. Condivisione ineguale. |
Simmetrica. Condivisione uguale. |
|
Spostamento degli elettroni condivisi |
verso l’atomo più elettronegativo, rendendo quella parte negativa |
Nessuno spostamento. Elettricamente neutro. |
|
Momento di dipolo |
Non-zero |
Zero |
|
Presenza di altri tipi di legami nei composti |
Legame idrogeno |
Legame Van der Waals |
|
Affinità verso l’acqua |
Idrofilo |
Idrofobico |
|
Proprietà fisiche dei composti |
Alti punti di fusione e punti di ebollizione |
Punti di fusione e di ebollizione bassi |
|
Volatilità dei liquidi |
Bassa volatilità |
Alta volatilità |
|
Solubilità dei composti |
Solubile in solventi polari |
Solubile in solventi non polari |
|
Esempi |
Acqua (H2O), ammoniaca (NH3) e cloruro di idrogeno (HCl) |
Idrogeno (H2), ossigeno (O2) e azoto (N2) |