- Introduzione
- Metodi
- Dati di distribuzione e classificazione dei biomi
- Species Composition Among Biomes
- Dati sui tratti
- Misurazione degli ipervolumi dei tratti
- Distinzione funzionale e diffusione
- Similitudine dello spazio funzionale e del bioma
- Risultati
- Discussione
- Carenze di conoscenza
- Schemi comuni all’interno dei biomi
- Confronti tra i biomi
- Conclusioni
- Data Availability
- Contributi degli autori
- Finanziamento
- Conflict of Interest Statement
- Acknowledgments
- Materiale supplementare
Introduzione
Ecologi e biogeografi organizzano la biodiversità vegetale terrestre in biomi determinati dal clima, con fisionomie caratterizzate dalle forme di crescita e dai tratti funzionali delle specie dominanti (Moncrieff et al., 2016). In effetti, il concetto di bioma ha una lunga storia che risale a Carl Ludwig Willdenow e Alexander von Humboldt. Willdenow riconobbe che climi simili supportano forme di vegetazione simili, e Humboldt osservò la diffusa associazione tra distribuzione delle piante, fisionomia e fattori ambientali. Nel complesso, il concetto di bioma riflette il presupposto che pressioni ambientali simili selezionano specie con attributi funzionali simili, indipendentemente dalla loro storia evolutiva. Allo stesso tempo, i biomi esistenti sulla Terra sono in una certa misura filogeneticamente distinti, con molte/maggior parte delle specie caratteristiche che provengono da lignaggi specifici che mostrano adattamenti chiave non solo alla selezione climatica ma anche a pressioni aggiuntive come il fuoco o i megaerbivori (Woodward et al., 2004; Pennington et al., 2006; Donoghue e Edwards, 2014). Poiché i biomi rappresentano regolarità su larga scala nella vegetazione della Terra, la comprensione delle differenze funzionali tra i biomi è criticamente importante per modellare il ciclo globale del carbonio e il funzionamento del sistema Terra, comprese le risposte al cambiamento globale antropogenico (Bonan et al, 2012; van Bodegom et al., 2014; Xia et al., 2015).
Gli ultimi due decenni hanno visto una rapida crescita nella comprensione della dimensione funzionale della biodiversità vegetale su scala continentale (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018). Ampi sforzi di sintesi e analisi dei dati hanno definito uno spazio limitato di tratti funzionali che incorpora la variazione delle dimensioni complessive delle piante, l’economia delle foglie e l’idraulica, noti come spettri di tratti funzionali (Wright et al., 2004; Díaz et al., 2016). Gli spettri dei tratti funzionali definiscono i trade-off fisiologici ed ecologici che determinano le strategie di life-history delle piante (Westoby, 1998; Reich et al., 2003; Craine, 2009) e la loro influenza sull’assemblaggio della comunità (Kraft et al., 2008), la funzione dell’ecosistema (Lavorel e Garnier, 2002; Garnier et al., 2004; Kerkhoff et al., 2005; Cornwell et al., 2008), e persino i tassi di evoluzione (Smith e Donoghue, 2008; Smith e Beaulieu, 2009). La generalità e l’utilità degli spettri dei tratti funzionali delle piante ha accelerato la loro incorporazione nei modelli di distribuzione globale della vegetazione (van Bodegom et al., 2014), dei cicli biogeochimici (Bonan et al., 2012) e dei servizi ecosistemici (Díaz et al., 2007; Cadotte et al., 2011; Lavorel et al., 2011). Tuttavia, pochi studi hanno esaminato misure complete della diversità funzionale alla scala del bioma attraverso specie e forme di vita sia dominanti che subordinate.
Ci sono due serie contrastanti di previsioni su come la diversità funzionale varia tra biomi climaticamente e fisionomicamente distinti. Da un lato, se la biodiversità dei biomi riflette la variazione dello spazio di nicchia ecologico disponibile, i biomi meno tassonomicamente diversi dovrebbero rappresentare un sottoinsieme più piccolo e largamente annidato dello spazio funzionale occupato dai biomi più diversi. D’altra parte, a causa della natura globale dei compromessi fondamentali nella struttura e nella funzione delle piante, e delle pressioni di selezione simili che agiscono in modo simile tra le specie, gli assemblaggi che occupano ambienti diversi possono infatti condividere aree simili dello spazio dei tratti (Reich et al., 2003; Wright et al., 2004; Díaz et al., 2016). Studi recenti confermano che le relazioni tra clima e diversità funzionale e tassonomica (cioè la ricchezza di specie) sono complesse e dipendenti dalla scala. In alcuni casi, la diversità funzionale segue da vicino i gradienti climatici, con una diversità funzionale più bassa in condizioni più variabili ed estreme (Swenson et al., 2012; de la Riva et al., 2018), e il volume dello spazio funzionale negli assemblaggi locali si espande con una ricchezza tassonomica crescente (Lamanna et al., 2014; Li et al., 2018). Tuttavia, le analisi dei pool di specie su scala regionale suggeriscono che grandi cambiamenti nella ricchezza di specie possono essere associati a impatti minimi sulla diversità funzionale (Lamanna et al., 2014; Šímová et al., 2015). Inoltre, le risposte della diversità tassonomica e funzionale al clima possono differire tra le principali forme di crescita delle piante (Šímová et al., 2018), e la diversità relativa delle diverse forme di crescita può cambiare sostanzialmente lungo i gradienti climatici che definiscono diversi biomi (Engemann et al., 2016).
I progressi nell’analisi della diversità funzionale su scala continentale e globale sono stati limitati in parte da carenze di dati nella catalogazione degli aspetti tassonomici, distributivi, filogenetici e funzionali della biodiversità (Hortal et al., 2015). Inoltre, anche dati i limitati dati disponibili, significative sfide informatiche sono associate con la standardizzazione e l’integrazione di grandi e disparati set di dati che descrivono le distribuzioni geografiche, i tratti funzionali e le relazioni filogenetiche delle specie (Violle et al., 2014). Qui esaminiamo la distribuzione della diversità funzionale delle specie vegetali attraverso i biomi del Nord e Sud America utilizzando il database Botanical Information and Ecology Network (BIEN; Enquist et al., 2016; Maitner et al., 2018), che assembla informazioni sulla distribuzione e sui tratti funzionali su >100.000 specie di piante terrestri. In particolare, esaminiamo la variazione nella diversità funzionale e la distintività dei biomi, sulla base di mappe di distribuzione delle specie di piante terrestri su una scala di celle di griglia 100 × 100 km e un set di dati completo di sei tratti funzionali che riflettono i principali assi di variazione nelle strategie ecologiche.
I nostri obiettivi in questo studio sono 3 volte. In primo luogo, al fine di evidenziare le persistenti carenze di dati, documentiamo l’estensione dei dati disponibili che caratterizzano la diversità funzionale e la particolarità dei biomi. In secondo luogo, dati i dati disponibili, caratterizziamo la distribuzione della diversità funzionale all’interno dei biomi attraverso le forme di crescita dominanti e subordinate. Queste analisi ci permettono di quantificare meglio la distintività funzionale di un bioma identificando le strategie funzionali più comuni delle specie più diffuse al suo interno. In terzo luogo, ci chiediamo se i biomi sono di fatto caratterizzati da collezioni di specie funzionalmente distinte, sulla base della sovrapposizione di ipervolumi multidimensionali nello spazio dei tratti funzionali.
Metodi
Dati di distribuzione e classificazione dei biomi
Per ridurre gli effetti dei bias di campionamento caratteristici dei dataset di occorrenza compilati da più risorse, abbiamo utilizzato le mappe di gamma BIEN 2.0 per 88.417 di specie vegetali distribuite in Nord e Sud America (Goldsmith et al., 2016). Il database BIEN integra le osservazioni standardizzate delle piante derivanti da campioni d’erbario e inventari delle aree di vegetazione. Le mappe dell’areale delle specie nei database BIEN sono state stimate utilizzando uno dei tre approcci, a seconda delle occorrenze disponibili per ogni specie. Per le specie con solo una o due occorrenze (circa il 35% delle specie), l’intervallo geografico è stato definito come un’area quadrata di 75.000 km2 che circonda ogni punto dati. Gli intervalli geografici per le specie con tre o quattro occorrenze sono stati identificati utilizzando una carena convessa (circa il 15% delle specie). Infine, le mappe di gamma per le specie con almeno cinque occorrenze sono state ottenute utilizzando l’algoritmo di modellazione della distribuzione delle specie Maxent, utilizzando 19 strati climatici come variabili predittive e 19 autovettori spaziali come filtri per vincolare le sovraprevisioni dei modelli (vedi Goldsmith et al, 2016 per ulteriori dettagli sulla metodologia delle mappe di gamma).
Abbiamo sovrapposto le mappe delle specie vegetali BIEN 2.0 su una mappa a griglia di 100 × 100 km con una proiezione Lambert Azimuthal Equal Area per ottenere una matrice di presenza/assenza di specie per ogni cella della griglia. Sulla base della classificazione dei biomi di Olson et al. (2001), abbiamo assegnato ogni cella della matrice a una delle categorie dei biomi. A causa delle limitazioni computazionali per le analisi successive, abbiamo unito alcuni biomi in base alle loro somiglianze nel clima e nella vegetazione e nella letteratura per ottenere una classificazione ampia come descritto nella Tabella 1 (escludendo Inland Water, Rock and Ice e Mangrovesci). Le ecoregioni Chaco e Caatinga sono state classificate come Xeric Woodlands e Dry forest, rispettivamente, seguendo Prado e Gibbs (1993), Pennington et al. (2000), Banda et al. (2016), Silva de Miranda et al. (2018).
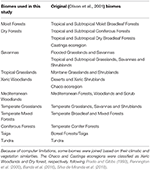
Tabella 1. Panoramica della classificazione dei biomi adottata in questo studio e l’equivalente (Olson et al., 2001) classificazione dei biomi (esclusi Inland Water, Rock and Ice, e Mangroves).
Species Composition Among Biomes
Per comprendere la variazione nello spazio dei tratti funzionali tra i biomi, abbiamo prima esplorato le differenze nella composizione delle specie vegetali tra loro. Sulla base della lista delle specie per ogni cella della griglia e bioma, abbiamo definito le specie caratteristiche di ogni bioma come quelle che hanno la proporzione massima della loro gamma in quel bioma. Queste liste di specie geograficamente predominanti in un dato bioma sono state confrontate con la lista di specie in altri biomi. Questo confronto a coppie fornisce un modo semplice per dedurre una sovrapposizione tassonomica direzionale tra i biomi (cioè, la proporzione di specie predominanti di un bioma condivisa con un altro bioma). Delle 88.417 specie con mappe di gamma disponibili, 44.899 specie hanno gamme che abbracciano più di un bioma, e 43.518 specie sono endemiche di un bioma specifico.
Dati sui tratti
Abbiamo estratto tutte le informazioni sui tratti per le specie vegetali del Nuovo Mondo disponibili nel dataset BIEN 3.0 (recuperato il 7 febbraio 2018) per un totale di 80.405 osservazioni di tratti a livello di specie. Abbiamo poi filtrato le informazioni per sei tratti funzionali: altezza massima della pianta (m), massa del seme (mg), densità del legno (mg/cm3), area specifica delle foglie SLA (cm2/g) e concentrazione di fosforo e azoto delle foglie per unità di massa (mg/g). Un totale di 18.192 osservazioni a livello di specie è rimasto dopo il filtraggio. Da queste, il sottoinsieme di 8.820 specie con entrambe le mappe di gamma e le informazioni sui tratti è stato utilizzato per ulteriori analisi.
Per stimare lo spazio funzionale dei tratti per ogni bioma, abbiamo richiesto dati completi sui tratti. Per questo motivo, abbiamo imputato filogeneticamente i dati mancanti dei tratti (Bruggeman et al., 2009; Penone et al., 2014; Swenson, 2014; Swenson et al., 2017) utilizzando il pacchetto R “Rphylopars” v 0.2.9 (Goolsby et al., 2017) e la filogenesi delle piante da seme recentemente pubblicata da Smith e Brown (2018) come base. L’imputazione filogenetica è uno strumento per prevedere i dati mancanti in serie di dati di tratti funzionali basati sul presupposto che le specie strettamente correlate tendono ad avere valori di tratti simili (Swenson, 2014). Abbiamo usato l’albero ALLBM (cioè, banca dei geni e Open Tree of life taxa con una spina dorsale fornita da Magallón et al., 2015) perché ha massimizzato la sovrapposizione tra le specie con informazioni disponibili sui tratti e sulla distribuzione. Dopo l’imputazione dei tratti, un totale di 7.842 specie con informazioni complete sui tratti e mappe di distribuzione è rimasto per ulteriori analisi.
Misurazione degli ipervolumi dei tratti
Abbiamo misurato la diversità funzionale relativa dei biomi calcolando gli ipervolumi dei tratti dai pool di specie all’interno delle celle dei biomi. A causa delle limitazioni di calcolo, abbiamo costruito gli ipervolumi dei tratti usando un campione casuale del 20% delle celle di ogni bioma. Gli ipervolumi per ogni cella della griglia sono stati stimati utilizzando i sei tratti funzionali estratti e il pacchetto R “hypervolume” (Blonder et al., 2014, 2018), utilizzando il metodo Gaussian KDE con lo stimatore di banda Silverman predefinito. La massa del seme, l’altezza e la densità del legno sono state trasformate in log, mentre lo SLA è stato trasformato con radice quadrata. Tutti i tratti sono stati scalati e centrati prima dell’analisi. Gli ipervolumi sono riportati in unità di deviazioni standard (sd) alla potenza del numero di tratti utilizzati (cioè, sd6).
Distinzione funzionale e diffusione
Poiché i biomi sono caratterizzati dalla loro vegetazione dominante, abbiamo anche esaminato la comunanza geografica e la distintività funzionale delle specie all’interno dei biomi. Utilizzando le mappe di gamma delle specie e le informazioni sui tratti funzionali, abbiamo stimato la distintività funzionale e la diffusione di ogni specie in ogni bioma, seguendo il quadro concettuale della rarità funzionale di Violle et al. (2017). Utilizzando l’intero set di tratti (misurati e imputati), abbiamo prima misurato la distanza euclidea nello spazio dei tratti standardizzati tra tutte le coppie di specie. Abbiamo poi calcolato la distintività funzionale (Di) per ogni specie in ogni bioma come la distanza funzionale media di una specie rispetto alle altre N specie all’interno del pool di specie del bioma. Di è stato scalato tra 0 e 1 all’interno di ogni bioma con valori più bassi che rappresentano specie che sono funzionalmente comuni (ridondanti) e valori più alti che rappresentano specie che sono funzionalmente distinte, rispetto alle altre specie nel bioma. Stimiamo anche la diffusione geografica (Wi) di una specie in un bioma, misurata come il numero di celle della griglia occupate dalla specie in un bioma rispetto al numero totale di celle in quel bioma. Un valore di 1 indica che la specie focale è presente in tutte le celle della griglia coperte dal bioma. Sia la distintività funzionale che la diffusione geografica sono state calcolate utilizzando il pacchetto R “funrar” (Grenié et al., 2017).
Poiché non abbiamo misure complete di dominanza basate sull’abbondanza locale o sulla biomassa, abbiamo usato le misure Di e Wi per identificare per ogni bioma le specie più “comuni” come quelle che sono sia geograficamente diffuse (Wi > 0,5) che funzionalmente simili (Di < 0,25). Quest’ultima soglia è stata utilizzata poiché il terzo quantile dei valori di distintività funzionale tra i biomi variava da 0,2 a 0,3. Per discriminare le specie funzionalmente distinte rispetto alle specie funzionalmente simili nelle analisi successive, abbiamo quindi utilizzato un valore di 0,25 come cut-off (cioè, le specie con valori di distintività < 0,25 sono state considerate comuni o ridondanti dal punto di vista funzionale all’interno di uno specifico bioma).
Similitudine dello spazio funzionale e del bioma
Per stimare la sovrapposizione tra gli ipervolumi dei biomi abbiamo utilizzato l’indice di similarità di Sørensen utilizzando (i) il numero totale di specie e (ii) la lista delle specie considerate come funzionalmente comuni e geograficamente diffuse per ogni bioma. La similarità dello spazio dei tratti funzionali è stata calcolata come sovrapposizione frazionata a coppie di ipervolumi tra i biomi. La sovrapposizione frazionaria è stata calcolata dividendo il doppio del volume dell’intersezione di due ipervolumi per il volume delle loro unioni. Tutti gli ipervolumi sono stati stimati utilizzando il pacchetto R “hypervolume” (Blonder et al.2014, 2018), utilizzando il metodo Gaussian KDE con lo stimatore di larghezza di banda Silverman predefinito.
Risultati
Abbiamo trovato una sostanziale sovrapposizione nella composizione delle specie vegetali tra i biomi, sulla base dell’intersezione delle gamme di specie modellate (vedi Figura 1, e Tabella 1 supplementare). Questa sovrapposizione tassonomica è maggiore nei biomi tropicali e temperati, con relativamente poche specie condivise tra queste due zone climatiche. È interessante notare che i boschi xerici condividono specie con entrambi i biomi tropicali e temperati. Nonostante l’alta percentuale di specie caratteristiche della foresta umida tropicale (83%), questo bioma condivide anche un gran numero di specie con altri biomi tropicali come le foreste secche, le savane, i boschi xerici e le praterie tropicali. L’alta sovrapposizione tassonomica dei biomi temperati come le praterie temperate, i boschi mediterranei, la taiga e la tundra suggerisce il potenziale per una bassa distintività funzionale, con alcuni biomi temperati che rappresentano un sottoinsieme più povero dei biomi tropicali più ricchi di specie e con una grande varietà funzionale.
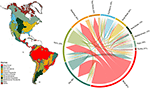
Figura 1. Sovrapposizione di specie vegetali tra i biomi del Nuovo Mondo. I valori percentuali esprimono la frazione di specie presenti in un bioma che hanno la maggior parte del loro range geografico in quel bioma, N = 84.413. La base di ogni freccia ramificata è posizionata in modo da mostrare il bioma che include la proporzione maggiore di una gamma di specie, mentre la larghezza rappresenta il numero di specie condivise con i biomi alle punte della freccia. Vedere la Tabella 1 supplementare per la matrice sottostante.
Con meno del 10% delle specie mappate rappresentate, i dati sui tratti erano piuttosto scarsi per i nostri assemblaggi di specie su scala biometrica (Figura 2A). Inoltre, i dati disponibili sui tratti variavano sostanzialmente tra tratti, cladi vegetali e biomi. Dal punto di vista filogenetico, la P delle foglie e la densità del legno erano particolarmente poco rappresentate, con interi cladi privi di dati disponibili. Di conseguenza, dei circa 2/3 dei valori dei tratti per le nostre 7.842 specie che dovevano essere imputati, molti dovevano essere assegnati in assenza di taxa strettamente correlati. Geograficamente, la SLA, l’altezza e la massa dei semi sono sottocampionate ai tropici e nel Sud America temperato, mentre l’N delle foglie e la densità del legno sono più uniformemente campionati tra le regioni. La P delle foglie è scarsamente campionata in tutti i biomi. Gli ipervolumi dei tratti creati dai pool di specie di una selezione casuale del 20% delle cellule per ogni bioma mostrano principalmente differenze tra i biomi tropicali e temperati/freddi (Figura 2B). Gli ipervolumi dei tratti tendono ad essere più grandi e più variabili nei biomi tropicali, con la più alta variazione nelle foreste tropicali umide e secche. Tra i biomi temperati/freddi, le foreste di conifere e le foreste miste temperate supportano gli ipervolumi dei tratti più grandi. È interessante notare che gli arbusteti xerici mostrano una distribuzione di ipervolumi più simile ai biomi tropicali che a quelli temperati.
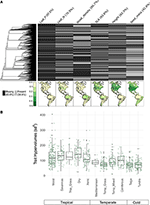
Figura 2. (A) Proporzione di specie nel database BIEN 3.0 con valori di tratti noti (grigio) o mancanti (nero). La filogenesi a sinistra corrisponde all’albero ALLBM delle piante da seme da Smith e Brown (2018) (cioè, GenBank e Open Tree of life taxa con una spina dorsale fornita da Magallón et al., 2015). Le mappe rappresentano la proporzione di specie con informazioni sui tratti rispetto al numero totale di specie nel database BIEN 2.0. (B) Distribuzione dei tratti ipervolumi del 20% delle celle 100 × 100 km selezionate a caso in ogni bioma. Gli ipervolumi sono riportati in unità di deviazioni standard alla potenza del numero di tratti utilizzati.
La relazione tra distintività funzionale e distribuzione geografica è notevolmente simile tra i biomi (Figura 3). In ogni bioma, la stragrande maggioranza delle specie sono sia geograficamente limitate che funzionalmente simili. Allo stesso tempo, le specie più distintive dal punto di vista funzionale all’interno di ogni bioma erano generalmente ristrette anche geograficamente, e le specie più diffuse geograficamente erano quasi sempre simili dal punto di vista funzionale.
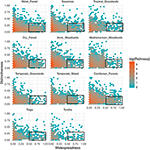
Figura 3. Modelli di distintività funzionale attraverso i biomi. La distintività rappresenta come le specie sono funzionalmente distanti l’una dall’altra all’interno di un bioma (cioè, la distanza fenotipica media a coppie da una specie focale a tutte le altre). Più grande è il valore, più distante è una specie dal centroide dello spazio funzionale del bioma. La diffusione misura quanto una specie sia geograficamente comune all’interno di un bioma. Un valore di 0 indica che una specie è presente in una sola cella del bioma. I valori di bin sono il numero di specie su una scala loge. I rettangoli rappresentano le specie considerate funzionalmente simili e diffuse in ogni bioma usando valori di cut-off di 0,25 e 0,5 di distintività e diffusione, rispettivamente.
Abbiamo trovato una notevole variazione nella distribuzione proporzionale delle forme di crescita all’interno e tra i biomi. Le specie legnose rappresentano le forme di crescita dominanti nei biomi tropicali in termini di numero di specie, mentre le specie erbacee dominano negli ambienti temperati (Figura 4). Quando abbiamo considerato solo quelle specie che sono diffuse e funzionalmente comuni in ogni bioma, la distribuzione delle forme di crescita tra i biomi è cambiata, specialmente nella proporzione di alberi, erbe ed erbe. Per esempio, nei biomi tropicali, la proporzione di alberi è diminuita in ogni bioma tranne che nella foresta umida. Nei biomi temperati, la proporzione di erbe è aumentata, specialmente verso le regioni polari. È interessante notare che la distribuzione delle forme di crescita nelle foreste xeriche assomiglia più da vicino alla distribuzione nei biomi temperati quando si considerano solo le specie diffuse e funzionalmente comuni.
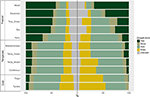
Figura 4. Distribuzione delle forme di crescita in ogni bioma (a sinistra) usando il numero totale di specie, e (a destra) usando solo quelle specie che sono funzionalmente simili e diffuse all’interno del bioma (vedi Figura 3).
I confronti a coppie della composizione delle specie tra i biomi rivelano tre gruppi principali che rappresentano le zone climatiche tropicali, temperate e polari (Figura 5A), riflettendo l’alta sovrapposizione tassonomica all’interno, ma non tra, queste regioni (Figura 1). I confronti a coppie degli ipervolumi dei tratti tra i biomi mostrano un clustering meno chiaro delle zone climatiche (Figura 5B). In questo caso, lo spazio funzionale dei boschi xerici si sovrappone significativamente ai biomi temperati. Questa analisi rivela anche la sovrapposizione nello spazio funzionale delle taiga con le praterie temperate e le foreste miste. Il confronto a coppie degli ipervolumi dei tratti tra i biomi utilizzando solo le specie considerate come funzionalmente comuni e diffuse mostra una minore sovrapposizione degli spazi dei tratti tra e all’interno delle zone climatiche (Figura 5C). Tuttavia, anche se i boschi xerici sono ora raggruppati con il resto dei biomi tropicali, questi habitat insieme alle praterie tropicali mostrano una grande sovrapposizione nello spazio funzionale con i biomi temperati come i boschi mediterranei e le praterie temperate.
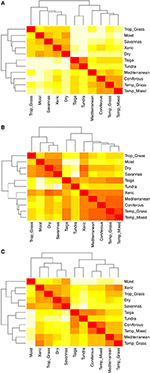
Figura 5. (A) Dissimilarità a coppie nella composizione delle specie tra i biomi. (B) Dissimilarità a coppie negli ipervolumi dei tratti (similarità 1-Sørensen) tra i biomi usando il numero totale di specie. (C) Dissimilarità a coppie negli ipervolumi dei tratti (similarità 1-Sørensen) tra i biomi usando solo le specie considerate funzionalmente simili e diffuse. Più chiara è la cella, maggiore è la dissimilarità.
Discussione
Le nostre analisi producono tre importanti intuizioni per comprendere i biomi terrestri attraverso una lente funzionale. In primo luogo, mostriamo che nonostante i progressi nella compilazione e nella sintesi dei dati primari sulla biodiversità, persistono significative carenze di conoscenza che possono limitare la nostra capacità di quantificare la biodiversità funzionale dei biomi su scala continentale e globale. In secondo luogo, le nostre analisi dei dati disponibili mostrano tuttavia che tutti i biomi del Nord e Sud America condividono un notevole modello comune in cui le specie geograficamente più diffuse in ogni bioma tendono a condividere tratti funzionali comuni, mentre le specie più distintive dal punto di vista funzionale sono invariabilmente limitate nella loro distribuzione. In terzo luogo, quando si considerano solo le specie diffuse e funzionalmente comuni, i biomi possono essere più facilmente distinti dal punto di vista funzionale, e i modelli di dissimiglianza tra i biomi sembrano riflettere una corrispondenza tra clima e spazio di nicchia funzionale delle piante. Presi insieme, i nostri risultati suggeriscono che, mentre lo studio della diversità funzionale dei biomi è ancora nelle sue fasi formative, l’ulteriore sviluppo del campo produrrà probabilmente intuizioni che collegano l’evoluzione, la biogeografia, l’assemblaggio della comunità e la funzione dell’ecosistema.
Carenze di conoscenza
Il database BIEN è specificamente progettato per colmare le lacune nella nostra conoscenza della biodiversità vegetale, ma come Hortal et al. (2015) sottolineano, le lacune di conoscenza interagenti portano a incertezza nella quantificazione della biodiversità alle scale più grandi. Per esempio, non solo meno del 10% delle nostre specie mappate aveva sia dati sui tratti che informazioni filogenetiche disponibili, ma i dati mancanti sui tratti (~66% dei valori dei tratti delle specie) erano abbastanza strutturati, sia filogeneticamente che geograficamente. Così, la carenza raunkeriana di dati sui tratti funzionali (sensu Hortal et al., 2015) interagisce con la carenza wallaceana di informazioni distributive e la carenza darwiniana di comprensione filogenetica. E mentre possiamo usare la conoscenza filogenetica per imputare ragionevolmente quei valori mancanti (Swenson et al., 2017), diversi aspetti dei modelli risultanti che sono importanti per la classificazione dei biomi rimangono incerti. Per esempio, i dati esistenti sulla forma di crescita suggeriscono che le specie legnose dominano in tutti i biomi tropicali, mentre la diversità proporzionale delle forme di crescita erbacee è molto più alta nei biomi temperati e polari (vedi anche Engemann et al., 2016; Zanne et al., 2018). Questo aumento latitudinale nella diversità relativa delle piante erbacee riflette le distorsioni di campionamento e una mancanza di conoscenza tassonomica delle piante erbacee tropicali, o riflette le diverse storie evolutive e biogeografiche nei regni Nearctic e Neotropicale? Le forme di crescita dominanti sono una delle caratteristiche distintive chiave dei biomi, quindi i cambiamenti sistematici nelle forme di crescita più diverse (dominanti o meno) influenzeranno necessariamente le nostre previsioni su come la diversità funzionale potrebbe cambiare nei biomi, e come questi cambiamenti influenzeranno la funzione e i servizi dell’ecosistema.
Abbiamo usato le mappe di distribuzione delle specie come dati di input principalmente per superare l’innegabile problema della distorsione del campionamento che è caratteristica dei dataset compilati da più fonti (vedi Figura 1 supplementare). Tuttavia, le mappe di areale tratte da modelli di distribuzione delle specie potrebbero rappresentare un ulteriore elemento di incertezza nei nostri risultati. Per esempio, data la risoluzione geografica di questo studio e la complessità spaziale di alcuni biomi, questi modelli potrebbero aver sovrastimato l’estensione geografica di alcune specie dalle celle di un singolo bioma alle celle di quelli vicini e interdigitati. L’utilizzo dei dati di occorrenza non ha cambiato i risultati generali di questo studio (vedi figure supplementari 2-6); tuttavia, una leggera diminuzione della sovrapposizione funzionale tra i biomi potrebbe effettivamente rivelare una sovrastima di alcune gamme di specie (vedi figure supplementari 2, 5 e 6). L’utilizzo di informazioni di occorrenza ha anche cambiato le relazioni generali tra la distintività funzionale e la diffusione nei nostri risultati, a causa del relativo sovracampionamento delle regioni temperate rispetto a quelle tropicali (vedi Figura supplementare 4). In questo caso, la nostra misura di diffusione è limitata dal campionamento estremamente limitato della maggior parte delle specie nei biomi tropicali. Con il miglioramento delle serie di dati e del campionamento, è probabile che ci sia spazio per ridurre queste incertezze in futuro.
L’altra lacuna di dati che deve essere affrontata per comprendere la diversità funzionale dei biomi è la carenza prestoniana di informazioni sull’abbondanza. L’abbondanza è particolarmente importante negli studi sulla diversità funzionale perché i tratti che contano di più per l’assemblaggio della comunità, il funzionamento dell’ecosistema e il ciclo biogeochimico sono quelli delle specie più dominanti. Poiché abbiamo basato i nostri assemblaggi su mappe di gamma derivate da modelli di distribuzione delle specie, abbiamo potuto affrontare solo la componente geografica della comunanza, ma la relazione positiva tra abbondanza locale e gamma geografica, la cosiddetta relazione occupazione-abbondanza, suggerisce che le specie più diffuse in ogni bioma possono spesso essere anche tra le più abbondanti (Borregaard e Rahbek, 2010; Novosolov et al., 2017). Poiché i biomi sono generalmente caratterizzati dalle forme di crescita dominanti nella regione, l’integrazione delle informazioni sull’abbondanza potrebbe portare a biomi che mostrano meno sovrapposizioni funzionali. Tuttavia, anche se BIEN ha compilato voluminosi dati di trama che consentono stime di abbondanza locale, fare confronti ragionevoli tra diverse regioni e forme di crescita è ostacolato da un campionamento non uniforme, differenze regionali nella diversità gamma e metodi incommensurati di quantificazione dell’abbondanza.
Schemi comuni all’interno dei biomi
Nonostante le persistenti lacune nei dati disponibili, le nostre analisi hanno scoperto una relazione precedentemente non documentata comune a tutti i biomi dell’emisfero occidentale: in qualsiasi bioma, le specie più diffuse tendono anche a mostrare una bassa distintività funzionale, mentre le specie funzionalmente più distintive sono quasi invariabilmente limitate nella loro distribuzione (Figura 3). Questa relazione “occupazione-ridondanza” può suggerire che le condizioni climatiche prevalenti all’interno di un bioma selezionano una serie di caratteristiche comuni, con specie funzionalmente più distintive limitate a un sottoinsieme più raro di habitat all’interno del bioma. La prevalenza complessiva di specie funzionalmente simili in tutti i biomi e la relazione “occupazione-ridondanza” sono entrambi coerenti con una recente analisi globale della diversità funzionale a livello di comunità che suggerisce che il filtraggio degli habitat porta alla coesistenza di specie funzionalmente simili (Li et al., 2018), così come gli studi che mostrano che le ridondanze funzionali aumentano la stabilità della comunità (ad esempio, Walker et al., 1999; Pillar et al., 2013). Inoltre, insieme all’alto grado di sovrapposizione sia tassonomica che funzionale tra i biomi (Figure 1, 5), il fatto che le specie comuni e diffuse siano funzionalmente simili rafforza la nozione che le piante terrestri attraverso una vasta gamma di condizioni ambientali condividono caratteristiche comuni vicino al nucleo dello spettro dei tratti funzionali (Wright et al., 2004; Díaz et al., 2016). A differenza di Umaña et al. (2017), i nostri risultati mostrano che le specie rare e geograficamente limitate possono o non possono essere funzionalmente distinte dalle specie più diffuse e comuni. Quindi, la questione rimane aperta se le specie più funzionalmente distintive sono specialisti in particolari ambienti o se le loro combinazioni di tratti risultano in trade-off demografici o fisiologici che limitano la loro distribuzione geografica.
Confronti tra i biomi
Il nostro confronto delle distribuzioni di ipervolume dei tratti attraverso i biomi (Figura 2B) è coerente con l’osservazione che ambienti più ricchi di specie sono anche più funzionalmente diversi (Swenson et al, 2012; Lamanna et al., 2014; Li et al., 2018; Šímová et al., 2018). I nostri risultati sono più equivoci riguardo all’ipotesi che gli ambienti climatici stagionali ed estremi limitino costantemente la diversità funzionale delle specie (de la Riva et al., 2018). Tutti i biomi tropicali mostrano una diversità funzionale media più alta di tutti i biomi temperati, e i biomi polari mostrano gli ipervolumi più piccoli. Tuttavia, all’interno di ciascun gruppo, i biomi più secchi o più variabili stagionalmente non sempre mostrano ipervolumi più piccoli (ad esempio, foreste secche, boschi xerici), come ci saremmo aspettati seguendo l’ipotesi di tolleranza di Currie et al. (2004), mentre le condizioni climatiche ottimali supportano più combinazioni di parametri fisiologici. Da questi risultati da soli non possiamo determinare se i biomi temperati e polari sono meno diversificati tassonomicamente a causa dei limiti dello spazio di nicchia funzionale, o se i loro ipervolumi funzionali sono piccoli perché non sono tassonomicamente diversi. Gli approcci di null-modeling potrebbero potenzialmente aiutare a distinguere la diversità tassonomica e funzionale (Swenson et al., 2012; Lamanna et al., 2014; Šímová et al., 2018), ma tale analisi era al di là dello scopo di questo studio. Ancora più importante, i nostri risultati rafforzano l’importanza di comprendere come la storia evolutiva e biogeografica plasmino la diversità funzionale dei biomi (Woodward et al., 2004; Pennington et al., 2006; Donoghue e Edwards, 2014; Moncrieff et al., 2016). L’ampia condivisione di specie (e lignaggi superiori) attraverso i biomi all’interno, ma in gran parte non tra, diversi regni biogeografici potrebbe servire sia per omogeneizzare la diversità funzionale all’interno dei regni e per fornire indizi circa i tratti caratteristici che sono selezionati per, o contro, i diversi ambienti (Douma et al, 2012; Zanne et al., 2014, 2018).
Nonostante la sostanziale sovrapposizione di ipervolume tra tutti i biomi (Figura supplementare 2), i biomi tropicali, temperati e freddi sembrano tutti occupare regioni distinguibili dello spazio funzionale (Figure 5B,C). I principali tratti che differenziano i biomi sembrano essere tratti relativi alle dimensioni complessive delle piante, tra cui sia l’altezza matura che la massa dei semi (Figure supplementari 7-10), piuttosto che tratti economici delle foglie, come osservato in analisi più locali, basate sui lotti (ad esempio, Douma et al., 2012). L’eccezione è la P fogliare, che ha mostrato differenze sostanziali tra i biomi tropicali e temperati/polari (Figure supplementari 7-10), un modello che è stato osservato in altre analisi basate sia su valori specifici della specie che su misure dell’intero ecosistema (Kerkhoff et al., 2005; Swenson et al., 2012). Poiché la P delle foglie era il nostro tratto più scarsamente campionato, le differenze tra i regni tropicali e temperati/polari potrebbero essere soggette a distorsioni dovute alla procedura di imputazione. Tuttavia, Leaf P mostra un significativo segnale filogenetico (Kerkhoff et al., 2006), il che suggerisce che le imputazioni non dovrebbero essere distorte (Swenson et al., 2017). Leaf P è anche significativamente più alto nelle forme di crescita erbacee (Kerkhoff et al., 2006), quindi lo spostamento latitudinale dalla diversità prevalentemente legnosa a quella erbacea (Figura 4) può anche influenzare questo modello.
Quando abbiamo limitato le analisi di ipervolume solo alle specie più diffuse e funzionalmente comuni in ogni bioma, i singoli biomi all’interno di ogni regno biogeografico si sono sovrapposti meno nello spazio del tratto funzionale (confrontare le figure 5B,C), suggerendo che queste specie possono riflettere fenotipi meglio adattati a particolari ambienti. In questo contesto, il bioma del bosco xerico è particolarmente interessante. In parte a causa dell’inclusione dell’ecoregione Chaco, i boschi xerici si raggruppano tassonomicamente con i biomi tropicali (Figura 5A). Ma quando si considerano gli ipervolumi funzionali di tutte le specie, essi mostrano una somiglianza molto più forte con i biomi temperati (Figura 5B). Infine, quando si analizzano solo le specie più diffuse e funzionalmente comuni, i boschi xerici mostrano di nuovo una maggiore somiglianza con i biomi tropicali, ma mantengono anche un’elevata somiglianza con le praterie temperate e i biomi mediterranei (Figura 5C). Le transizioni da ambienti caldi e mesici ad ambienti più freddi, secchi e stagionali sono facilitate da tratti simili, ad esempio l’abito erbaceo (Douma et al., 2012; Zanne et al., 2014, 2018), e come gli ambienti più freddi, le comunità in ambienti secchi tendono anche ad essere più filogeneticamente raggruppate (Qian e Sandel, 2017). Inoltre, la posizione delle zone xeriche al confine della zona di convergenza intertropicale le rende una transizione geografica tra il regno tropicale e quello temperato. Il fatto che i boschi xerici siano intermedi tra il regno tropicale e quello temperato sia funzionalmente che biogeograficamente rafforza ulteriormente l’idea che per comprendere meglio la diversità funzionale dei biomi dobbiamo prendere in considerazione le loro storie biogeografiche e filogenetiche (Pennington et al., 2006; Donoghue e Edwards, 2014; Moncrieff et al, 2016).
Conclusioni
Ogni classificazione dei biomi terrestri impone un piccolo numero di categorie discrete su gradienti continui nel clima e nelle distribuzioni delle specie, e rappresenta quindi una grossolana semplificazione del complesso paesaggio ecologico (Moncrieff et al., 2016, ma vedi Silva de Miranda et al., 2018). Eppure, nonostante il loro potenziale di eccessiva semplificazione, i biomi sono costrutti utili per organizzare e comprendere la biodiversità e il funzionamento dei principali ecosistemi terrestri, e gli approcci basati sui tratti hanno un alto potenziale per aiutare a modellare dinamicamente le distribuzioni globali della vegetazione.
In questo studio abbiamo dimostrato che gran parte della diversità tassonomica di tutti i biomi rappresenta specie che sono sia strettamente distribuite che funzionalmente simili. Inoltre, all’interno dei biomi, le specie funzionalmente più distintive in ogni bioma tendono anche ad essere geograficamente rare, mentre le specie diffuse mostrano uniformemente una bassa distintività funzionale. Nonostante l’ampia sovrapposizione tassonomica e funzionale tra i biomi, essi si raggruppano in unità distinguibili, biogeograficamente e climaticamente distinte, specialmente quando il raggruppamento funzionale si basa sulle specie più diffuse e funzionalmente comuni in ogni bioma. Tuttavia, avanzare una comprensione funzionale dei biomi richiederà non solo una migliore caratterizzazione della variazione dei tratti all’interno e tra i tipi di vegetazione, ma anche informazioni sulla storia biogeografica e filogenetica degli assemblaggi di specie e sull’abbondanza relativa delle specie all’interno dei biomi.
Data Availability
I set di dati dei tratti e le mappe di gamma delle specie analizzati per questo studio possono essere scaricati attraverso il pacchetto R BIEN (Maitner et al., 2018). Vedi http://bien.nceas.ucsb.edu/bien/ per maggiori dettagli sul database BIEN.
Contributi degli autori
SE-L, AK, BJE, DMN, e CV hanno progettato lo studio; SE-L e AK hanno analizzato i dati; SE-L e AK hanno scritto la prima versione del manoscritto; CV, BB, NK, BSM, BM, RKP, BS, SS, J-CS, e SKW hanno contribuito alla collazione e alla creazione del database di tratti e mappe di gamma. Tutti gli autori hanno contribuito allo sviluppo e alla stesura del manoscritto.
Finanziamento
SE-L, DMN e AK sono stati sostenuti da una borsa di ricerca collaborativa della US National Science Foundation (DEB-1556651). BJE è stato sostenuto dal premio della National Science Foundation DEB-1457812 e Macrosystems-1065861. CV è stato sostenuto dal Consiglio europeo della ricerca (Grant ERC-StG-2014-639706-CONSTRAINTS) e dalla Fondazione francese per la ricerca sulla biodiversità (FRB; www.fondationbiodiversite.fr) nel contesto del progetto CESAB Cause e conseguenze della rarità funzionale dalla scala locale a quella globale. J-CS considera questo lavoro un contributo al suo progetto VILLUM Investigator Biodiversity Dynamics in a Changing World finanziato da VILLUM FONDEN (grant 16549). SKW è stato supportato dallo Strategic Science Investment Fund del New Zealand Ministry of Business, Innovation and Employment’s Science and Innovation Group.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Acknowledgments
Ringraziamo Dan Griffith e due revisori per le loro critiche costruttive che hanno notevolmente migliorato questo manoscritto. Ringraziamo anche tutti i collaboratori dei dati BIEN (vedi http://bien.nceas.ucsb.edu/bien/data-contributors/ per una lista completa).
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fevo.2018.00219/full#supplementary-material
Banda, R.K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D., et al. (2016). Modelli di diversità vegetale nelle foreste secche neotropicali e le loro implicazioni di conservazione. Scienza 353, 1383-1387. doi: 10.1126/science.aaf5080
PubMed Abstract | CrossRef Full Text | Google Scholar
Blonder, B., Lamanna, C., Violle, C., e Enquist, B. J. (2014). L’ipervolume n-dimensionale. Glob. Ecol. Biogeogr. 23, 595-609. doi: 10.1111/geb.12146
CrossRef Full Text | Google Scholar
Blonder, B., Morrow, C. B., Maitner, B., Harris, D. J., Lamanna, C., Violle, C., et al. (2018). Nuovi approcci per delineare ipervolumi n-dimensionali. Metodi Ecol. Evol. 9, 305-319. doi: 10.1111/2041-210X.12865
CrossRef Full Text | Google Scholar
Bonan, G. B., Oleson, K. W., Fisher, R. A., Lasslop, G., e Reichstein, M. (2012). Riconciliazione dei tratti fisiologici delle foglie e dei dati di flusso della chioma: uso dei database TRY e FLUXNET nel Community Land Model versione 4. J. Geophys. Res. Biogeosci. 117:G02026. doi: 10.1029/2011JG001913
CrossRef Full Text | Google Scholar
Borregaard, M. K., e Rahbek, C. (2010). Causalità del rapporto tra distribuzione geografica e abbondanza delle specie. Q. Rev. Biol. 85, 3-25. doi: 10.1086/650265
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruggeman, J., Heringa, J., and Brandt, B. W. (2009). PhyloPars: stima dei valori dei parametri mancanti usando la filogenesi. Nucleic Acids Res. 37, W179-W184. doi: 10.1093/nar/gkp370
PubMed Abstract | CrossRef Full Text | Google Scholar
Cadotte, M. W., Carscadden, K., and Mirotchnick, N. (2011). Oltre le specie: la diversità funzionale e il mantenimento dei processi e dei servizi ecologici. J. Appl. Ecol. 48, 1079-1087. doi: 10.1111/j.1365-2664.2011.02048.x
CrossRef Full Text | Google Scholar
Cornwell, W. K., Cornelissen, J. H., Amatangelo, K., Dorrepaal, E., Eviner, V. T., Godoy, O., et al. (2008). I tratti delle specie vegetali sono il controllo predominante sui tassi di decomposizione della lettiera nei biomi di tutto il mondo. Ecol. Lett. 11, 1065-1071. doi: 10.1111/j.1461-0248.2008.01219.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Craine, J. M. (2009). Strategie di risorse di piante selvatiche. New Jersey, NJ: Princeton University Press. doi: 10.1515/9781400830640
CrossRef Full Text | Google Scholar
Currie, D. J., Mittelbach, G. G., Cornell, H. V., Field, R., Guégan, J. F., Hawkins, B. A., et al. (2004). Previsioni e test di ipotesi basate sul clima sulla variazione su larga scala della ricchezza tassonomica. Ecol. Lett. 12, 1121-1134. doi: 10.1111/j.1461-0248.2004.00671.x
CrossRef Full Text | Google Scholar
de la Riva, E. G., Violle, C., Pérez-Ramos, I. M., Marañón, T., Navarro-Fernández, C. M., Olmo, M., et al. (2018). Un approccio multidimensionale tratto funzionale rivela l’impronta di stress ambientale in Mediterraneo Comunità legnose. Ecosystems 21, 248-262. doi: 10.1007/s10021-017-0147-7
CrossRef Full Text | Google Scholar
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S., Dray, S., et al. (2016). Lo spettro globale della forma e della funzione delle piante. Nature 529, 167-171. doi: 10.1038/nature16489
PubMed Abstract | CrossRef Full Text | Google Scholar
Díaz, S., Lavorel, S., de Bello, F., Quétier, F., Grigulis, K., e Robson, T. M. (2007). Incorporare gli effetti della diversità funzionale delle piante nelle valutazioni dei servizi ecosistemici. Proc. Natl. Acad. Sci. U.S.A 104, 20684-20689. doi: 10.1073/pnas.0704716104
PubMed Abstract | CrossRef Full Text | Google Scholar
Donoghue, M. J., and Edwards, E. J. (2014). Spostamenti di bioma ed evoluzione di nicchia nelle piante. Annu. Rev. Ecol. Evol. Syst. 45, 547-572. doi: 10.1146/annurev-ecolsys-120213-091905
CrossRef Full Text | Google Scholar
Douma, J. C., Aerts, R., Witte, J. P. M., Bekker, R. M., Kunzmann, D., Metselaar, K., et al. (2012). Una combinazione di tratti vegetali funzionalmente diversi fornisce un mezzo per prevedere quantitativamente un’ampia gamma di assemblaggi di specie nell’Europa nord-occidentale. Ecography 35, 364-373. doi: 10.1111/j.1600-0587.2011.07068.x
CrossRef Full Text | Google Scholar
Engemann, K., Sandel, B., Enquist, B. J., Jørgensen, P. M., Kraft, N., Marcuse-Kubitza, A., et al. (2016). Patterns and drivers of plant functional group dominance across the Western Hemisphere: a macroecological re-assessment based on a massive botanical dataset. Bot. J. Linn. Soc. 180, 141-160. doi: 10.1111/boj.12362
CrossRef Full Text | Google Scholar
Enquist, B. J., Condit, R., Peet, R., Thiers, B., and Schildhauer, M. (2016). Il botanical information and ecology network (BIEN): cyberinfrastruttura per una rete integrata di informazioni botaniche per studiare gli impatti ecologici del cambiamento climatico globale sulla biodiversità vegetale. PeerJ Prepr. 4:e2615v2. doi: 10.7287/peerj.preprints.2615v2
CrossRef Full Text | Google Scholar
Garnier, E., Cortez, J., Billès, G., Navas, M. L., Roumet, C., Debussche, M., et al. (2004). I marcatori funzionali delle piante catturano le proprietà dell’ecosistema durante la successione secondaria. Ecology 85, 2630-2637. doi: 10.1890/03-0799
CrossRef Full Text | Google Scholar
Goldsmith, G. R., Morueta-Holme, N., Sandel, B., Fitz, E. D., Fitz, S. D., Boyle, B., et al. (2016). Plant-O-Matic: una guida dinamica e mobile a tutte le piante delle Americhe. Metodi Ecol. Evol. 7, 960-965. doi: 10.1111/2041-210X.12548
CrossRef Full Text | Google Scholar
Goolsby, E. W., Bruggeman, J., and Ané, C. (2017). Rphylopars: metodi comparativi filogenetici multivariati veloci per dati mancanti e variazione within-specie. Metodi Ecol. Evol. 8, 22-27. doi: 10.1111/2041-210X.12612
CrossRef Full Text | Google Scholar
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F., and Violle, C. (2017). funrar: an R package to characterize functional rarity. Divers. Distrib. 23, 1365-1371. doi: 10.1111/ddi.12629
CrossRef Full Text | Google Scholar
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., and Ladle, R. J. (2015). Sette carenze che affliggono la conoscenza su larga scala della biodiversità. Annu. Rev. Ecol. Evol. Syst. 46, 523-549. doi: 10.1146/annurev-ecolsys-112414-054400
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Enquist, B. J., Elser, J. J., and Fagan, W. F. (2005). Allometria delle piante, stechiometria e dipendenza dalla temperatura della produttività primaria. Glob. Ecol. Biogeogr. 14, 585-598. doi: 10.1111/j.1466-822X.2005.00187.x
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Fagan, W. F., Elser, J. J., and Enquist, B. J. (2006). Variazione filogenetica e forma di crescita nella scala di azoto e fosforo nelle piante da seme. Am. Nat. 168, E103-E122. doi: 10.1086/507879
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraft, N. J., Valencia, R., e Ackerly, D. D. (2008). Tratti funzionali e di nicchia a base di assemblaggio comunità albero in una foresta amazzonica. Scienza 322, 580-582. doi: 10.1126/science.1160662
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamanna, C., Blonder, B., Violle, C., Kraft, N. J., Sandel, B., et al. Spazio tratto funzionale e il gradiente di diversità latitudinale. Proc. Natl. Acad. Sci. U.S.A. 111, 13745-13750. doi: 10.1073/pnas.1317722111
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavorel, S., e Garnier, E. (2002). Predire i cambiamenti nella composizione della comunità e nel funzionamento dell’ecosistema dai tratti delle piante: rivisitare il Santo Graal. Funct. Ecol. 16, 545-556. doi: 10.1046/j.1365-2435.2002.00664.x
CrossRef Full Text | Google Scholar
Lavorel, S., Grigulis, K., Lamarque, P., Colace, M.-P., Garden, D., Girel, J., et al. Utilizzando i tratti funzionali delle piante per capire la distribuzione del paesaggio di più servizi ecosistemici. J. Ecol. 99, 135-147. doi: 10.1111/j.1365-2745.2010.01753.x
CrossRef Full Text | Google Scholar
Li, Y., Shipley, B., Price, J. N., Dantas, V. de L., Tamme, R., Westoby, M., et al. (2018). Il filtraggio dell’habitat determina l’occupazione di nicchia funzionale delle comunità vegetali in tutto il mondo. J. Ecol. 106, 1001-1009. doi: 10.1111/1365-2745.12802
CrossRef Full Text | Google Scholar
Magallón, S., Gómez-Acevedo, S., Sánchez-Reyes, L. L., e Hernández-Hernández, T. (2015). Un albero temporale metacalibrato documenta l’aumento precoce della diversità filogenetica delle piante da fiore. New Phytol. 207, 437-453. doi: 10.1111/nph.13264
PubMed Abstract | CrossRef Full Text | Google Scholar
Maitner, B. S., Boyle, B., Casler, N., Condit, R., Donoghue, J., Durán, S. M., et al. (2018). Il pacchetto BIEN R: uno strumento per accedere al database di informazioni botaniche ed ecologia (BIEN). Metodi Ecol. Evol. 9, 373-379. doi: 10.1111/2041-210X.12861
CrossRef Full Text | Google Scholar
Moncrieff, G. R., Bond, W. J., and Higgins, S. I. (2016). Rivedere il concetto di bioma per la comprensione e la previsione degli impatti del cambiamento globale. J. Biogeogr. 43, 863-873. doi: 10.1111/jbi.12701
CrossRef Full Text | Google Scholar
Novosolov, M., Rodda, G. H., North, A. C., Butchart, S. H. M., Tallowin, O. J. S., Gainsbury, A. M., et al. (2017). Densità di popolazione-gamma relazione rivisitata. Glob. Ecol. Biogeogr. 26, 1088-1097. doi: 10.1111/geb.12617
CrossRef Full Text | Google Scholar
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C., et al. (2001). Terrestrial Ecoregions of the world: a new map of life on earth: una nuova mappa globale delle ecoregioni terrestri fornisce uno strumento innovativo per la conservazione della biodiversità. Bioscience 51, 933-938.doi: 10.1641/0006-3568(2001)0512.0.CO;2
CrossRef Full Text | Google Scholar
Pennington, R. T., Prado, D. E., and Pendry, C. A. (2000). Foreste stagionalmente secche neotropicali e cambiamenti quaternari della vegetazione. J. Biogeogr. 27, 261-273. doi: 10.1046/j.1365-2699.2000.00397.x
CrossRef Full Text | Google Scholar
Pennington, R. T., Richardson, J. E., and Lavin, M. (2006). Approfondimenti sulla costruzione storica di biomi ricchi di specie da filogenesi vegetali datate, teoria ecologica neutra e struttura filogenetica della comunità. New Phytol. 172, 605-616. doi: 10.1111/j.1469-8137.2006.01902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Penone, C., Davidson, A. D., Shoemaker, K. T., Di Marco, M., Rondinini, C., Brooks, T. M., et al. (2014). Imputazione dei dati mancanti in serie di dati di tratti di vita: quale approccio funziona meglio? Methods Ecol. Evol. 5, 961-970. doi: 10.1111/2041-210X.12232
CrossRef Full Text | Google Scholar
Pilastro, V. D., Blanco, C. C., Müller, S. C., Sosinski, E. E., Joner, F., e Duarte, L. D. S. (2013). Ridondanza funzionale e stabilità nelle comunità vegetali. J. Veg. Sci. 24, 963-974. doi: 10.1111/jvs.12047
CrossRef Full Text | Google Scholar
Prado, D. E., e Gibbs, P. E. (1993). Modelli di distribuzione delle specie nelle foreste secche stagionali del Sud America. Ann. Mo. Bot. Gard. 80, 902-927. doi: 10.2307/2399937
CrossRef Full Text | Google Scholar
Qian, H., and Sandel, B. (2017). Struttura filogenetica degli assemblaggi regionali di angiosperme attraverso gradienti latitudinali e climatici in Nord America. Glob. Ecol. Biogeogr. 26, 1258-1269. doi: 10.1111/geb.12634
CrossRef Full Text | Google Scholar
Reich, P. B., Wright, I. J., Cavender-Bares, J., Craine, J. M., Oleksyn, J., Westoby, M., et al. (2003). L’evoluzione della variazione funzionale delle piante: tratti, spettri e strategie. Int. J. Plant Sci. 164, S143-S164. doi: 10.1086/374368
CrossRef Full Text | Google Scholar
Silva de Miranda, P. L., Oliveira-Filho, A., Pennington, R. T., Neves, D. M., Baker, T. R., and Dexter, K. G. (2018). Utilizzando inventari di specie arboree per mappare i biomi e valutare le loro sovrapposizioni climatiche nel Sud America tropicale di pianura. Glob. Ecol. Biogeogr. 27, 899-912. doi: 10.1111/geb.12749
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Kraft, N. J. B., Storch, D., Svenning, J.-C., Boyle, B., et al. (2015). Spostamenti nelle medie dei tratti e nelle varianze negli assemblaggi di alberi nordamericani: i modelli di ricchezza delle specie sono vagamente legati allo spazio funzionale. Ecography 38, 649-658. doi: 10.1111/ecog.00867
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Svenning, J.-C., Kattge, J., Engemann, K., Sandel, B., et al. (2018). Modelli spaziali e relazioni climatiche dei principali tratti vegetali nel Nuovo Mondo differiscono tra specie legnose ed erbacee. J. Biogeogr. 45, 895-916. doi: 10.1111/jbi.13171
CrossRef Full Text | Google Scholar
Smith, S. A., e Beaulieu, J. M. (2009). Storia della vita influenza i tassi di evoluzione della nicchia climatica nelle piante da fiore. Proc. Biol. Sci. 276, 4345-4352. doi: 10.1098/rspb.2009.1176
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., e Brown, J. W. (2018). Costruire una filogenesi delle piante da seme ampiamente inclusiva. Am. J. Bot. 105, 302-314. doi: 10.1002/ajb2.1019
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., e Donoghue, M. J. (2008). Tassi di evoluzione molecolare sono legati alla storia della vita nelle piante da fiore. Scienza 322, 86-89. doi: 10.1126/science.1163197
PubMed Abstract | CrossRef Full Text | Google Scholar
Swenson, N. G. (2014). Imputazione filogenetica di database di tratti funzionali delle piante.Ecography 37, 105-110. doi: 10.1111/j.1600-0587.2013.00528.x
CrossRef Full Text
Swenson, N. G., Enquist, B. J., Pither, J., Kerkhoff, A. J., Boyle, B., Weiser, M. D., et al. (2012). La biogeografia e il filtraggio della diversità funzionale delle piante legnose in Nord e Sud America. Glob. Ecol. Biogeogr. 21, 798-808. doi: 10.1111/j.1466-8238.2011.00727.x
CrossRef Full Text | Google Scholar
Swenson, N. G., Weiser, M. D., Mao, L., Araújo, M. B., Diniz-Filho, J. A. F., Kollmann, J., et al. (2017). Filogenesi e la previsione della diversità funzionale dell’albero attraverso nuove impostazioni continentali. Glob. Ecol. Biogeogr. 26, 553-562. doi: 10.1111/geb.12559
CrossRef Full Text | Google Scholar
Umaña, M. N., Mi, X., Cao, M., Enquist, B. J., Hao, Z., Howe, R., et al. (2017). Il ruolo dell’unicità funzionale e dell’aggregazione spaziale nello spiegare la rarità negli alberi. Glob. Ecol. Biogeogr. 26, 777-786. doi: 10.1111/geb.12583
CrossRef Full Text | Google Scholar
van Bodegom, P. M., Douma, J. C., and Verheijen, L. M. (2014). Un approccio completamente basato sui tratti per modellare la distribuzione globale della vegetazione. Proc. Natl. Acad. Sci. U.S.A. 111, 13733-13738. doi: 10.1073/pnas.1304551110
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Reich, P. B., Pacala, S. W., Enquist, B. J., e Kattge, J. (2014). L’emergere e la promessa di biogeografia funzionale. Proc. Natl. Acad. Sci. U.S.A. 111, 13690-13696. doi: 10.1073/pnas.1415442111
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W., et al. (2017). Rarità funzionale: l’ecologia di outlier. Trends Ecol. Evol. 32, 356-367. doi: 10.1016/j.tree.2017.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, B., Kinzig, A., and Langridge, J. (1999). Diversità degli attributi delle piante, resilienza e funzione dell’ecosistema: la natura e il significato delle specie dominanti e minori. Ecosystems 2, 95-113. doi: 10.1007/s100219900062
CrossRef Full Text | Google Scholar
Westoby, M. (1998). Uno schema di strategia di ecologia vegetale per l’altezza delle foglie (LHS). Plant Soil 199, 213-227. doi: 10.1023/A:1004327224729
CrossRef Full Text | Google Scholar
Woodward, F. I., Lomas, M. R., and Kelly, C. K. (2004). Il clima globale e la distribuzione dei biomi vegetali. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 359, 1465-1476. doi: 10.1098/rstb.2004.1525
PubMed Abstract | CrossRef Full Text | Google Scholar
Wright, I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Baruch, Z., Bongers, F., et al. (2004). Lo spettro economico mondiale delle foglie. Natura 428, 821-827. doi: 10.1038/nature02403
PubMed Abstract | CrossRef Full Text | Google Scholar
Xia, J., Niu, S., Ciais, P., Janssens, I. A., Chen, J., Ammann, C., et al. (2015). Controllo congiunto della produttività primaria lorda terrestre dalla fenologia e fisiologia delle piante. Proc. Natl. Acad. Sci. U.S.A. 112, 2788-2793. doi: 10.1073/pnas.1413090112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Pearse, W. D., Cornwell, W. K., McGlinn, D. J., Wright, I. J., e Uyeda, J. C. (2018). Biogeografia funzionale delle angiosperme: la vita agli estremi. New Phytol. 218, 1697-1709. doi: 10.1111/nph.15114
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Tank, D. C., Cornwell, W. K., Eastman, J. M., Smith, S. A., FitzJohn, R. G., et al. (2014). Tre chiavi per la radiazione di angiosperme in ambienti di congelamento. Natura 506, 89-92. doi: 10.1038/nature12872
PubMed Abstract | CrossRef Full Text | Google Scholar