Introduzione
La sclerosi laterale amiotrofica (SLA) è una malattia progressiva caratterizzata dal coinvolgimento dei motoneuroni sia superiori che inferiori (UMNs e LMNs). Nella SLA, il deperimento muscolare colpisce preferenzialmente l’abduttore pollicis brevis (APB) e il primo interosseo dorsale, con relativa conservazione dell’abduttore digiti minimi (ADM). Questa caratteristica specifica della SLA è stata definita il segno della “mano divisa” (Wilbourn, 2000). In generale, l’entità della perdita di unità motorie è significativamente maggiore nell’APB che nell’ADM nei pazienti con SLA (Kuwabara et al., 1999). Sono stati proposti sia meccanismi corticali che periferici alla base dei diversi livelli di atrofia dei piccoli muscoli della mano nella SLA (Weber et al., 2000; Shibuya et al., 2013). I risultati degli studi di stimolazione magnetica transcranica hanno dimostrato che l’input corticomotoneuronale ai motoneuroni spinali che innervano il complesso thenar è più esteso nei partecipanti normali (Macdonell et al., 1999; Menon et al., 2014). Tale differenza di input potrebbe causare questi motoneuroni spinali a degenerare preferenzialmente nella SLA attraverso un meccanismo eccitotossico anterogrado trans-sinaptico. Le proiezioni corticomotoneuronali al complesso thenar sono preferenzialmente colpite nella SLA, il che suggerisce che la disfunzione corticomotoneuronale contribuisce al segno della mano divisa nella SLA (Weber et al., 2000). Studi sull’eccitabilità dei nervi periferici hanno suggerito che gli assoni dei motoneuroni che innervano l’APB sono ipereccitabili e soggetti a degenerazione nella SLA (Vucic e Kiernan, 2010; Shibuya et al., 2013). Tuttavia, ad oggi, ci sono pochi studi che hanno confrontato direttamente la disfunzione o eccitabilità dei motoneuroni che innervano la APB e ADM. L’onda F è una risposta tardiva e di bassa ampiezza che riflette l’attivazione antidromica dei motoneuroni (Pastore-Olmedo et al., 2009). Onde F può fornire una misura indipendente di eccitabilità motoneurone segmentale (Fisher, 1992; Milanov, 1992; Hachisuka et al., 2015). Lo scopo principale di questo studio è stato quello di esaminare le differenze di disfunzione tra i motoneuroni spinali che innervano l’APB e l’ADM nella SLA utilizzando le onde F.
Materiali e metodi
Partecipanti
Abbiamo studiato 40 pazienti con SLA sporadica e 20 partecipanti normali abbinati per età e sesso. Tutti i pazienti sono stati visti presso il Dipartimento di Neurologia del Peking Union Medical College Hospital tra agosto 2013 e giugno 2014. I pazienti affetti da SLA che soddisfacevano i criteri modificati di El Escorial per la SLA certa, probabile o probabile supportata dal laboratorio (Brooks et al., 2000) sono stati consecutivamente arruolati nello studio. Vari esami elettrofisiologici e caratteristiche cliniche, come l’età al momento dell’arruolamento e il tempo dall’inizio dei sintomi, sono stati analizzati in questi pazienti. Nessuna mutazione genetica era stata identificata in nessuno dei pazienti con SLA. Il coinvolgimento dell’UMN negli arti superiori era suggerito dalla presenza di clono, aumento del tono, riflessi tendinei vivaci e segni positivi di Hoffman. I pazienti affetti da SLA sono stati assegnati a due gruppi in base ai loro sintomi fisici. I pazienti del gruppo 1 (20 pazienti con SLA) avevano spreco e debolezza dei muscoli intrinseci della mano. I pazienti del gruppo 2 (20 pazienti con SLA) non presentavano spreco o debolezza dei muscoli intrinseci della mano e mostravano nessuna o lieve compromissione dei movimenti discreti delle dita. I dati per la mano più colpita sono stati analizzati per i pazienti SLA nel gruppo 1, mentre i dati per la mano più intatta sono stati analizzati per i pazienti SLA nel gruppo 2. I dati per la mano sinistra sono stati analizzati per i controlli normali (NC). I pazienti affetti da SLA sono stati classificati clinicamente utilizzando la ALS functional rating scale-revised (ALSFRS-R; Cedarbaum et al., 1999) e classificati in base al sito di insorgenza della malattia. Le caratteristiche elettrodiagnostiche di tutti i pazienti SLA erano coerenti con una degenerazione diffusa e progressiva delle cellule del corno anteriore. Al momento dell’indagine, nessuno dei pazienti stava assumendo riluzolo o altri farmaci antispastici. I partecipanti con sindrome del tunnel carpale o cubitale coincidente, basata sull’esame clinico e sugli studi di conduzione nervosa, sono stati esclusi. Tutti i soggetti hanno fornito il consenso informato scritto per partecipare all’indagine. Lo studio è stato approvato dal Comitato Etico di Ricerca Clinica del Peking Union Medical College Hospital (Pechino, Cina), e tutte le procedure sono state condotte in conformità alla Dichiarazione di Helsinki.
Studio della conduzione nervosa
I test elettrofisiologici sono stati eseguiti utilizzando un sistema di elettromiografia (EEG) Viking IV (Nicolet Biomedical, Madison, WI, USA). I potenziali d’azione muscolari composti (CMAP) sono stati registrati dai muscoli APB e ADM dopo la stimolazione del nervo mediano o ulnare al polso. La temperatura della pelle degli arti studiati è stata mantenuta a >32°C. Sono stati misurati la latenza motoria distale (DML), l’ampiezza CMAP da picco a picco, la velocità di conduzione motoria (MCV) e il rapporto di ampiezza ADM/APB CMAP.
Studio delle onde F
Tutti i soggetti erano supini e rilassati durante gli esperimenti. Le onde F dei nervi mediano e ulnare sono state registrate con elettrodi di superficie attaccati alla pelle sopra i muscoli APB e ADM. I nervi studiati sono stati stimolati consegnando 100 stimoli sovramassimali con una frequenza di 1 Hz in un sito che era 7 cm prossimale all’elettrodo attivo di registrazione con il catodo prossimale all’anodo. Un totale di 100 stimoli sono stati considerati appropriati per esplorare il pieno potenziale delle onde F (Fisher et al., 1994). Le impostazioni del filtro erano 20 Hz a 10 kHz, la velocità di scansione era 5 ms per divisione, e il guadagno amplificatore era 0.5 mV per divisione. A-onde, che sono stati definiti come identiche risposte tardive con latenze costanti che si è verificato in almeno 8 su 20 tracce, sono stati esclusi dallo studio delle onde F (Puksa et al., 2003). I seguenti parametri delle onde F sono stati analizzati: latenza minima, latenza media, latenza massima, persistenza delle onde F, ampiezza media, rapporto medio di ampiezza F/M e numero di onde F ripetute. L’ampiezza da picco a picco di un’onda F è stata misurata se l’ampiezza era almeno 40 μV. Il rapporto di ampiezza media F / M è stato calcolato dividendo l’ampiezza media delle onde F per la corrispondente ampiezza massima CMAP. Un neurone ripetente (RN) era un neurone che ha dato luogo ad una serie di F-onde con identiche latenze, ampiezze e forme, e queste F-onde sono state definite come ripetitore F-onde. RNs e ripetitore F-onde sono stati rilevati tramite ispezione visiva e sono stati sovrapposti manualmente sulle altre onde F ripetitore. Le onde F ripetute sono state misurate utilizzando i seguenti indici: indice RN = 100 × numero di RN/numero di tracce con diverse forme di onde F in una serie di 100 stimoli; indice onde F ripetute (Freps) = 100 × numero di onde F ripetute/numero totale di tracce con onde F nello stesso nervo (Chroni et al., 2012).
Analisi statistiche
Il test di Shapiro-Wilk è stato utilizzato per valutare la normalità dei dati. Quando il valore P nell’analisi della varianza ha raggiunto la significatività, è stato eseguito il test di Student-Newman-Keuls. Il test t a campione indipendente è stato utilizzato per valutare le differenze tra due gruppi. Per i dati non parametrici, i confronti tra i gruppi sono stati eseguiti utilizzando il test di Kruskal-Wallis H. Una volta rifiutata l’ipotesi nulla, i confronti a coppie dei gruppi sono stati testati utilizzando il test U di Mann-Whitney e la correzione di Bonferroni con un livello di significatività di P < 0,017. Le differenze nelle variabili categoriche sono state esaminate con il test Chi-quadro. La significatività statistica è stata fissata a P < 0,05. SPSS per Windows, versione 21.0 (SPSS, Inc., Chicago, IL, USA), è stato utilizzato per eseguire le analisi statistiche.
Risultati
I profili clinici dei pazienti SLA e dei partecipanti NC sono riassunti nella tabella 1. Tutti i pazienti SLA erano clinicamente LMN-predominanti. L’età al momento dell’esame, il rapporto tra i sessi e l’altezza erano comparabili nei tre gruppi. Tra i pazienti affetti da SLA, la malattia insorta agli arti superiori rappresentava il 70% dei pazienti del gruppo 1 e il 25% dei pazienti del gruppo 2. C’erano 11 pazienti affetti da SLA nel gruppo 1 e 10 nel gruppo 2 con due regioni del corpo interessate, e c’erano 9 pazienti generalizzati nel gruppo 1 e 10 nel gruppo 2. La durata della malattia e i punteggi ALSFRS-R non differivano significativamente tra i pazienti di SLA nei gruppi 1 e 2.

Tabella 1. Profili clinici dei partecipanti.
Tabella 2 mostra i risultati dello studio della conduzione nervosa per i pazienti SLA e i NC. Il rapporto di ampiezza ADM/APB CMAP era significativamente aumentato nei pazienti SLA del gruppo 1 rispetto al gruppo NC, che è stato osservato coerentemente con il segno della mano divisa nei pazienti SLA (Kuwabara et al., 2008). I risultati dello studio delle onde F per i pazienti SLA e i NC sono mostrati nella tabella 3. L’ampiezza media delle onde F per l’APB era significativamente più bassa nel gruppo 1 che nel gruppo 2, che erano comparabili tra il gruppo 2 e i NC. Le ampiezze medie delle onde F dell’ADM nei gruppi 1 e 2 erano significativamente aumentate rispetto a quelle dei NC. I rapporti di ampiezza F/M dell’APB e dell’ADM nel gruppo 1 erano significativamente più alti di quelli del gruppo 2 e dei NC, mentre il gruppo 2 e i NC hanno mostrato rapporti di ampiezza F/M simili. La persistenza dell’onda F dell’APB, che era significativamente più bassa nei pazienti SLA che nei NC, era comparabile tra i gruppi 1 e 2. La persistenza dell’onda F dell’ADM era significativamente più bassa nel gruppo 1 che nel gruppo 2 e nei NC, mentre la persistenza dell’onda F dell’ADM era simile tra il gruppo 2 e i NC. L’indice RN e l’indice Freps dell’APB erano significativamente aumentati nei gruppi 1 e 2 rispetto ai NC, ma questi indici erano comparabili tra i gruppi 1 e 2. L’indice RN e l’indice Freps dell’ADM erano significativamente più alti nel gruppo 1 che nel gruppo 2 e nelle NC, mentre il gruppo 2 e le NC mostravano valori simili per questi indici. La figura 1 presenta esempi rappresentativi di tracce di onde F per i nervi mediano e ulnare registrati da pazienti SLA nei gruppi 1, 2 e NC.

Tabella 2. Risultati dello studio di conduzione nervosa.

Tabella 3. Studio delle onde F nei pazienti SLA e nei controlli normali.

Figura 1. Esempi rappresentativi di F-onde registrate dalla sclerosi laterale amiotrofica (SLA) i pazienti ei controlli normali (NCs). (A) F-onde registrate da un paziente SLA mano esibendo spreco e debolezza. Persistenza ridotta delle onde F e aumento del numero di onde F ripetute sono stati osservati sulle onde F registrate da entrambi i nervi mediano e ulnare. (B) F-onde registrate da un paziente SLA mano mancanza di spreco rilevabile o debolezza. La persistenza delle onde F era ridotta e il numero di onde F ripetute era aumentato sul nervo mediano, mentre i parametri delle onde F registrate dal nervo ulnare erano relativamente normali. (C) Onde F registrate da un soggetto sano sull’arto superiore sinistro. Ampiezze delle onde F, latenze e forme d’onda erano variabili, e la persistenza delle onde F era normale su entrambi i nervi mediano e ulnare. Le lettere a destra della registrazione identificano le onde F ripetute sulla base di ampiezza, latenza e forma d’onda. Le calibrazioni sono 0,5 mV e 5 ms per la registrazione dell’onda F.
La tabella 4 mostra la performance diagnostica dell’onda F nella SLA rispetto ai NC. L’onda F potrebbe essere usata per aiutare a differenziare i pazienti SLA dai NC. L’indice RN e l’indice Freps dell’APB sembravano essere variabili affidabili per differenziare i pazienti SLA dai NC, poiché l’area sotto la curva (AUC) per l’indice RN (0,998, 95% intervallo di confidenza (CI) 0,937-1,000) e l’indice Freps (1,000, 95% CI 0,940-1,000) mostravano un’utilità diagnostica “molto buona”. Le altre variabili delle onde F avevano valori AUC più bassi rispetto all’indice RN e all’indice Freps dell’APB e quindi mostravano una minore utilità diagnostica. Il rapporto di ampiezza ADM/APB CMAP ha mostrato un AUC di 0,766 (95% CI 0,638-0,865, P < 0,001) e potrebbe moderatamente differenziare i pazienti SLA dai NC. Utilizzando un valore di cut-off di ADM/APB > 1,7 (Kim et al., 2015) per la diagnosi di SLA ha prodotto una sensibilità moderata (52,5%) e un’elevata specificità (85,0%) rispetto ai controlli. La persistenza dell’onda F (P = 0,002), l’indice RN (P < 0,001) e l’indice Freps (P < 0,001) nell’APB sembravano differenziare i pazienti SLA dai NC più robustamente del rapporto di ampiezza ADM/APB CMAP.
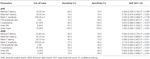
Tabella 4. Prestazioni diagnostiche delle onde F nella sclerosi laterale amiotrofica (SLA) rispetto ai controlli normali (NC).
Discussione
Lo scopo principale di questo studio è stato quello di utilizzare le misure delle onde F per accertare le differenze di disfunzione tra motoneuroni APB e ADM nei pazienti con SLA. Secondo un sistema di stadiazione proposto per la SLA (Roche et al., 2012), gli stadi della malattia erano comparabili tra i gruppi 1 e 2. La differenza nella percentuale di insorgenza dell’arto superiore tra i gruppi 1 e 2 può essere alla base di un diverso modello di progressione della malattia tra i due gruppi. Il numero stimato di unità motorie e le ampiezze CMAP sono parametri utili per valutare la perdita di motoneuroni, mentre l’onda F può essere una sonda diretta di disfunzione o instabilità nelle cellule del corno anteriore (Hachisuka et al., 2015). La persistenza dell’onda F è legata al numero di LMN e all’eccitabilità dei motoneuroni (Schiller e Stalberg, 1978; de Carvalho et al., 2002; Argyriou et al., 2006). I meccanismi proposti alla base delle onde F ripetitore sono un aumento dell’eccitabilità in particolari cellule del corno anteriore, una diminuzione dell’eccitabilità in alcuni motoneuroni, o la perdita di motoneuroni (Schiller e Stalberg, 1978; Petajan, 1985; Peioglou-Harmoussi et al., 1987; Hachisuka et al., 2015). Con la perdita dei motoneuroni, le onde F ripetute dai singoli motoneuroni possono essere riconosciute più facilmente; tuttavia, è stato sostenuto che la bassa frequenza di backfiring dei singoli motoneuroni rende il meccanismo piuttosto improbabile (Chroni et al., 2012). Fisiologicamente, c’erano differenze significative nella persistenza dell’onda F e nel numero di onde F ripetute tra l’APB e l’ADM. Questi risultati possono essere associati a un minor numero di motoneuroni funzionali che innervano l’APB (Gooch et al., 2014), o a una maggiore modulazione inibitoria corticale dell’APB (Menon et al., 2014).
Nella SLA, la disfunzione dei motoneuroni spinali si sviluppa gradualmente prima della comparsa di sintomi evidenti (Bradley, 1987). Nel presente studio, i pazienti affetti da SLA privi di deperimento o debolezza rilevabile nelle mani hanno mostrato una persistenza delle onde F significativamente ridotta e valori più elevati di indice RN e indice Freps per l’APB rispetto a quelli dei NC. Inoltre, questi pazienti SLA hanno mostrato valori di onde F relativamente normali nell’ADM. Questi dati sono coerenti con una disfunzione preferenziale dei motoneuroni spinali che innervano l’APB nella SLA (Baumann et al., 2012). Nella SLA, tuttavia, i motoneuroni spinali che innervano l’APB possono essere più attivi di quelli che innervano l’ADM, e l’ampiezza CMAP può non avere una sensibilità sufficiente per rilevare la perdita di motoneuroni perché i motoneuroni rimanenti possono fornire reinnervazione collaterale compensatoria delle fibre muscolari denervate (van Dijk et al., 2010). Analizzando le onde F, in particolare le onde F nei nervi mediani, potrebbe aiutare a rilevare sottili alterazioni delle cellule del corno anteriore anche in pazienti affetti da SLA senza sintomi clinici e quindi può fornire un approccio utile per valutare la progressione della malattia.
Il danno del MNM ha dimostrato di ridurre l’ampiezza delle onde F (Fisher, 1992). L’atrofia muscolare può portare ad una risposta muscolare più debole neutralizzando parzialmente l’ipereccitabilità del pool di motoneuroni (Drory et al., 1993). Nel presente studio, i pazienti con SLA che presentavano il segno della mano divisa hanno mostrato ampiezze delle onde F significativamente ridotte, una ridotta persistenza delle onde F e un maggior numero di onde F ripetute nell’APB rispetto all’ADM, il che riflette probabilmente un danno più grave ai motoneuroni spinali che innervano l’APB. La formazione di grandi unità motorie post-rinnervazione potrebbe contribuire ad aumentare l’ampiezza delle onde F (Drory et al., 2001). Un’ampiezza dell’onda F significativamente aumentata nell’ADM rispetto all’APB nei pazienti SLA è coerente con una perdita di motoneuroni più lenta nel pool di motoneuroni dell’ADM (Baumann et al., 2012). Il rapporto di ampiezza F/M quantifica la proporzione del pool di motoneuroni che si attiva durante una serie di onde F (Drory et al., 2001). Il rapporto di ampiezza F/M significativamente aumentato nella APB rispetto a quello nella ADM dei pazienti SLA riflette una maggiore tendenza dei motoneuroni che innervano la APB a generare onde F. Al contrario, la combinazione della diminuzione dell’ampiezza media delle onde F e l’aumento del rapporto di ampiezza F/M nella APB sottolinea il coinvolgimento preferenziale della APB nella SLA. Le onde F ripetute indicano cambiamenti patologici nelle unità motorie (Hachisuka et al., 2015). L’aumento significativo del numero di onde F ripetute nell’APB può implicare un maggior grado di ipereccitabilità all’interno dei motoneuroni spinali che innervano l’APB (Fang et al., 2015).
Intrigante, i pazienti SLA che non avevano atrofia muscolare della mano rilevabile hanno mostrato un’ampiezza media delle onde F per l’APB che era significativamente superiore a quella dei pazienti SLA che presentavano il segno della mano divisa. Tuttavia, l’ampiezza media delle onde F per l’ADM era comparabile tra i due gruppi di pazienti SLA, indipendentemente dall’atrofia del muscolo della mano, ma era significativamente più alta nei pazienti SLA che nei NC. Le differenze nelle caratteristiche delle onde F tra l’APB e l’ADM possono essere attribuite agli effetti concorrenti della degenerazione e della rigenerazione all’interno dell’unità motoria. Con la degenerazione dei motoneuroni, i motoneuroni superstiti compensano reinnervando le fibre muscolari denervate attraverso la germinazione assonale (Ibrahim e el-Abd, 1997). Nella SLA, il processo di denervazione può iniziare prima e progredire più rapidamente nella regione thenar. Il tasso di degenerazione era più lento nei motoneuroni che innervano l’ADM che in quelli che innervano l’APB. Ulteriori studi sono necessari per chiarire i meccanismi nella SLA che contribuiscono alle differenze nella disfunzione dei motoneuroni tra i motoneuroni che innervano l’APB e l’ADM. Sospettiamo che meccanismi corticali, meccanismi assonali periferici o disfunzioni segmentali spinali, in particolare nei circuiti inibitori spinali, possano contribuire alla degenerazione preferenziale dei motoneuroni spinali che innervano l’APB (Turner e Kiernan, 2012; Ramírez-Jarquín et al., 2014).
Ricerche precedenti hanno dimostrato che il segno della mano divisa è più frequentemente osservato nella SLA, e l’aumentato rapporto di ampiezza ADM/APB CMAP è quasi specifico della SLA. Il presente studio ha dimostrato che il criterio neurofisiologico per l’ADM/APB di un rapporto di ampiezza CMAP >1,7 (Kuwabara et al., 2008) ha una sensibilità moderata e un’alta specificità nel differenziare la SLA dai NC, che è coerente con studi precedenti (Kim et al., 2015). In questo studio, i parametri delle onde F potrebbero aiutare a differenziare in modo affidabile i pazienti SLA dai partecipanti normali. Inoltre, la persistenza delle onde F, l’indice RN e l’indice Freps nell’APB potrebbero differenziare in modo affidabile i pazienti SLA dai NC, poiché queste misure hanno mostrato valori AUC più grandi rispetto al rapporto di ampiezza ADM/APB CMAP.
La nostra analisi ha diversi limiti. Questo era uno studio trasversale e un numero relativamente piccolo di partecipanti è stato incluso. Uno studio di follow-up con una popolazione più ampia è necessario per determinare specificamente l’entità della disfunzione spinale associata al segno della mano divisa nella SLA. Un’altra potenziale limitazione è la mancanza di un gruppo di controllo costituito da pazienti con sindromi che imitano la SLA. Un tale gruppo sarebbe utile per valutare il valore clinico dell’onda F nel discriminare la SLA dai disturbi che imitano la SLA. Inoltre, ulteriori studi elettrofisiologici che utilizzano i metodi per valutare la disfunzione UMN, così come l’eccitabilità degli assoni motori, dovrebbero essere eseguiti sugli stessi gruppi di pazienti per fare più luce sulla fisiopatologia di questo fenomeno.
In conclusione, i nostri risultati dimostrano differenze nelle caratteristiche delle onde F tra l’APB e ADM nei pazienti con SLA. Queste alterazioni nelle onde F sono caratteristiche dei pazienti con SLA e possono essere utili per differenziare la SLA da alcuni disturbi che imitano la SLA. Chiarire i meccanismi fisiopatologici alla base dei diversi livelli di atrofia nei muscoli della mano piccola farebbe luce sulla patogenesi della SLA.
Contributi degli autori
JF e LC: ideato, eseguito e progettato gli esperimenti. JF, LC, ML e YG: analizzato i dati. ML, YG, XL, DL, BC, DS e QD: hanno contribuito con reagenti/materiali/strumenti di analisi. JF e LC: hanno contribuito alla stesura del manoscritto.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Vorremmo ringraziare i pazienti SLA e i volontari sani che hanno partecipato a questo studio.
Argyriou, A. A., Polychronopoulos, P., Talelli, P., e Chroni, E. (2006). Studio delle onde F nella sclerosi laterale amiotrofica: valutazione dell’equilibrio tra coinvolgimento del motoneurone superiore e inferiore. Clin. Neurophysiol. 117, 1260-1265. doi: 10.1016/j.clinph.2006.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baumann, F., Henderson, R. D., Gareth Ridall, P., Pettitt, A. N., and McCombe, P. A. (2012). Studi quantitativi della degenerazione del motoneurone inferiore nella sclerosi laterale amiotrofica: prove per il decadimento esponenziale del numero di unità motorie e il maggior tasso di perdita nel sito di insorgenza. Clin. Neurophysiol. 123, 2092-2098. doi: 10.1016/j.clinph.2012.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bradley, W. G. (1987). Punti di vista recenti sulla sclerosi laterale amiotrofica con particolare attenzione agli studi elettrofisiologici. Muscle Nerve 10, 490-502. doi: 10.1002/mus.880100603
PubMed Abstract | CrossRef Full Text | Google Scholar
Brooks, B. R., Miller, R. G., Swash, M., and Munsat, T. L. (2000). El escorial rivisitato criteri rivisti per la diagnosi di sclerosi laterale amiotrofica. Amyotroph. Sclerosi Laterale. Altro Motor Neuron Disord. 1, 293-299. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedarbaum, J. M., Stambler, N., Malta, E., Fuller, C., Hilt, D., Thurmond, B., et al. La ALSFRS-R una scala di valutazione funzionale ALS riveduta che incorpora valutazioni della funzione respiratoria. J. Neurol. Sci. 169, 13-21. doi: 10.1016/s0022-510x(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Chroni, E., Tendero, I. S., Punga, A. R., and Stålberg, E. (2012). Utilità della valutazione delle onde F ripetute negli studi di routine. Muscle Nerve 45, 477-485. doi: 10.1002/mus.22333
PubMed Abstract | CrossRef Full Text | Google Scholar
de Carvalho, M., Scotto, M., Lopes, A., e Swash, M. (2002). Onde F e la lesione corticospinale nella sclerosi laterale amiotrofica. Amyotroph. Sclerosi laterale. Other Motor Neuron Disord. 3, 131-136. doi: 10.1080/146608202760834139
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Kovach, I., and Groozman, G. B. (2001). Valutazione elettrofisiologica del coinvolgimento del motoneurone superiore nella sclerosi laterale amiotrofica. Amyotroph. Sclerosi Laterale. Other Motor Neuron Disord. 2, 147-152. doi: 10.1080/146608201753275616
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Neufeld, M. Y., and Korczyn, A. D. (1993). Caratteristiche delle onde F dopo leisioni acute e croniche del motoneurone superiore. Electromyogr. Clin. Neurophysiol. 33, 441-446.
PubMed Abstract | Google Scholar
Fang, J., Cui, L.-Y., Liu, M.-S., Guan, Y.-Z., Li, X.-G., Cui, B., et al. (2015). Studio delle onde F nella sclerosi laterale amiotrofica: valutazione della disfunzione motoneuronale segmentale. Chin. Med. J. 128, 1738-1742. doi: 10.4103/0366-6999.159346
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A. (1992). Riflessi H e onde F: fisiologia e indicazioni cliniche. Muscle Nerve 15, 1223-1233. doi: 10.1002/mus.880151102
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A., Hoffen, B., and Hultman, C. (1994). Valori normativi delle onde F e il numero di onde F registrate. Muscle Nerve 17, 1185-1189. doi: 10.1002/mus.880171009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gooch, C. L., Doherty, T. J., Chan, K. M., Bromberg, M. B., Lewis, R. A., Stashuk, D. W., et al. (2014). Stima del numero di unità motorie: una tecnologia e revisione della letteratura. Muscle Nerve 50, 884-893. doi: 10.1002/mus.24442
PubMed Abstract | CrossRef Full Text | Google Scholar
Hachisuka, A., Komori, T., Abe, T., e Hachisuka, K. (2015). Onde F ripetitore sono segni di patologia dell’unità motoria nei sopravvissuti alla polio. Muscle Nerve 51, 680-685. doi: 10.1002/mus.24428
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahim, I. K., e el-Abd, M. A. (1997). Ripetizione gigante dell’onda F in pazienti con disturbi delle cellule del corno anteriore. Ruolo della dimensione dell’unità motoria. Am. J. Phys. Med. Rehabil. 76, 281-287. doi: 10.1097/00002060-199707000-00006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J.-E., Hong, Y.-H., Lee, J.-H., Ahn, S.-W., Kim, S.-M., Park, K.-S., et al. (2015). Differenza di modello di atrofia muscolare della mano dissociata nella sclerosi laterale amiotrofica e varianti. Muscle Nerve 51, 333-337. doi: 10.1002/mus.24323
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Mizobuchi, K., Ogawara, K., e Hattori, T. (1999). Dissociato piccolo coinvolgimento muscolare della mano nella sclerosi laterale amiotrofica rilevato da stime di numero di unità motoria. Muscle Nerve 22, 870-873. doi: 10.1002/(sici)1097-4598(199907)22:7<870::aid-mus9>3.0.co;2-o
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Sonoo, M., Komori, T., Shimizu, T., Hirashima, F., Inaba, A., et al. (2008). Dissociata piccola atrofia muscolare della mano nella sclerosi laterale amiotrofica: frequenza, estensione e specificità. Muscle Nerve 37, 426-430. doi: 10.1002/mus.20949
PubMed Abstract | CrossRef Full Text | Google Scholar
Macdonell, R. A. L., Jackson, G. D., Curatolo, J. M., Abbott, D. F., Berkovic, S. F., Carey, L. M., et al. (1999). Localizzazione della corteccia motoria utilizzando la risonanza magnetica funzionale e la stimolazione magnetica transcranica. Neurology 53, 1462-1467. doi: 10.1212/wnl.53.7.1462
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, P., Kiernan, M. C., e Vucic, S. (2014). Differenze di eccitabilità corticale nei muscoli della mano seguono un modello di split-hand nei controlli sani. Muscle Nerve 49, 836-844. doi: 10.1002/mus.24072
PubMed Abstract | CrossRef Full Text | Google Scholar
Milanov, I. G. (1992). Onda F per la valutazione dell’eccitabilità segmentale del motoneurone. Electromyogr. Clin. Neurophysiol. 32, 11-15.
PubMed Abstract | Google Scholar
Pastore-Olmedo, C., Gonzáez, O., e Geijo-Barrientosc, E. (2009). Uno studio delle onde F in pazienti con radicolopatia lombosacrale unilaterale. Eur. J. Neurol. 16, 1233-1239. doi: 10.1111/j.1468-1331.2009.02764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Peioglou-Harmoussi, S., Fawcett, P. R. W., Howel, D., and Barwick, D. D. (1987). F-risposta frequenza nella malattia del motoneurone e spondilosi cervicale. J. Neurol. Neurosurg. Psychiatry 50, 593-599. doi: 10.1136/jnnp.50.5.593
PubMed Abstract | CrossRef Full Text | Google Scholar
Petajan, J. H. (1985). Onde F in atrofia neurogenica. Muscle Nerve 8, 690-696. doi: 10.1002/mus.880080811
PubMed Abstract | CrossRef Full Text | Google Scholar
Puksa, L., Stålberg, E., and Falck, B. (2003). Presenza di onde A in studi di onde F di nervi sani. Muscle Nerve 28, 626-629. doi: 10.1002/mus.10448
PubMed Abstract | CrossRef Full Text | Google Scholar
Ramírez-Jarquín, U. N., Lazo-Gómez, R., Tovar-y-Romo, L. B., e Tapia, R. (2014). Circuiti inibitori spinali e il loro ruolo nella degenerazione del motoneurone. Neuropharmacology 82, 101-107. doi: 10.1016/j.neuropharm.2013.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Roche, J. C., Rojas-Garcia, R., Scott, K. M., Scotton, W., Ellis, C. E., Burman, R., et al. Una proposta di sistema di stadiazione per la sclerosi laterale amiotrofica. Brain 135, 847-852. doi: 10.1093/brain/awr351
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, H. H., e Stalberg, E. (1978). Risposte F studiate con EMG a fibra singola in soggetti normali e pazienti spastici. J. Neurol. Neurosurg. Psychiatry 41, 45-53. doi: 10.1136/jnnp.41.1.45
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibuya, K., Misawa, S., Nasu, S., Sekiguchi, Y., Mitsuma, S., Beppu, M., et al. (2013). Sindrome della mano spaccata nella sclerosi laterale amiotrofica: diversi cambiamenti di eccitabilità negli assoni motore thenar e hypothenar. J. Neurol. Neurosurg. Psychiatry 84, 969-972. doi: 10.1136/jnnp-2012-304109
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, M. R., e Kiernan, M. C. (2012). La disfunzione interneuronale contribuisce alla neurodegenerazione nella sclerosi laterale amiotrofica. Amyotroph. Lateral Scler. 13, 245-250. doi: 10.3109/17482968.2011.636050
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dijk, J. P., Schelhaas, H. J., Van Schaik, I. N., Janssen, H. M. H. A., Stegeman, D. F., and Zwarts, M. J. (2010). Monitoraggio della progressione della malattia utilizzando la stima del numero di unità motorie ad alta densità nella sclerosi laterale amiotrofica. Muscle Nerve 42, 239-244. doi: 10.1002/mus.21680
PubMed Abstract | CrossRef Full Text | Google Scholar
Vucic, S., e Kiernan, M. C. (2010). L’aumento delle conduttanze di sodio persistente nella SLA familiare. J. Neurol. Neurosurg. Psychiatry 81, 222-227. doi: 10.1136/jnnp.2009.183079
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, M., Eisen, A., Stewart, H., e Hirota, N. (2000). La mano spaccata nella SLA ha una base corticale. J. Neurol. Sci. 180, 66-70. doi: 10.1016/s0022-510x(00)00430-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilbourn, A. J. (2000). La sindrome della mano divisa. Muscle Nerve 23:138. doi: 10.1002/(sici)1097-4598(200001)23:1<138::aid-mus22>3.0.co;2-7
PubMed Abstract | CrossRef Full Text | Google Scholar