Valutazione | Biopsicologia | Comparativa |Cognitiva | Sviluppo | Linguaggio | Differenze individuali |Personalità | Filosofia | Sociale |
Metodi | Statistica |Clinica | Educativa | Industriale |Voci professionali | Psicologia mondiale |
Biologico:Genetica comportamentale – Psicologia evolutiva – Neuroanatomia – Neurochimica – Neuroendocrinologia – Neuroscienze – Psiconeuroimmunologia – Psicologia fisiologica – Psicofarmacologia (Indice, Profilo)
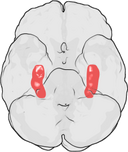
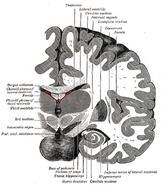
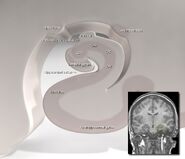
La posizione dell’ippocampo nel cervello umano.
Per l’omonima rivista, vedi Ippocampo (rivista)
L’ippocampo è una parte del proencefalo, situata nel lobo temporale mediale. Appartiene al sistema limbico e svolge ruoli importanti nella memoria a lungo termine e nella navigazione spaziale. Gli esseri umani e altri mammiferi hanno due ippocampi, uno in ogni lato del cervello. Nei roditori, dove è stato studiato più estesamente, l’ippocampo ha la forma di una banana. Negli esseri umani, ha una forma curva e convoluta che ricordava ai primi anatomisti un cavalluccio marino. Il nome, infatti, deriva dalla parola greca per cavallo marino (greco: hippos = cavallo, campos = mare).
Nella malattia di Alzheimer, l’ippocampo è una delle prime regioni del cervello a subire danni; problemi di memoria e disorientamento appaiono tra i primi sintomi. I danni all’ippocampo possono anche derivare dalla mancanza di ossigeno (anossia), dall’encefalite o dall’epilessia del lobo temporale mesiale. Le persone con danni estesi all’ippocampo possono sperimentare l’amnesia, cioè l’incapacità di formare o conservare nuovi ricordi.
- Funzioni dell’ippocampo
- Ruolo nella memoria
- Ruolo nella memoria spaziale e nella navigazione
- Ippocampo e depressione
- Storia
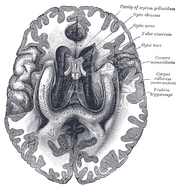
- Anatomia
- Fisiologia
- Il ritmo theta
- Onde taglienti
- Evoluzione
- Vedi anche
- Riferimenti & Bibliografia
- Testi chiave
- Libri
- Documenti
- Materiale aggiuntivo
- Documenti
- Immagini aggiuntive
Funzioni dell’ippocampo
Forse la prima idea fu che l’ippocampo è coinvolto nell’olfatto: questo sembra essere stato suggerito principalmente dalla sua posizione nel cervello, accanto alla corteccia olfattiva. Continua ad esserci un certo interesse per le risposte olfattive dell’ippocampo, ma quasi nessuno ora crede che la funzione primaria dell’ippocampo sia olfattiva.
Nel corso degli anni, tre idee principali sulla funzione dell’ippocampo hanno dominato la letteratura: inibizione, memoria e spazio. La teoria dell’inibizione comportamentale (caricaturalmente definita da O’Keefe e Nadel come “un passo indietro!”) è stata molto popolare fino agli anni ’60. Ha derivato gran parte della sua forza da due osservazioni: primo, gli animali con danni all’ippocampo tendono ad essere iperattivi; secondo, gli animali con danni all’ippocampo spesso hanno difficoltà ad imparare ad inibire le risposte che sono state precedentemente insegnate. Jeffrey Gray ha sviluppato questa linea di pensiero in una vera e propria teoria del ruolo dell’ippocampo nell’ansia. La teoria dell’inibizione non è, tuttavia, molto popolare al momento.
La seconda importante linea di pensiero mette in relazione l’ippocampo con la memoria. Anche se ha avuto dei precursori, questa idea ha derivato la sua forza principale da un rapporto molto noto di Scoville e Milner sui risultati della distruzione chirurgica dell’ippocampo (nel tentativo di alleviare le crisi epilettiche), in un paziente noto come H.M. Il risultato inaspettato era una grave amnesia: H.M. non era in grado di ricordare coscientemente gli eventi che si sono verificati dopo l’intervento o per diversi anni prima. Questo caso suscitò un tale interesse che oggi si dice che H.M. sia il caso medico più intensamente studiato nella storia. Negli anni successivi, sono stati studiati anche altri pazienti con livelli simili di danno all’ippocampo e amnesia (causati da incidenti o malattie), e letteralmente migliaia di esperimenti hanno studiato la fisiologia della plasticità neurale nell’ippocampo. C’è ormai un accordo quasi universale sul fatto che l’ippocampo svolge un ruolo importante nella memoria; tuttavia, la natura precisa di questo ruolo rimane ampiamente dibattuta.
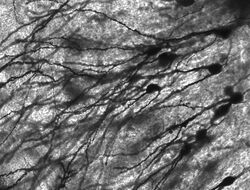
Neuroni macchiati di Golgi nell’ippocampo del roditore.
Ruolo nella memoria
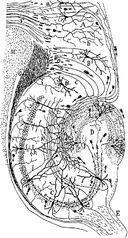
Disegno del circuito neurale dell’ippocampo del roditore. S. Ramón y Cajal, 1911.
Psicologi e neuroscienziati contestano il ruolo preciso dell’ippocampo, ma generalmente concordano sul fatto che ha un ruolo essenziale nella formazione di nuovi ricordi su eventi vissuti personalmente (memoria episodica o autobiografica). Alcuni ricercatori preferiscono considerare l’ippocampo come parte di un più grande sistema di memoria del lobo temporale mediale responsabile della memoria dichiarativa generale (ricordi che possono essere esplicitamente verbalizzati – questi includerebbero, per esempio, la memoria dei fatti oltre alla memoria episodica).
Articolo principale: Ruolo dell’ippocampo nella memoria
Alcune prove implicano l’ippocampo nella memorizzazione ed elaborazione delle informazioni spaziali. Studi sui ratti hanno dimostrato che i neuroni nell’ippocampo hanno campi di cottura spaziali. Queste cellule sono chiamate cellule di luogo. Alcune cellule sparano quando l’animale si trova in una particolare posizione, indipendentemente dalla direzione del viaggio, mentre la maggior parte sono almeno parzialmente sensibili alla direzione della testa e alla direzione del viaggio.
Articolo principale: Ruolo dell’ippocampo nella memoria spaziale e nella navigazione
Ippocampo e depressione
- La perdita di volume dell’ippocampo, forse riflettendo gli effetti dell’eccesso di glucocorticoidi sulla
neurogenesi è stata identificata in gruppi di persone depresse rispetto ai controlli.
Articolo principale: Depressione e ippocampo
Storia
L’anatomista Giulio Cesare Aranzi (circa 1564) usò per primo il termine ippocampo per descrivere l’organo cerebrale a causa della sua somiglianza visiva con un cavalluccio marino. Questo organo fu inizialmente collegato al senso dell’olfatto, piuttosto che alla sua nota funzione nell’acquisizione della memoria. Il russo Vladimir Bekhterev notò il ruolo dell’ippocampo nella memoria intorno al 1900, sulla base delle osservazioni di un paziente con profondi disturbi della memoria. Tuttavia, per molti anni, la visione convenzionale dell’ippocampo era che, come il resto del sistema limbico, era responsabile delle emozioni.
L’importanza dell’ippocampo nella memoria fu portata all’attenzione dei ricercatori dal paziente HM. HM soffriva di una serie di disturbi della memoria anterograda e retrograda temporalmente graduata (tali disturbi sono il soggetto del film Memento) in seguito alla rimozione bilaterale di varie strutture del lobo mediale-temporale (compresa l’ablazione bilaterale dei suoi ippocampi) per alleviare i frequenti attacchi epilettici. Di particolare importanza è che HM era ancora in grado di imparare compiti procedurali (che sono associati con lo striato) e aveva un QI superiore alla media. HM ha dimostrato una sorprendente dissociazione singola tra intelligenza e memoria dichiarativa. La dimensione relativa della formazione dell’ippocampo in relazione al volume totale del cervello è spesso conservata nella maggior parte delle specie di mammiferi. Tuttavia, è stato riscontrato che queste aree sono relativamente ipotrofiche nei cetacei.
Anatomia
Articolo principale: Anatomia dell’ippocampo
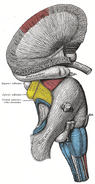
Ippocampo umano.
Sezione coronale colorata con Nissl del cervello di una scimmia macaco, che mostra l’ippocampo (cerchiato). Fonte: brainmaps.org
Anatomicamente, l’ippocampo è un’elaborazione del bordo della corteccia. Può essere distinto come una zona in cui la corteccia si restringe in un singolo strato di neuroni molto densi, che si arriccia in una stretta forma a S. Le strutture che fiancheggiano il bordo della corteccia costituiscono il cosiddetto sistema limbico (latino limbus = confine): queste comprendono l’ippocampo, la corteccia cingolata, la corteccia olfattiva e l’amigdala. Paul MacLean una volta suggerì, come parte della sua teoria del cervello trino, che le strutture limbiche comprendono la base neurale dell’emozione. La maggior parte dei neuroscienziati non crede più che il concetto di un “sistema limbico” unificato sia valido, però.
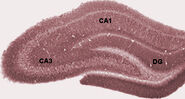
L’ippocampo, nel suo insieme, finisce per assomigliare a un tubo curvo, che è stato variamentealogato a un cavalluccio marino, o a un corno di montone (Cornu Ammonis), o a una banana.Questa disposizione generale vale per tutta la gamma di specie di mammiferi, dal riccio all’uomo, sebbene i dettagli varino. Nel ratto, i due ippocampi assomigliano sorprendentemente a una coppia di banane, unite al gambo. Nei cervelli umani o di scimmia, la porzione dell’ippocampo in basso, vicino alla base del lobo temporale, è molto più larga della parte in alto. Una delle conseguenze di questa complessa geometria è che le sezioni trasversali attraverso l’ippocampo possono mostrare una sconcertante varietà di forme, a seconda dell’angolo e della posizione del taglio.
Le connessioni più forti dell’ippocampo sono con la corteccia entorinale (CE), che si trova accanto ad essa nel lobo temporale. Gli strati superficiali della CE forniscono gli input più numerosi all’ippocampo, e gli strati profondi della CE ricevono gli output più numerosi. La CE, a sua volta, è fortemente e reciprocamente connessa con molte altre parti della corteccia. L’ippocampo riceve anche una proiezione molto importante dall’area del setto mediale. La distruzione dell’area settale abolisce il ritmo theta dell’ippocampo e compromette gravemente alcuni tipi di memoria. (Si pensa che le cosiddette droghe “da stupro” esercitino i loro effetti amnestici almeno in parte antagonizzando la proiezione colinergica dal setto mediale all’ippocampo.)
Fisiologia
Esempi di ippocampo di ratto EEG e attività neurale CA1 nelle modalità theta (sveglio/beathaving) e LIA (slow-wave sleep). Ogni grafico mostra 20 secondi di dati, con una traccia EEG ippocampale in alto, raster di spike da 40 cellule piramidali CA1 registrate simultaneamente nel mezzo (ogni linea raster rappresenta una cella diversa), e un grafico di velocità di corsa in basso. Il grafico in alto rappresenta un periodo di tempo durante il quale il ratto era attivamente alla ricerca di pellet di cibo sparsi. Per il grafico in basso, il ratto era addormentato.
L’ippocampo mostra due principali “modalità” di attività, ciascuna associata a un modello distinto di onde EEG e attività della popolazione neurale.Queste modalità sono chiamate dopo i modelli EEG associati a loro: theta e grande attività irregolare (LIA). Ecco alcune delle loro caratteristiche principali nel ratto, l’animale che è stato studiato più estesamente:
La modalità theta appare durante gli stati di comportamento attivo, vigile (soprattutto locomozione), e anche durante il sonno REM (sognare). Nel modo theta, l’EEG è dominato da grandi onde regolari con una gamma di frequenza di 6-9 Hz, e i principali gruppi di neuroni ippocampali (cellule piramidali e cellule di granulo) mostrano attività di popolazione sparse, il che significa che in qualsiasi breve intervallo di tempo, la grande maggioranza delle cellule sono silenziose, mentre la piccola frazione rimanente fuoco a tassi relativamente elevati, fino a 50 spike in un secondo per il più attivo di loro. Una cellula attiva rimane tipicamente attiva da mezzo secondo a pochi secondi. Mentre il ratto si comporta, le cellule attive cadono in silenzio e nuove cellule diventano attive, ma la percentuale complessiva di cellule attive rimane più o meno costante. In molte situazioni, l’attività cellulare è determinata in gran parte dalla posizione spaziale dell’animale, ma anche altre variabili comportamentali la influenzano chiaramente.
La modalità LIA appare durante il sonno a onde lente (non sognare) e anche durante gli stati di immobilità da svegli, come riposare o mangiare. Nella modalità LIA, l’EEG è dominato da onde taglienti, che arerandomly-timed grandi deviazioni del segnale EEG della durata di 200-300msec. Queste onde acute determinano anche i modelli di attività neurale della popolazione. Tra di loro, le cellule piramidali e le cellule di granulo sono molto tranquille (ma non silenziose). Durante un’onda acuta, fino al 5-10% della popolazione può emettere potenziali d’azione durante un periodo di 50 msec; molte di queste cellule emettono non uno ma una raffica di picchi.
Queste due modalità di attività ippocampale possono essere viste nei primati così come nei ratti, con l’importante eccezione che è stato difficile vedere una robusta ritmicità theta nell’ippocampo dei primati. Ci sono, tuttavia, qualitativamente simili onde taglienti, e similistate-dipendente cambiamenti nella popolazione neuraleactivity..
Il ritmo theta
A causa della sua densamente imballato strati neurali, l’ippocampo generatessome alcuni dei più grandi segnali EEG di qualsiasi struttura del cervello. In alcune situazioni l’EEG è dominato da onde regolari, che spesso continuano per molti secondi. Questo modello EEG è noto come ritmo theta. Fu uno dei primi fenomeni EEG ad essere scoperto: la prima descrizione venne da Jung e Kornmuller, nel 1938. Non è stato fino al 1954, tuttavia, con la pubblicazione di Green e Arduini di un lungo e approfondito studio del ritmo theta in conigli, gatti e scimmie, che l’interesse è veramente decollato. Forse in gran parte perché hanno collegato il ritmo theta all’eccitazione, che era il tema caldo del giorno, la loro carta ha provocato un diluvio di studi di follow-up, con conseguente pubblicazione di letteralmente centinaia di studi di fisiologia e farmacologia del theta durante gli anni 1950 e 1960. Nonostante questo corpo di lavoro piuttosto scoraggiante, molte domande sono rimaste senza risposta, soprattutto la questione della funzione. Anche attualmente questa domanda più critica non ha ancora avuto una risposta convincente.
La ritmicità theta è molto evidente nei conigli e nei roditori, e anche chiaramente presente nei gatti e nei cani. Se il theta può essere visto nei primati è una domanda fastidiosa. Green e Arduini riportato solo veryshort scoppi di ritmicità piuttosto irregolare nelle scimmie, e studi mostlater hanno visto poco più. Tuttavia, le variazioni nella metodologia hanno reso difficile trarre conclusioni forti.
Nei ratti (gli animali che sono stati di gran lunga i più ampiamente studiati), theta è visto principalmente in due condizioni: in primo luogo, quando un animale sta camminando o in qualche altro modo interagendo attivamente con itssurroundings; in secondo luogo, durante il sonno REM. La frequenza aumenta come funzione della velocità di corsa, a partire da circa 6,5 Hz sulla fascia bassa, e aumentando a circa 9 Hz sulla fascia alta, anche se frequenze più elevate sono a volte visto per movimenti drammatici come jumpsacross ampi spazi. In altre, più grandi, specie di animali, thetafrequenze sono generalmente un po ‘più basso. La dipendenza comportamentale sembra anche variare da specie: in gatti e conigli, theta è oftenobserved durante gli stati di vigilanza immobile. Questo è stato riportato anche per i ratti, ma solo quando sono gravemente spaventati.
Il teta non è solo confinato all’ippocampo. Nei ratti, può essere osservato in molte parti del cervello, comprese quasi tutte quelle che interagiscono fortemente con l’ippocampo. Si pensa che il pacemaker del ritmo si trovi nell’area del setto mediale: quest’area proietta a tutte le regioni che mostrano ritmicità theta, e la sua distruzione elimina il theta in tutto il cervello. (Ci può essere un’eccezione, una piccola area nell’ipotalamo chiamata supramamillarynucleus, che sembra essere in grado di sostenere il theta indipendentemente dal setto in alcune situazioni.)
La funzione del theta, presumendo che ne abbia una, non è stata ancora spiegata in modo convincente, sebbene siano state proposte numerose teorie.La tendenza più popolare è stata quella di metterlo in relazione con l’apprendimento e la memoria.È ben stabilito che le lesioni del setto mediale – il nodo centrale del sistema theta – causano gravi interruzioni della memoria.Tuttavia, il setto medio è più che il semplice controllore del theta, è anche la principale fonte di proiezioni colinergiche alhippocampus. Non è stato stabilito che le lesioni del setto esercitano i loro effetti specificamente eliminando theta.
Onde taglienti
Durante il sonno, o durante gli stati di veglia quando un animale è a riposo o altrimenti non impegnato con l’ambiente circostante, l’EEG ippocampale mostra un modello di onde lente irregolari, un po ‘più grande in ampiezza thantheta onde. Questo modello è occasionalmente interrotto da grandi surgescalled onde taglienti. Questi eventi sono associati a scoppi di attività di picco, della durata di 50-100 msec, nelle cellule piramidali di CA3 eCA1. Essi sono anche associati a breve durata ad alta frequenza EEGoscillazioni chiamato “increspature”. Ripples, con frequenze nel range150-200 Hz nei ratti, di solito può essere rilevato solo da elettrodi locatedeither all’interno, o molto vicino a, lo strato del corpo cellulare CA1. Incontrast, elettrodi situati ovunque all’interno dell’ippocampo, o anchein strutture cerebrali vicine, sarà spesso raccogliere onde taglienti come grandi deflessioni lente EEG, della durata di 200-400 msec.
Nei ratti, onde taglienti sono più robusti durante il sonno, quando si verificano a un tasso medio intorno 1 al secondo, ma in un temporalpattern molto irregolare. Onde taglienti si verificano anche durante gli stati di veglia inattivi, ma sono meno frequenti allora e di solito più piccolo. Nelle scimmie, le onde acute sono abbastanza robuste, ma non si verificano quasi con la stessa frequenza che nei ratti.
Uno degli aspetti più interessanti delle onde acute è che sembrano essere associate alla memoria. Wilson e McNaughton 1994, e numerosi studi successivi, hanno riferito che quando le cellule di luogo ippocampali hanno campi di fuoco spaziali sovrapposti (e quindi spesso fuoco in quasi simultaneità), tendono a mostrare attività correlata durante il sonno che segue la sessione comportamentale. Questo miglioramento della correlazione, comunemente noto come riattivazione, è stato trovato per essere confinato principalmente alle onde taglienti. È stato proposto che le onde acute sono, infatti, riattivazioni di modelli di attività neurale che sono stati memorizzati durante il comportamento, guidato dal rafforzamento delle connessioni sinaptiche all’interno dell’ippocampo. Questa idea forma una componente chiave della teoria della “memoria a due stadi”, sostenuta da Buzsaki e altri, che propone che i ricordi sono memorizzati all’interno dell’ippocampo durante il comportamento, e poi successivamente trasferiti alla neocorteccia durante il sonno: le onde taglienti sono suggeriti per guidare i cambiamenti sinaptici Hebbian in obiettivieneocorticali delle vie di uscita ippocampali.
Evoluzione
L’ippocampo ha un aspetto generalmente simile in tutta la gamma di specie mammifere, da quelle basali come il riccio a quelle più “avanzate” come l’uomo. Quindi, l’ippocampo occupa un volume molto più grande della corteccia nei roditori che nei primati.
C’è anche una relazione generale tra la dimensione dell’ippocampo e la memoria spaziale: quando si fanno confronti tra specie simili, quelle che hanno una maggiore capacità di memoria spaziale tendono ad avere volumi ippocampali più grandi. Questa relazione si estende anche alle differenze di sesso: nelle specie in cui maschi e femmine mostrano forti differenze nella capacità di memoria spaziale, tendono anche a mostrare differenze corrispondenti nel volume dell’ippocampo
Le specie non-mammifere non hanno una struttura cerebrale che assomiglia all’ippocampo dei mammiferi, ma ne hanno una che è considerata omologa ad esso. L’ippocampo, come sottolineato sopra, è essenzialmente il bordo mediale della corteccia. Solo i mammiferi hanno una corteccia completamente sviluppata, ma la struttura da cui si è evoluta, chiamata pallio, è presente in tutti i vertebrati, anche nei più primitivi come la lampreda o la rana pescatrice. Il pallio è solitamente diviso in tre zone: mediale, laterale e dorsale. Il pallio mediale forma il precursore dell’ippocampo. Non assomiglia visivamente all’ippocampo, perché gli strati non sono deformati a forma di S o avvolti dal giro dentato, ma l’omologia è indicata da forti affinità chimiche e funzionali. C’è ora la prova che queste strutture simili all’ippocampo sono coinvolte nella cognizione spaziale in uccelli, rettili e pesci.
Negli uccelli, la corrispondenza è sufficientemente ben stabilita che la maggior parte degli anatomisti si riferiscono alla zona palliale mediale come “avianhippocampus”. Numerose specie di uccelli hanno forti abilità spaziali, in particolare quelle che nascondono il cibo. Ci sono prove che gli uccelli che nascondono il cibo hanno un ippocampo più grande di altri tipi di uccelli, e che i danni all’ippocampo causano menomazioni inspatial memoria.
La storia per i pesci è più complessa. Nei pesci teleostei (che costituiscono la grande maggioranza delle specie esistenti), il proencefalo è stranamente distorto rispetto ad altri tipi di vertebrati. La maggior parte dei neuroanatomisti crede che il proencefalo dei teleostei sia essenzialmente rovesciato, come un calzino rovesciato, così che le strutture che si trovano all’interno, vicino ai ventricoli, per la maggior parte dei vertebrati, si trovano all’esterno nei pesci teleostei, e viceversa. Una delle conseguenze di questo è che il pallio mediale (zona “ippocampale”) di un tipico vertebrato è pensato per corrispondere al pallio laterale di un tipico pesce. Diversi tipi di pesci (in particolare i pesci rossi) hanno dimostrato sperimentalmente di avere forti capacità di memoria spaziale, formando anche “mappe cognitive” delle aree che abitano. C’è evidenza che il danno al pallio laterale compromette la memoria spaziale (la navigazione a lunga distanza, come l’homing dei salmoni, sembra affidarsi a meccanismi diversi, tuttavia).
Quindi, il ruolo della regione ippocampale nella navigazione sembra iniziare molto indietro nell’evoluzione dei vertebrati, precedendo le scissioni avvenute centinaia di milioni di anni fa. Non è ancora noto se il pallio mediale svolge un ruolo simile in vertebrati ancora più primitivi, come squali e raggi, o anche lamprede e pesci selvatici. Alcuni tipi di insetti, e molluschi come il polpo, hanno anche forti capacità di apprendimento spaziale e di navigazione, ma queste sembrano funzionare in modo diverso dal sistema spaziale dei mammiferi, quindi non c’è ancora una buona ragione per pensare che abbiano un’origine evolutiva comune; né c’è sufficiente somiglianza nella struttura del cervello per permettere di identificare qualcosa di simile a un “ippocampo” in queste specie.
Vedi anche
- Amigdalohippocampectomia
- Fascio medio del proencefalo
- Nuclei settali nuclei
Riferimenti & Bibliografia
Testi chiave
Libri
- Aboitiz, F, Morales D, Montiel J (2003). L’origine evolutiva dell’isocorteccia dei mammiferi: Verso un approccio integrato di sviluppo e funzionale. Behav. Brain Sciences 26: 535-552.
- Amaral, D; Lavenex P (2006). “Ch 3. Hippocampal Neuroanatomy” Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J The Hippocampus Book, Oxford University Press.
- Broglio, C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). Segni distintivi di un piano comune dei vertebrati del proencefalo: Aree palliali specializzate per la memoria spaziale, temporale ed emotiva nei pesci attinopterigi. Brain Res. Bull. 57: 397-399.
- Buzsáki, G (2002). Oscillazioni Theta nell’ippocampo. Neuron 33: 325-340.
- Buzsáki, G (2006). Ritmi del cervello.
- Cantero, JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (2003). Oscillazioni theta dipendenti dal sonno nell’ippocampo e nella neocorteccia umana. J. Neurosci. 23: 10897-10903.
- Colombo, M, Broadbent N (2000). L’ippocampo aviario è un omologo funzionale dell’ippocampo dei mammiferi? Neurosci. Biobehav. Rev. 24: 465-484.
- Eichnbaum, H; Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System, MIT Press.
- Ekstrom, AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). Reti cellulari alla base della navigazione spaziale umana. Natura 425: 184-188.
- Gray, JA; McNaughton N (2000). La neuropsicologia dell’ansia: An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press.
- Green, JD, Arduini AA (1954). Attività elettrica ippocampale in eccitazione. J. Neurophysiol. 17: 533-557.
- Jacobs, LF, Gaulin SJ, Sherry DF, Hoffman GE (1990). Evoluzione della cognizione spaziale: modelli sesso-specifici di comportamento spaziale prevedere le dimensioni dell’ippocampo. PNAS 87: 6349-6352.
- Jacobs, LF (2003). L’evoluzione della mappa cognitiva. Brain Behav. Evol. 62: 128-139.
- Kirk, IJ, McNaughton N (1991). Cottura delle cellule sopramammillari e l’attività ritmica lenta dell’ippocampo. Neuroreport 11: 723-725.
- Maguire, EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). Cambiamento strutturale legato alla navigazione negli ippocampi dei tassisti. PNAS 97: 4398-4403.
- McNaughton, BL, Battaglia FP, Jensen O, Moser EI, Moser MB (2006). Integrazione dei percorsi e la base neurale della “mappa cognitiva”. Nat. Rev. Neurosci. 7: 663-678.
- Moser, EI, Kropf E, Moser M-B (2008). Cellule di luogo, cellule griglia, e il sistema di rappresentazione spaziale del cervello. Ann. Rev. Neurosci. 31.
- Nieuwenhuys, R (1982). Una panoramica dell’organizzazione del cervello dei pesci attinopterigi. Am. Zool. 22: 287-310.
- O’Kane, G, Kensinger EA, Corkin S (2004). Prove di apprendimento semantico nell’amnesia profonda: Un’indagine con il paziente H.M.. Hippocampus 14: 417-425.
- O’Keefe, J; Nadel L (1978). The Hippocampus as a Cognitive Map, Oxford University Press.
- Portavella, M, Vargas JP, Torres B, Salas C (2002). Gli effetti delle lesioni palliali telencefaliche sull’apprendimento spaziale, temporale ed emotivo nel pesce rosso. Brain Res. Bull. 57: 397-399.
- Rodríguez, F, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C (2002). Memoria spaziale e pallio ippocampale attraverso l’evoluzione dei vertebrati: intuizioni da rettili e pesci teleostei. Brain Res. Bull. 57: 499-503.
- Sainsbury, RS, Heynen A, Montoya CP (1987). Correlati comportamentali dell’ippocampo tipo 2 theta nel ratto. Physiol. Behav. 39: 513-519.
- Scoville, WB, Milner B (1957). Perdita di memoria recente dopo lesioni bilaterali dell’ippocampo. J. Neurol. Neurosurg. Psych. 20: 11-21.
- Shettleworth, SJ (2003). Memoria e specializzazione ippocampale in uccelli che conservano il cibo: Sfide per la ricerca sulla cognizione comparata. Brain Behav. Evol. 62: 108-116.
- Skaggs, WE, McNaughton BL, Wilson MA, Barnes CA (1996). Precessione della fase Theta in popolazioni neuronali ippocampali e la compressione delle sequenze temporali. Hippocampus 6: 149-176.
- Squire, LR (1992). La memoria e l’ippocampo: una sintesi dei risultati con ratti, scimmie e umani. Psych. Rev. 99: 195-231.
- Squire, LR; Schacter DL (2002). The Neuropsychology of Memory, Guilford Press.
- Vanderwolf, CH (1969). Attività elettrica ippocampale e movimento volontario nel ratto. EEG & Clin. Neurophysiol. 26: 407-418.
- Vargas, JP, Bingman VP, Portavella M, López JC (2006). Telencefalo e spazio geometrico nel pesce rosso. Eur. J. Neurosci. 24: 2870-2878.
- West, MJ (1990). Studi stereologici dell’ippocampo: un confronto delle suddivisioni ippocampali di diverse specie tra cui ricci, roditori da laboratorio, topi selvatici e uomini. Prog. Brain Res. 83: 13-36.
Documenti
- Amaral DG e Cowan WM. 1980. Afferenze sottocorticali alla formazione dell’ippocampo nella scimmia. Journal of Comparative Neurology. Feb 15; 189(4):573-91.
- Duvernoy, H. (2005) The Human Hippocampus, 3rd ed. Berlin: Springer-Verlag.
Materiale aggiuntivo
Documenti
- Google Scholar
- http://www.psycheducation.org/emotion/hippocampus.htm Grande tour del cervello!
- BrainMaps at UCDavis hippocampus
- Artificial Hippocampus
- BrainInfo at the University of Washington hier-164
- John O’Keefe & Lynn Nadel (1978) The Hippocampus as a Cognitive Map , Oxford University Press. Full Text
Immagini aggiuntive
Aggiungi una foto a questa galleria
Cervello umano: Sistema limbico
Amigdala – Giro del cingolo – Giro del fornicato – Ippocampo – Ipotalamo – Corpo mammillare – Nucleo accumbens – Corteccia orbitofrontale – Giro paraippocampale
|
v-d-e
Cervello umano: proencefalo (cervello – corteccia cerebrale – emisferi cerebrali, materia grigia) (TA A14.1.09.002-240, 301-320, GA 9.818-826) |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Lobo frontale |
|
||||||||||||||||
| Lobo parietale |
|
Superolaterale
|
Mediale/inferior
|
Both
|
|||||||||||||
| Lobo occipitale |
|
Superolaterale
|
Mediale/inferior
|
||||||||||||||
| Lobo temporale |
|
Superolaterale
|
Medial/inferior
|
||||||||||||||
| Sulci/fissure interlobari |
|
Superolaterale
|
Mediale/inferior
|
||||||||||||||
| Lobo limbico |
|
Altro
|
|||||||||||||||
| Lobo insulare |
Giro lungo dell’insula – Giro corto dell’insula – Solco circolare dell’insula |
||||||||||||||||
| Generale |
Operculum – Poli degli emisferi cerebrali |
||||||||||||||||
Alcune categorizzazioni sono approssimazioni, e alcune aree di Brodmann abbracciano i gyri.
|
|||||||||||||||||
Questa pagina usa contenuti di Wikipedia con licenza Creative Commons (visualizza autori).