イントロダクション
Amyotrophic lateral sclerosis(ALS)は上部および下部運動ニューロン(UMNおよびLMN)の関与を特徴とする進行性の障害である。 ALSでは、筋肉の衰えは多裂筋外転筋(APB)と第一背側骨間筋に優先的に影響し、相対的に少関節外転筋(ADM)は温存される。 このALSの特徴は、「スプリットハンド」サインと呼ばれている(Wilbourn, 2000)。 一般に、ALS患者の運動単位喪失の程度は、ADMよりもAPBで著しく大きい(Kuwabaraら、1999)。 ALSの小手筋の萎縮の程度が異なる背景には、皮質と末梢の両方のメカニズムが提案されている(Weberら, 2000; Shibuyaら, 2013)。 経頭蓋磁気刺激研究の結果、遠位筋複合体を支配する脊髄運動ニューロンへの皮質・基質ニューロン入力は、健常者においてより広範囲であることが示されている(Macdonellら, 1999; Menonら, 2014)。 このような入力の違いにより、ALSではこれらの脊髄運動ニューロンが経シナプス的な前向性興奮毒性メカニズムにより優先的に変性するのかもしれない。 ALSでは、大脳皮質運動ニューロンから足関節複合体への投射が優先的に影響を受けることから、大脳皮質運動ニューロン機能障害がALSのスプリットハンドサインに寄与していると考えられる(Weberら、2000年)。 末梢神経の興奮性に関する研究では、ALSではAPBを支配する運動ニューロン軸索が過興奮性で変性しやすいことが示唆されている(Vucic and Kiernan, 2010; Shibuya et al, 2013)。 しかし、これまで、APBとADMを支配する運動ニューロンの機能障害や興奮性を直接比較した研究はほとんどない。 F波は、運動ニューロンの反道筋性活性化を反映する遅発低振幅の反応である(Pastore-Olmedo et al.) F波は、分節性運動ニューロンの興奮性の独立した指標を提供する可能性がある(Fisher, 1992; Milanov, 1992; Hachisuka et al., 2015)。 本研究の主な目的は、F波を用いてALSのAPBとADMを支配する脊髄運動ニューロンの機能障害の違いを調べることである。
材料と方法
参加者
散発性ALS患者40人と年齢と性別が一致した正常者20人を研究対象とした。 全患者は2013年8月から2014年6月にかけて北京ユニオン医科大学病院神経科を受診した。 修正エル・エスコリアルのALS確定基準,可能性基準,検査室支持型ALS基準(Brooksら,2000)を満たすALS患者を連続的に登録した。 これらの患者について,さまざまな電気生理学的検査と,登録時の年齢や症状発現からの時間などの臨床的特徴を分析した. どのALS患者にも遺伝子変異は確認されていない。 上肢のUMNの関与は、クローヌス、緊張の亢進、腱反射の亢進、ホフマン徴候が陽性であることで示唆された。 ALS患者を身体症状に基づいて2群に分けた。 第1群(ALS患者20名)では、手指固有筋の衰弱と脱力がみられた。 第2群(ALS患者20名)では、手指固有筋の衰えや脱力はなく、指の離開動作の障害はないか軽度であった。 左手のデータは正常対照者(NC)のデータで、右手のデータはALS患者(1群)のデータで、右手のデータはALS患者(2群)のデータで分析した。 ALS患者は、ALS機能評価尺度改訂版(ALSFRS-R; Cedarbaum et al.、1999)を用いて臨床的病期分類を行い、発症部位によって分類した。 電気診断学的特徴は、すべてのALS患者において、前角細胞のびまん性かつ進行性の変性と一致した。 調査時点では、どの患者もriluzoleや他の抗痙攣薬を服用していなかった。 臨床検査と神経伝導検査に基づいて手根管症候群または立方骨トンネル症候群を併発した参加者は除外された。 すべての被験者は、調査への参加についてインフォームド・コンセントを文書で得た。 本研究は、北京ユニオン医科大学病院(中国・北京)の臨床研究倫理委員会の承認を受け、すべての手順はヘルシンキ宣言に従って行われた。
Nerve Conduction Study
電気生理検査はViking IV electromyography (EEG) system (Nicolet Biomedical, Madison, WI, USA)を用いて行われた。 手首の正中神経または尺骨神経刺激後にAPB筋とADM筋から複合筋活動電位(CMAPs)を記録した。 研究対象の四肢の皮膚温度は>32℃に維持した。 遠位運動潜時(DML)、CMAP振幅のピーク・トゥ・ピーク、運動伝導速度(MCV)、ADM/APB CMAP振幅比が測定された<262> <8512>F-wave Study<4202> <3797>全ての被験者は実験中仰臥位でリラックスしていた。 APB筋とADM筋の上の皮膚に取り付けた表面電極で、正中神経と尺骨神経のF波を記録した。 このとき、活性記録電極の7cm近位にある部位に、周波数1Hzの上刺激100回を与え、陰極を陽極に近接させ、調査対象の神経を刺激した。 合計100回の刺激は、F波の可能性を十分に探るために適切であると考えられた(Fisher et al.、1994)。 フィルター設定は20Hzから10kHz、掃引速度は5ms/div、アンプゲインは0.5mV/divであった。 A波は、20トレース中少なくとも8トレースで発生する一定の潜時を持つ同一の遅延反応と定義し、F波の研究から除外した(Puksa et al.、2003)。 F波のパラメータは、最小潜時、平均潜時、最大潜時、F波の持続性、平均振幅、平均F/M振幅比、リピーターF波の数で解析した。 F波のpeak-to-peak振幅は、振幅が40μV以上であれば測定した。 平均F/M振幅比は、平均F波振幅を対応する最大CMAP振幅で割ることにより算出した。 反復ニューロン(RN)は、同一の潜時、振幅、形状を持つ一連のF波を生じさせるニューロンであり、これらのF波はリピータF波と定義された。 RNとリピータF波は目視により検出し、他のリピータF波と手動で重ね合わせた。 リピーターF波は以下の指標を用いて測定した:指標RN=100×RN数/100回の一連の刺激で異なるF波形を持つ痕跡数;指標リピーターF波(Freps)=100×リピーターF波数/同じ神経でF波を持つ痕跡数合計(Chroniら、2012)
統計解析
データの正規性の評価にはシャピロ・ウィルク検定が使用された. 分散分析のP値が有意となった場合、Student-Newman-Keuls検定を実施した。 2群間の差の評価には独立標本t検定を用いた。 ノンパラメトリックなデータについては、Kruskal-Wallis H 検定を用いてグループ間の比較が行われた。 帰無仮説が棄却された後、P < 0.017の有意水準で、Mann-Whitney U検定およびBonferroni補正を用いて群の一対比較が検定された。 カテゴリー変数の差は、カイ二乗検定で検討した。 統計的有意水準はP < 0.05とした。 統計解析にはSPSS for Windows, version 21.0 (SPSS, Inc., Chicago, IL, USA) を用いた。
Results
ALS患者とNC参加者の臨床プロファイルは表1にまとめられている。 ALS患者はすべて臨床的にLMN優位であった。 受診時年齢,男女比,身長は3群間で同等であった。 ALS患者のうち,上肢発症者は第1群70%,第2群25%であった。 患部2か所のALS患者は第1群11名,第2群10名であり,全身発症者は第1群9名,第2群10名であった。 疾患期間とALSFRS-R得点は第1群,第2群のALS患者で有意差がなかった

Table 1. 参加者の臨床プロファイル。
表2は、ALS患者およびNCの神経伝導試験の結果を示す。 1群のALS患者ではNC群に比べADM/APB CMAP振幅比が有意に増加し、ALS患者のsplit-hand signと整合的に観察された(Kuwabara et al.、2008)。 ALS患者およびNCのF波研究の結果を表3に示す。 APBのF波平均振幅は第1群で第2群より有意に小さく、第2群とNCの間で同程度であった。 ADMの平均F波振幅は、1群、2群ともNCに比べ有意に大きくなった。 APBとADMのF/M振幅比は、第1群では第2群やNCに比べて有意に高かったが、第2群とNCでは同程度のF/M振幅比であった。 ALS患者でNCより有意に低かったAPBのF波の持続性は、第1群と第2群で同程度であった。 ADMのF波持続は、1群では2群、NCに比べ有意に低かったが、2群とNCでは同程度であった。 APBのindex RNとindex FrepsはNCに比べ1、2群で有意に増加したが、これらのindexは1、2群間で同程度であった。 ADMのindex RNとindex Frepsは、群1と群2およびNCの間で有意に高くなったが、群2とNCの間ではこれらのindexは同程度の値であった。 図1は、第1群、第2群およびNCのALS患者から記録した正中神経と尺骨神経のF波トレースの代表例を示す。

Table 2. 神経伝導試験の結果。

Table 3. ALS患者と正常対照者のF波検査。

Figure 1. 筋萎縮性側索硬化症(ALS)患者および正常対照者(NC)から記録したF波の代表例。 (A)ALS患者の手の衰弱と脱力を示すF波を記録した。 正中神経と尺骨神経の両方から記録したF波では、F波の持続性が低下し、リピーターF波の数が増加していることが観察された。 (B) 衰弱や脱力が検出されないALS患者の手指から記録されたF波。 正中神経ではF波の持続性が低下し、リピーターF波の数が増加しているが、尺骨神経から記録されたF波のパラメータは比較的正常であった。 (C)健常者の左上肢のF波記録。 正中神経、尺骨神経ともにF波の振幅、潜時、波形は変動しており、F波の持続性は正常であった。 記録の右側の文字は、振幅、潜時、波形に基づくリピータF波を示す。 表4はALSのF波とNCのF波の診断性能を示したものである。 F波はALS患者をNCと区別するのに役立つと考えられる。 APBの指標RNと指標Frepsは、指標RN(0.998、95%信頼区間(CI)0.937-1.000)および指標Freps(1.000、95%CI0.940-1.000)の曲線下面積が「非常に良い」診断能を示したように、ALS患者のNCからの区別に信頼できる変数と思われた。 残りのF波変数は,APBの指標RNおよび指標FrepsよりもAUC値が低く,したがって,診断的有用性は低かった. ADM/APB CMAP振幅比は0.766(95%CI 0.638-0.865, P < 0.001)のAUCを示し、ALS患者とNCを中程度に鑑別することが可能であった。 ALSの診断にADM/APB > 1.7 (Kim et al., 2015) のカットオフ値を使用すると、対照と比較して中程度の感度 (52.5%) と高い特異度 (85.0%) を得ることができた。 APBにおけるF波の持続性(P = 0.002)、指標RN(P < 0.001)、指標Freps(P < 0.001)は、ADM/APB CMAP振幅比よりも強固にALS患者とNCを区別するようだった。
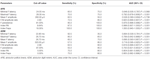
Table 4. 筋萎縮性側索硬化症(ALS)対正常対照(NC)におけるF波の診断性能
考察
この研究の主目的は、ALS患者のAPBとADM運動ニューロン間の機能障害の違いを確認するためにF波測定法を使用することであった。 ALSの病期分類の提案(Roche et al., 2012)によると、病期は第1群と第2群で同等であった。 1群と2群の上肢発症の割合の違いは、両群の疾患進行のパターンの違いの背景にある可能性がある。 推定運動単位数とCMAP振幅は運動ニューロン損失の評価に有用なパラメータであるが、F波は前角細胞の機能障害や不安定性の直接的なプローブとなりうる(Hachisuka et al, 2015)。 F波の持続性は、LMNの数や運動ニューロンの興奮性に関連している(Schiller and Stalberg, 1978; de Carvalho et al., 2002; Argyriou et al., 2006)。 リピータF波の基礎となるメカニズムとして、特定の前角細胞における興奮性の上昇、一部の運動ニューロンにおける興奮性の低下、または運動ニューロンの損失が提案されている(Schiller and Stalberg, 1978; Petajan, 1985; Peioglou-Harmoussi et al, 1987; Hachisuka et al, 2015)。 運動ニューロンが失われると、個々の運動ニューロンからのリピータF波が認識されやすくなると考えられるが、個々の運動ニューロンのバックファイヤー頻度が低いため、そのメカニズムはむしろ考えにくいと主張されている(Chroni et al.、2012)。 生理的には、APBとADMの間でF波の持続性とリピーターF波の数に有意な差が見られた。 これらの知見は,APBを支配する機能的運動ニューロンの数が少ないこと(Goochら,2014),あるいはAPBの皮質抑制性モジュレーションの増加(Menonら,2014)と関連しているのかもしれない。
ALSにおいて,脊髄運動ニューロンの機能障害は明らかな症状の発現前に徐々に進行する(Bradley,1987)。 本研究では,手の衰えや脱力が検出されないALS患者では,NCと比較してF波の持続性が有意に低下し,APBのindex RNとindex Frepsの値が高くなることが示された。 さらに、これらのALS患者はADMのF波が比較的正常であった。 これらのデータは、ALSにおいてAPBを支配する脊髄運動ニューロンが優先的に機能不全に陥ることと矛盾しない(Baumann et al., 2012)。 しかし、ALSでは、APBを支配する脊髄運動ニューロンがADMを支配するニューロンよりも活発である可能性があり、残存する運動ニューロンが代償的に脱神経された筋線維の側副神経を提供する可能性があるので、CMAP振幅は運動ニューロン損失の検出には十分な感度を持たないかもしれない(van Dijkら, 2010)。 F波、特に正中神経のF波を分析することで、臨床症状のないALS患者でも前角細胞の微妙な変化を検出できる可能性があり、病気の進行を評価する有用なアプローチとなる。
LMN損傷はF波の振幅を減少させることが示されている(Fisher、1992)。 筋萎縮は運動ニューロンプールの過興奮性を部分的に中和することにより、筋反応を弱める可能性がある(Drory et al., 1993)。 本研究では、スプリットハンドサインを呈したALS患者において、ADMと比較してAPBのF波振幅が有意に減少し、F波の持続性が減少し、リピーターF波の数が増加した。これは、APBを支配する脊髄運動ニューロンにより深刻な障害が生じたことを反映していると思われる。 再灌流後の大きな運動単位の形成がF波振幅の増加に寄与している可能性がある(Droryら、2001)。 ALS患者において、APBと比較してADMのF波振幅が有意に増加したことは、ADM運動ニューロンプールにおける運動ニューロン減少が緩やかであることと一致する(Baumann et al.) F/M振幅比は、一連のF波の間に活性化される運動ニューロンプールの割合を定量化する(Droryら、2001)。 ALS患者のADMと比較してAPBでF/M振幅比が有意に増加したのは、APBを支配する運動ニューロンがF波を発生させる傾向が強くなったためである。 逆に、APBにおける平均F波振幅の減少とF/M振幅比の増加の組み合わせは、ALSにおけるAPBの優先的な関与を強調するものである。 リピーターF波は運動単位の病的変化を示す(Hachisuka et al.) APBにおけるリピーターF波の数の著しい増加は,APBを支配する脊髄運動ニューロン内の過興奮性の程度が大きいことを示唆しているのかもしれない(Fang et al.,2015)<262><3797>興味深いことに,検出できる手筋萎縮がないALS患者では,APBの平均F波振幅が,スプリットハンド・サインを呈するALS患者のそれより著しく高いことが示された. しかし、ADMのF波の平均振幅は、手指の筋萎縮に関係なく、2つのALS患者群間で同等であったが、ALS患者ではNCよりも有意に高かった。 APBとADMのF波特性の違いは、運動単位内の変性と再生の競合効果に起因していると考えられる。 運動ニューロンの変性に伴い、生き残った運動ニューロンは軸索の萌芽を通じて変性した筋繊維を再神経支配することにより代償する(Ibrahim and el-Abd, 1997)。 ALSの場合、脱神経のプロセスは、より早く始まり、より急速に進行すると考えられる。 ADMを支配する運動ニューロンでは、APBを支配する運動ニューロンよりも変性速度が遅かった。 APBとADMを支配する運動ニューロンの機能不全の違いをもたらすALSのメカニズムを解明するためには、さらなる研究が必要である。 APBを支配する脊髄運動ニューロンが優先的に変性するのは,皮質メカニズム,末梢軸索メカニズム,あるいは脊髄分節機能障害,特に脊髄抑制回路が寄与しているのではないかと考えた(Turner and Kiernan, 2012; Ramírez-Jarquín et al, 2014)<262><3797>先行研究により,ALSではスプリットハンドサインがより頻繁に見られ,ADM/APB CMAP振幅比が大きくなるとほぼALS特異的になることが明らかにされた. 本研究では,ADM/APBのCMAP振幅比>1.7(Kuwabara et al., 2008)という神経生理学的基準は,ALSをNCから鑑別する上で中程度の感度と高い特異性を有することが示され,これまでの研究(Kim et al., 2015)と一致する。 本研究では、F波パラメータは、ALS患者と健常者の確実な鑑別に役立つと考えられる。 さらに,APBにおけるF波の持続性,指数RN,指数Frepsは,ADM/APB CMAP振幅比よりも大きなAUC値を示したため,ALS患者をNCから確実に鑑別できた<262><3797>我々の分析にはいくつかの限界がある。 これは横断的研究であり,対象となった参加者は比較的少数であった。 ALSにおけるsplit-hand signに関連する脊髄機能障害の程度を具体的に判断するためには、より大規模な集団を対象としたフォローアップ研究が必要である。 もう一つの潜在的な限界は、ALSを模倣する症候群を持つ患者からなる対照群がないことである。 このようなグループは、ALSを模倣する疾患とALSを識別するためのF波の臨床的価値を評価するのに有用であろう。 さらに、UMNの機能障害や運動軸索の興奮性を評価する方法を用いた電気生理学的研究を同じ患者群に対してさらに実施し、この現象の病態生理をより明らかにする必要がある
結論として、我々の発見は、ALS患者のAPBとADM間のF波の特性の違いを実証した。 これらのF波の変化はALS患者に特徴的であり、ALSを模倣するある種の疾患との鑑別に役立つと思われる。 また、小手筋の萎縮の程度が異なる病態生理学的なメカニズムを解明することは、ALSの病態に光を当てることになると考えられる。 JF、LC、ML、YG:データを解析した。 ML、YG、XL、DL、BC、DS、QD:試薬・材料・解析ツールの提供。 JFとLCは原稿執筆に貢献した。
利益相反声明
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で行われたことを宣言している。
謝辞
この研究に参加したALS患者と健康なボランティアに感謝する
Argyriou, A. A.. Polychronopoulos, P., Talelli, P., and Chroni, E. (2006). 筋萎縮性側索硬化症におけるF波研究:上部および下部運動ニューロン病変のバランスの評価。 Clin. Neurophysiol. 117, 1260-1265. doi: 10.1016/j.clinph.2006.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baumann, F., Henderson, R. D., Gareth Ridall, P., Pettitt, A.N., and McCombe, P. A. (2012). 筋萎縮性側索硬化症における下部運動ニューロン変性の定量的研究:運動単位数の指数関数的減衰と発症部位での喪失率が最大であることを示す証拠。 Clin. 123, 2092-2098. doi: 10.1016/j.clinph.2012.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bradley, W. G. (1987). 筋萎縮性側索硬化症に関する最近の見解-電気生理学的研究に重点を置いて-. 筋神経 10, 490-502. doi: 10.1002/mus.880100603
PubMed Abstract | CrossRef Full Text | Google Scholar
Brooks,B. R., Miller,R. G., Swash,M., and Munsat,T. L. (2000). El escorial revisited 筋萎縮性側索硬化症の診断のための改訂基準。 Amyotroph. Lateral Scler. Other Motor Neuron Disord. 1, 293-299. doi: 10.1080/146608200300079536
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedarbaum, J. M., Stambler, N., Malta, E., Fuller, C., Hilt, D., Thurmond, B., et al.(1999).エルスコリア・リバイス・リヴァイデッド・スクライテリア・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ・プロパティ。 ALSFRS-R は呼吸機能の評価を取り入れた改訂版 ALS 機能評価尺度である。 J. Neurol. doi: 10.1016/s0022-510x(99)00210-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Chroni, E., Tendero, I. S., Punga, A. R., and Stålberg, E. (2012)(2012. ルーチン研究におけるリピーターF波の評価の有用性。 Muscle Nerve 45, 477-485. doi: 10.1002/mus.22333
PubMed Abstract | CrossRef Full Text | Google Scholar
de Carvalho, M., Scotto, M., Lopes, A., and Swash, M. (2002)(2012). 筋萎縮性側索硬化症におけるF波と皮質脊髄病変。 Amyotroph. Lateral Scler. Other Motor Neuron Disord. 3, 131-136. doi: 10.1080/146608202760834139
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Kovach, I., and Groozman, G. B. (2001). 筋萎縮性側索硬化症における上部運動ニューロン病変の電気生理学的評価。 Amyotroph. Lateral Scler. Other Motor Neuron Disord. 2, 147-152. doi: 10.1080/146608201753275616
PubMed Abstract | CrossRef Full Text | Google Scholar
Drory, V. E., Neufeld, M. Y., and Korczyn, A. D. (1993)(2013). 急性および慢性の上部運動ニューロンリージョン後のF波特性。 Electromyogr. Clin. 神経生理学 33, 441-446.
PubMed Abstract|Google Scholar
Fang, J., Cui, L.-Y., Liu, M.-S., Guan, Y.-Z., Li, X.-G., Cui, B., et al. (2015). 筋萎縮性側索硬化症におけるF波研究:分節性運動ニューロン機能不全の評価。 Chin. Med. J. 128, 1738-1742. doi: 10.4103/0366-6999.159346
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A. (1992). H反射とF波:生理学と臨床的適応。 doi: 10.1002/mus.880151102
PubMed Abstract | CrossRef Full Text | Google Scholar
Fisher, M. A., Hoffen, B., and Hultman, C. (1994)(Muscle Nerve 15, 1223-1233. F波の規格値と記録されたF波の数。 Muscle Nerve 17, 1185-1189. doi: 10.1002/mus.880171009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gooch, C. L., Doherty, T.J., Chan, K.M., Bromberg, M.B., Lewis, R.A., Stashuk, D.W., et al(2014).。 運動単位数推定:技術および文献レビュー。 Muscle Nerve 50, 884-893. doi: 10.1002/mus.24442
PubMed Abstract | CrossRef Full Text | Google Scholar
Hachisuka, A., Komori, T., Abe, T. and Hachisuka, K.(2015). リピーターF波はポリオ経験者の運動器病変の徴候である。 Muscle Nerve 51, 680-685. doi: 10.1002/mus.24428
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahim, I. K., and el-Abd, M. A. (1997). 前角細胞障害患者における巨大リピータF波。 運動単位の大きさの役割。 Am. J. Phys.Med. Rehabil. 76, 281-287. doi: 10.1097/00002060-199707000-00006
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J.-E., Hong, Y.-H., Lee, J.-H., Ahn, S.-W., Kim, S.-M., Park, K.-S., et al.(2015)。 筋萎縮性側索硬化症とバリアントにおける解離性手指筋萎縮のパターン差。 Muscle Nerve 51, 333-337. doi: 10.1002/mus.24323
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S., Mizobuchi, K., Ogawara, K. and Hattori, T.(1999). 運動単位数推定により検出された筋萎縮性側索硬化症における解離性小手筋の病変. Muscle Nerve 22, 870-873. doi: 10.1002/(sici)1097-4598(199907)22:7<870::aid-mus9>3.0.co;2-o
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuwabara, S…, 園尾正樹・小森俊之・清水隆司・平島文・稲葉明彦・他(2008). 筋萎縮性側索硬化症における解離性小手筋萎縮:頻度、範囲、特異性. 筋神経 37, 426-430. doi: 10.1002/mus.20949
PubMed Abstract | CrossRef Full Text | Google Scholar
Macdonell, R. A. L., Jackson, G. D., Curatolo, J. M., Abbott, D. F., Berkovic,S. F., Carey, L. M.、他 (1999). 機能的MRIと経頭蓋磁気刺激による運動野の局在化。 Neurology 53, 1462-1467. doi: 10.1212/wnl.53.7.1462
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, P., Kiernan, M. C. , and Vucic, S. (2014). 手指の筋肉における皮質興奮性の違いは、健常対照者におけるスプリットハンドパターンに従う。 Muscle Nerve 49, 836-844. doi: 10.1002/mus.24072
PubMed Abstract | CrossRef Full Text | Google Scholar
Milanov, I. G.(1992). 分節性運動ニューロンの興奮性評価のためのF波。 Electromyogr. Clin. Neurophysiol.32、11-15。
PubMed Abstract|Google Scholar
Pastore-Olmedo, C., Gonzáez, O., and Geijo-Barrientosc, E. (2009). 片側腰仙骨神経根症患者におけるF波の検討。 Eur. J. Neurol. 16, 1233-1239. doi: 10.1111/j.1468-1331.2009.02764.x
PubMed Abstract |Ref Full Text | Google Scholar
Peioglou-Harmoussi, S., Fawcett, P. R. W., Howel, D. and Barwick, D. D. (1987). 運動ニューロン疾患と頚椎症におけるF反応頻度。 J. Neurol. Neurosurg. Psychiatry 50, 593-599. doi: 10.1136/jnnp.50.5.593
PubMed Abstract | CrossRef Full Text | Google Scholar
Petajan, J. H. (1985). 神経原性萎縮におけるF波。 doi: 10.1002/mus.880080811
PubMed Abstract | CrossRef Full Text | Google Scholar
Puksa, L., Stålberg, E., and Falck, B. (2003)(Muscle Nerve 8, 690-696. 健康な神経のF波研究におけるA波の発生。 Muscle Nerve 28, 626-629. doi: 10.1002/mus.10448
PubMed Abstract | CrossRef Full Text | Google Scholar
Ramírez-Jarquín, U. N., Lazo-Gómez, R., Tovar-y-Romo, L. B., and Tapia, R. (2014). 脊髄抑制回路と運動ニューロン変性におけるその役割。 Neuropharmacology 82, 101-107. doi: 10.1016/j.neuropharm.2013.10.003
PubMed Abstract | Cross Full Text | Google Scholar
Roche, J.C., Rojas-Garcia, R., Scott, K.M., Scotton, W., Ellis, C.E., Burman, R., et al. 筋萎縮性側索硬化症の病期分類の提案。 Brain 135, 847-852. doi: 10.1093/brain/awr351
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, H. H., and Stalberg, E. (1978). 健常者と痙性患者における単繊維筋電図によるF反応の検討。 J. Neurol. Neurosurg. 精神医学 41, 45-53.45
PubMed Abstract | CrossRef Full Text | Google Scholar
Shibuya, K, Misawa, S, Nasu, S, Sekiguchi, Y., Mitsuma, S., Beppu, M., et al. 筋萎縮性側索硬化症におけるスプリットハンド症候群:掌側運動軸索と下腿運動軸索の異なる興奮性変化. J. Neurol. Neurosurg. Psychiatry 84, 969-972. doi: 10.1136/jnnp-2012-304109
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, M. R., and Kiernan, M. C. (2012). 筋萎縮性側索硬化症における神経細胞間機能不全は神経変性に寄与するか. Amyotroph. Lateral Scler. 13, 245-250. doi: 10.3109/17482968.2011.636050
PubMed Abstract | CrossRef Full Text | Google Scholar
van Dijk, J. P., Schelhaas, H. J., Van Schaik, I. N., Janssen, H. M. H. A., Stegeman, D. F., and Zwarts, M. J. (2010). 筋萎縮性側索硬化症における高密度運動単位数推定を用いた疾患進行のモニタリング。 Muscle Nerve 42, 239-244. doi: 10.1002/mus.21680
PubMed Abstract | CrossRef Full Text | Google Scholar
Vucic, S., and Kiernan, M. C. (2010). 家族性ALSにおける持続性ナトリウムコンダクタンスのアップレギュレーション。 J. Neurol. Neurosurg. Psychiatry 81, 222-227. doi: 10.1136/jnnp.2009.183079
PubMed Abstract | CrossRef Full Text | Google Scholar
Weber, M., Eisen, A., Stewart, H., and Hirota, N. (2000). ALSのスプリットハンドには皮質的基盤がある。 J. Neurol. Sci. 180, 66-70. doi: 10.1016/s0022-510x(00)00430-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilbourn, A.J. (2000). スプリットハンドシンドローム。 doi: 10.1002/(sici)1097-4598(200001)23:1<138::aid-mus22>3.0.co;2-7
PubMed Abstract | CrossRef Full Text | Google Scholar
を参照してください。