実際の気体の圧力・体積・温度の関係
理想気体の場合、(PV/nRT) vs. (P) のプロットは、(PV/nRT) 軸に1を切片とした水平線となる。 しかし、現実の気体は、特に高圧力下で理想気体に期待される挙動から大きく逸脱しています(図˶‾゙゙゙˵)。 また、比較的低い圧力(1気圧以下)においてのみ、現実の気体は理想気体の挙動に近似しています(Figure ㊤)。 現実の気体は理想気体の法則に従わない、特に高圧の場合。 (a) 273KでのPV/nRT対Pのプロットでは、C2H4とCO2は比較的低い圧力で液化するため、大きな負の偏差が観察される。 (b)これらのプロットは、低圧での実ガスの実験データと理想気体の法則が比較的よく一致していることを示している。
実ガスはまた、Figure \(N_2) for N_2} のように、高温ではより理想気体に近い振る舞いとなる。 なぜ現実の気体は、高圧・低温で理想気体とは異なる振る舞いをするのでしょうか。
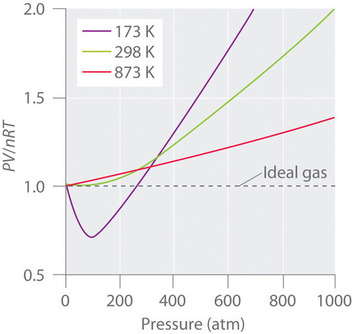
さらに、すべての分子はさまざまな力によって互いに引き合っている。 この力は、分子間距離が短い低温・高圧の気体で特に重要になる。 分子間の引力は容器の壁との衝突回数を減らす効果があり、その効果は引力相互作用の数が増えるほど顕著になる。 分子間距離の平均値が小さくなるため、気体が容器壁面に与える圧力が減少し、観測される圧力は予想よりも小さくなります(図(ⅳ))。 このように、低温ではFigure Ⓐのように、理想気体の場合、Ⓐの比が予想より小さくなり、複雑気体や低温の単純気体で特に顕著となる。 また、非常に高い圧力では、分子体積がゼロでないことの影響が支配的となる。
Nonzero molecular volume makes the actual volume greater than predicted at high pressures; intermolecular attractions make the pressure less than predicted.
At high temperature, the molecules have enough kinetic energy to overcome intermolecular attractive forces, and the effects of nonzero molecular volume dominate.The competition between these effects are responsible for many gases.The reason for the plot in the \(PV/nRT)vs. Pante. 逆に、温度が下がると気体分子の運動エネルギーは減少する。 やがて、分子が分子間引力に打ち勝つことができなくなり、液化(凝縮して液体になること)してしまうのである
。