極性共有結合とは?
共有結合は、2つの原子がその間に電子を共有するときに形成されるものです。 共有結合は、電子が不均等に共有されている場合、極性を持つ可能性があります。 歪みは2つの原子の電気陰性度の差によって生じます。 電気陰性度とは、原子が結合電子のペアを引き寄せる傾向を示す尺度である。 次の表は、この電気陰性度の差によって形成される化学結合の種類を説明するものです。
| 化学結合の種類 | 電気陰性度の差 |
|---|---|
| 非極性共有結合 | 0 |
| 少しだけ極性のある共有結合 | 0.0。1~0.4 |
| 極性共有結合 | 0.5~2 |
| イオン | > 2 |
電子陰性度の差が大きい方が極性と結合強度が大きいことを示す。 したがって極性共有結合は中間の結合強度を持つ。
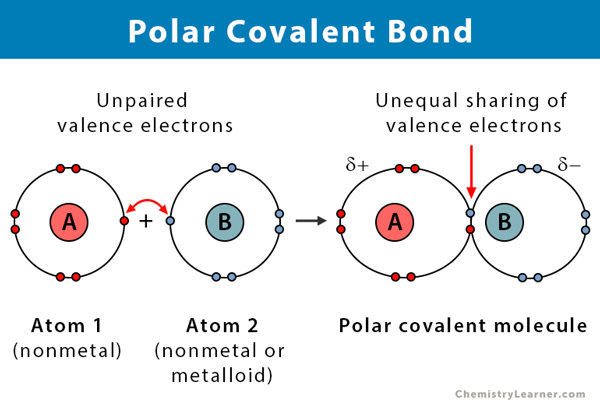
Properties of Polar Covalent Bonds
ここで、極性共有結合についていくつかの事実が挙げられる。
- 2つの非金属間、または非金属とメタロイド間で起こる
- 化合物の中で電子を不均等に共有する
- 原子間の電気陰性度の差は0.から0.の間にある
- 結合の一端が正に帯電し、他端が負に帯電する
- 極性化合物は極性溶媒に溶ける
極性共有結合の例
以下は、結合原子間の電気陰性度差がある極性共有結合の例です :
化合物名 分子式 結合 電気陰性度 差 水
H2O
O-」とあるように、「水」は「水」、「水」は「水」、「水」は「水」です。H
フッ化水素 H・F 1.9 塩化水素 HCl H-Cl
0.9 臭化水素
HBr
H-.Br
Ammonia
NH3
N-H
二酸化硫黄
SO2
S=O 1 硫化水素 H2S H- … 続きを読むS 0.4 メタノール CH3OH O-H 1.4 いくつかの化合物に見られる極性共有結合の説明を以下に示します。
水 (H2O)
水は極性溶媒であります。 極性共有結合は、水素よりも電気陰性である酸素(O)原子が、共有する電子を自分の方に引き寄せることで生まれます。 その結果、酸素原子は部分的に負の電荷を持つことになります。
塩化水素 (HCl)
塩素 (Cl) 原子は水素 (H) 原子よりも電気陰性なので、塩化水素は極性共有結合化合物です。
アンモニア (NH3)
アンモニアは極性分子である。 中心原子の窒素(N)は3個の水素(H)と結合している。 NはHより電気陰性度が高いので、電子はN原子の周りに集まる傾向があります。
臭化水素(HBr)
水素(H)と臭素(Br)の電気陰性度の差はあまり大きくありません。 そのため、HBrガスは共有結合が分極し、水素原子はわずかにプラス、臭素はわずかにマイナスの電荷を帯びています。 その結果、電子対は臭素に引き寄せられます。
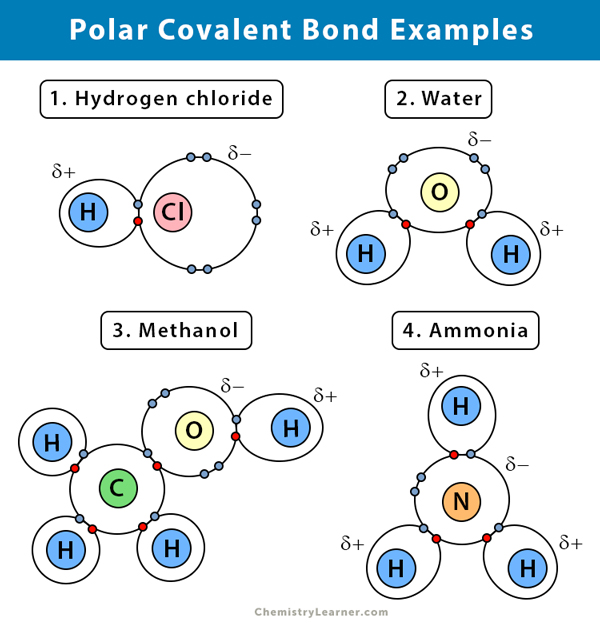
極性共有結合の例 極性・非極性共有結合の違い
以下の表は極性と非極性の共有結合を比較・対比しているものである。
極性共有結合と非極性共有結合の比較。 非極性共有結合
極性
非極性 原子の種類
二つの非金属間のもの 電気陰性度の異なる2つの非金属間
同じ電気陰性度の2つの非金属間
電気陰性度の違い
0.1 – 2
電子分布
左右非対称。 不均等な分配。
Symmetrical.
共有電子の変位
より電気陰性の原子に向かって、その部分を陰性にする
変位がないことです。 電気的に中性。
双極子モーメント
非-
。zero
Zero
化合物の他の種類の結合の存在
水素結合
ファンデルワールス結合
水への親和性
親水性 疎水性
化合物の物理的性質
高い融点と 融点・沸点<9849><748> 低融点・沸点<9849><748>
液体の揮発性<9849><748> 低揮発性<9849><748> 高揮発性<9849><748>
化合物の溶解性
極性溶媒に溶ける非極性溶媒に溶ける
例
水(H2O), アンモニア(NH3)、塩化水素(HCl)
水素(H2)、酸素(O2)、窒素(N2)
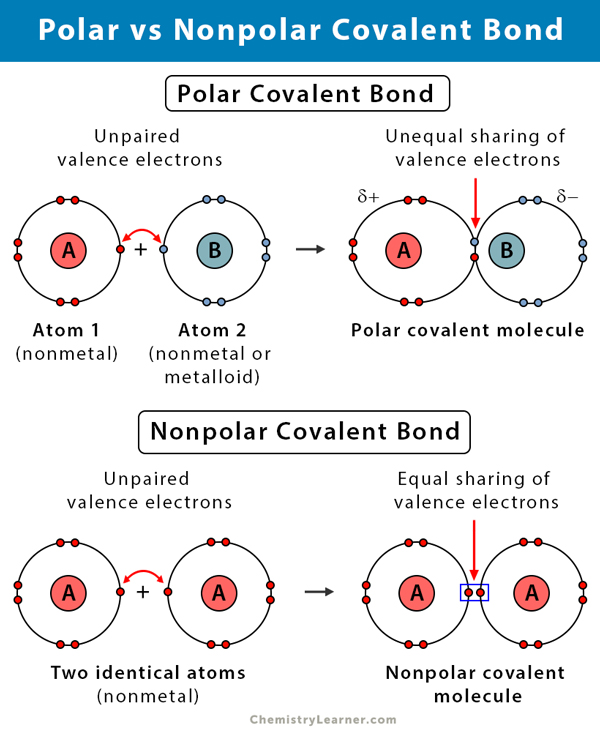
極性と非極性の共有結合 。