Relações de Pressão, Volume e Temperatura em Gases Reais
Para um gás ideal, uma trama de PV/nRT versus P dá uma linha horizontal com uma intercepção de 1 no eixo PV/nRT. Os gases reais, entretanto, mostram desvios significativos do comportamento esperado para um gás ideal, particularmente a altas pressões (Figura 1a). Apenas a pressões relativamente baixas (menos de 1 atm) os gases reais aproximam-se do comportamento do gás ideal (Figura \PageIndex{1b}}}).
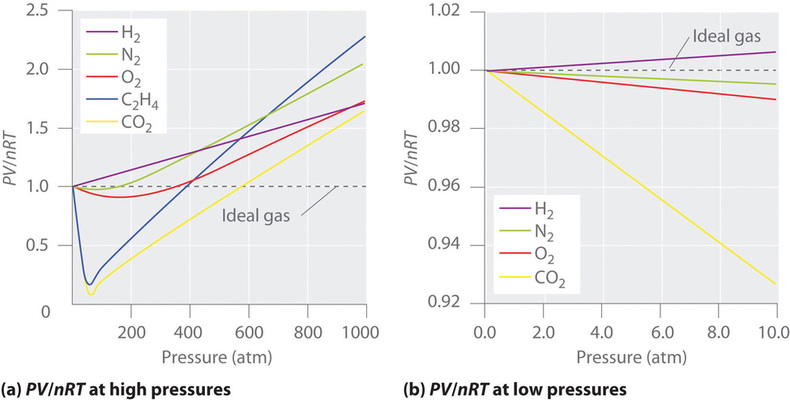
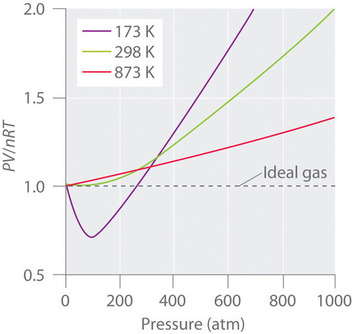
Gases reais também se aproximam mais do comportamento do gás ideal a temperaturas mais altas, como mostrado na Figura \PageIndex (2) para \PageIndex (N_2). Por que os gases reais se comportam de forma tão diferente dos gases ideais a altas pressões e baixas temperaturas? Sob estas condições, as duas suposições básicas por trás da lei do gás ideal –nomeadamente, que as moléculas de gás têm volume insignificante e que as interações intermoleculares são insignificantes- já não são válidas.
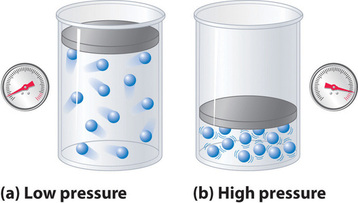
Porque as moléculas de um gás ideal são assumidas como tendo volume zero, o volume disponível para o movimento é sempre o mesmo que o volume do recipiente. Em contraste, as moléculas de um gás real têm volumes pequenos mas mensuráveis. A baixas pressões, as moléculas gasosas estão relativamente distantes, mas à medida que a pressão do gás aumenta, as distâncias intermoleculares tornam-se cada vez menores (Figura 3). Como resultado, o volume ocupado pelas moléculas torna-se significativo em comparação com o volume do recipiente. Consequentemente, o volume total ocupado pelo gás é maior do que o volume previsto pela lei do gás ideal. Assim, a pressões muito elevadas, o valor de PV/nRT medido experimentalmente é superior ao valor previsto pela lei do gás ideal.
Mais ainda, todas as moléculas são atraídas umas pelas outras por uma combinação de forças. Estas forças tornam-se particularmente importantes para gases a baixas temperaturas e altas pressões, onde as distâncias intermoleculares são mais curtas. Atrações entre moléculas reduzem o número de colisões com a parede do recipiente, um efeito que se torna mais pronunciado à medida que o número de interações atraentes aumenta. Como a distância média entre as moléculas diminui, a pressão exercida pelo gás na parede do recipiente diminui, e a pressão observada é menor do que o esperado (Figura \PageIndex{4}}). Assim, como mostrado na Figura 2, a baixas temperaturas, a razão de PV/NRT é inferior à prevista para um gás ideal, um efeito que se torna particularmente evidente para gases complexos e para gases simples a baixas temperaturas. A pressões muito elevadas predomina o efeito de volume molecular não nulo. A competição entre esses efeitos é responsável pelo mínimo observado no gráfico \(PV/nRT\) versus P\) para muitos gases.
Volume molecular não nulo torna o volume real maior do que o previsto em altas pressões; atrações intermoleculares tornam a pressão menor do que o previsto.
Em altas temperaturas, as moléculas têm energia cinética suficiente para superar as forças atrativas intermoleculares, e os efeitos do volume molecular não nulo predominam. Por outro lado, à medida que a temperatura é baixada, a energia cinética das moléculas de gás diminui. Eventualmente, chega-se a um ponto onde as moléculas não conseguem mais superar as forças de atratividade intermoleculares, e o gás se liquefaz (condensa-se a um líquido).