Segunda Metade da Glicólise (Etapas de Liberação de Energia)
Até agora, a glicólise custou à célula duas moléculas de ATP e produziu duas pequenas moléculas de açúcar com três átomos de carbono. Ambas as moléculas irão prosseguir pela segunda metade do caminho, e energia suficiente será extraída para pagar as duas moléculas de ATP usadas como um investimento inicial e produzir um lucro para a célula de duas moléculas adicionais de ATP e duas moléculas de NADH de energia ainda mais alta.
Passo 6. O sexto passo na glicólise (Figura 9.1.2) oxida o açúcar (gliceraldeído-3-fosfato), extraindo elétrons de alta energia, que são captados pelo portador de elétrons NAD+, produzindo NADH. O açúcar é então fosforilado pela adição de um segundo grupo fosfato, produzindo 1,3-bisfosfoglicérato. Note que o segundo grupo de fosfato não requer outra molécula ATP.
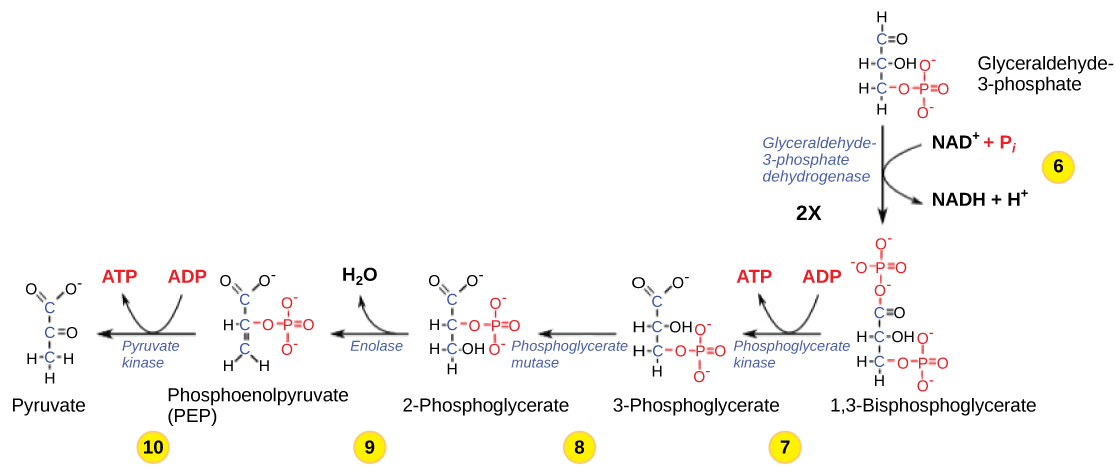
Aqui novamente é um fator limitante potencial para esta via. A continuação da reação depende da disponibilidade da forma oxidada do portador de elétrons, NAD+. Assim, o NADH deve ser continuamente oxidado de volta ao NAD+ a fim de manter esta etapa em andamento. Se o NAD+ não estiver disponível, a segunda metade da glicólise desacelera ou pára. Se houver oxigênio disponível no sistema, o NADH será oxidado prontamente, embora indiretamente, e os elétrons de alta energia do hidrogênio liberado neste processo serão usados para produzir ATP. Em um ambiente sem oxigênio, um caminho alternativo (fermentação) pode fornecer a oxidação do NADH para NAD+.
Passo 7. No sétimo passo, catalisado pelo fosfoglicérato quinase (uma enzima chamada para a reação reversa), o 1,3-bisfosfoglicérato doa um fosfato de alta energia ao ADP, formando uma molécula de ATP. Um grupo carbonilo no 1,3-bisfosfoglicerato é oxidado para um grupo carboxilo, e o 3fosfoglicerato é formado.
Passo 8. No oitavo passo, o restante do grupo fosfato no 3-fosfoglicerato passa do terceiro carbono para o segundo carbono, produzindo o 2-fosfoglicerato (um isômero do 3-fosfoglicerato). A enzima que catalisa esta etapa é uma mutase (isomerase).
Passo 9. A enolase catalisa o nono passo. Esta enzima provoca a perda de água da sua estrutura pelo 2-fosfoglicérato; esta é uma reacção de desidratação, resultando na formação de uma dupla ligação que aumenta a energia potencial na ligação fosfato remanescente e produz fosfoenolpiruvato (PEP).
Passo 10. O último passo na glicólise é catalisado pela enzima piruvato quinase (a enzima neste caso é denominada para a reação reversa da conversão do piruvato em PEP) e resulta na produção de uma segunda molécula de ATP por fosforilação em nível de substrato e o ácido pirúvico composto (ou sua forma salina, piruvato). Muitas enzimas em vias enzimáticas são nomeadas para as reacções inversas, uma vez que a enzima pode catalisar tanto reacções directas como inversas (estas podem ter sido descritas inicialmente pela reacção inversa que ocorre in vitro, sob condições não fisiológicas).
A reacção líquida na transformação da glucose em piruvato é:
Assim, são geradas duas moléculas de ATP na conversão da glucose em duas moléculas de piruvato.
Nota que a energia liberada na conversão anaeróbica da glicose em duas moléculas de piruvato é -21 kcal mol-1 (- 88 kJ mol-1).