- O que é uma Ligação Covalente Polar?
- Propriedades de ligações polares covalentes
- Exemplos de ligações polares covalentes
- Água (H2O)
- Cloreto de hidrogênio (HCl)
- Amoníaco (NH3)
- Brometo de hidrogénio (HBr)
- Diferença entre Ligações Covalentes Polares e Não Polares
- Ligação Covalente Polar vs. Ligação Covalente Não-Polar
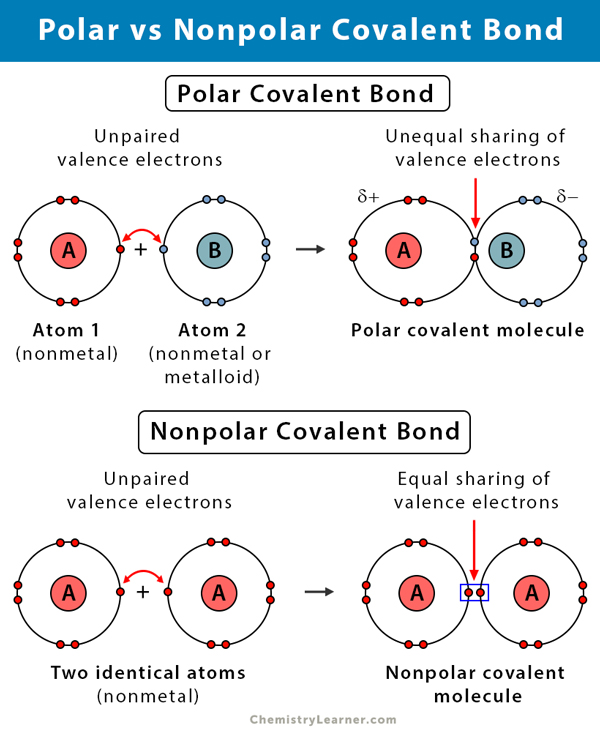
O que é uma Ligação Covalente Polar?
Uma ligação covalente é formada quando dois átomos compartilham elétrons entre eles. A ligação covalente é provável que seja polar quando os elétrons são desigualmente compartilhados. A ligação covalente surge devido à diferença nas electronegatividades dos dois átomos. A eletronegatividade é uma medida da tendência de um átomo para atrair um par de elétrons de ligação. É medida usando uma escala conhecida como escala de Pauling e varia de 0,7 a 4. A tabela seguinte explica o tipo de ligação química formada devido a esta diferença de eletronegatividade.
| Tipo de ligação química | Diferença de eletronegatividade |
|---|---|
| Covalente não polar | 0 |
| Ligeiramente covalente polar | 0.1 a 0,4 |
| Covalente polar | 0,5 a 2 |
| Iónico | > 2 |
Quanto mais significativa for a diferença na electronegatividade, maior é a polaridade e a força de ligação. Assim, as ligações polares covalentes têm uma força de ligação intermédia.
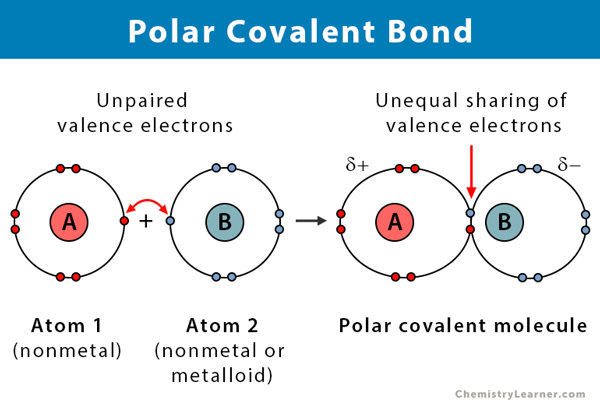
Propriedades de ligações polares covalentes
Aqui estão alguns factos sobre as ligações polares covalentes.
>
- Tem lugar entre dois não metálicos ou entre um não metálico e um metalóide
- Partilha desigual de electrões num composto
- Diferença de electro-negatividade entre átomos está entre 0.1 e 2
- Uma extremidade da ligação é carregada positivamente e a outra é carregada negativamente
- Os compostos polares dissolvem-se num solvente polar
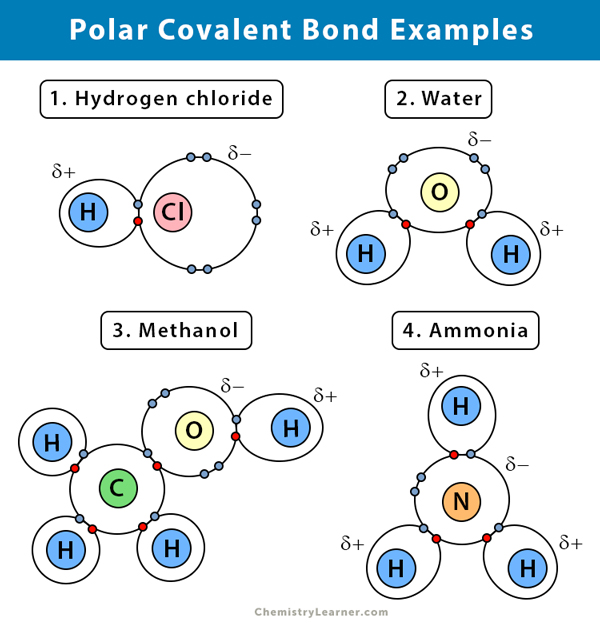
Exemplos de ligações polares covalentes
Aqui estão alguns exemplos de uma ligação polar covalente com a diferença de electronegatividade entre os dois átomos de ligação:
| Nome Completo | Fórmula Molecular | Bond | Electronegatividade diferença |
|---|---|---|---|
|
Água |
H2O |
O-H | |
| Fluoreto de hidrogênio | HF | H-F | 1.9 |
| Cloreto de hidrogênio | HCl |
H-Cl |
0.9 |
|
Brometo de hidrogênio |
HBr |
H-Br |
|
|
Ammonia |
NH3 |
N-H |
|
|
Dióxido de enxofre |
SO2 | S=O | 1 |
| Sulfureto de hidrogénio | H2S | H-S | 0.4 |
| Metanol | CH3OH | O-H | 1.4 |
A explicação da ligação covalente polar em alguns compostos é dada abaixo.
Água (H2O)
Água é um solvente polar. Uma ligação polar covalente é criada quando o átomo de oxigénio (O), sendo mais electronegativo que o hidrogénio, puxa os electrões partilhados para si próprio. Como resultado, o átomo de oxigênio tem uma carga parcialmente negativa associada a ele. Os hidrogênios (H), por outro lado, são essencialmente prótons e têm uma carga parcialmente positiva associada a eles.
Cloreto de hidrogênio (HCl)
Cloreto de hidrogênio é um composto polar covalente já que o átomo de cloro (Cl) é mais eletronegativo que o átomo de hidrogênio (H). Portanto, o cloro carrega uma carga parcialmente negativa, enquanto o hidrogênio carrega uma carga parcialmente positiva.
Amoníaco (NH3)
Amoníaco é uma molécula polar. O átomo central, nitrogênio (N), está ligado a três átomos de hidrogênio (H). Como N é mais electronegativo que H, os electrões tenderão a pendurar em torno do átomo N.
Brometo de hidrogénio (HBr)
A diferença de electronegatividade entre hidrogénio (H) e bromo (Br) não é demasiado elevada. Portanto, o gás HBr tem uma ligação covalente polarizada, e o átomo de hidrogênio tem uma leve carga positiva, e o bromo tem uma leve carga negativa. Como resultado, o par de elétrons é atraído pelo bromo.
Diferença entre Ligações Covalentes Polares e Não Polares
A tabela seguinte compara e contrasta as ligações covalentes polares e não polares.
Ligação Covalente Polar vs. Ligação Covalente Não-Polar |
||
| Polar | Não-Polar | |
|---|---|---|
|
Tipos de átomos |
Entre dois não-metálicos com diferentes eletronegatividades |
Entre dois não metais da mesma eletronegatividade |
|
Diferença de eletronegatividade |
0.1 – 2 |
|
|
Distribuição de elétrons |
Asymmetrical. Partilha desigual. |
Symmetrical. Partilha igual. |
|
Deslocamento de electrões partilhados |
Para o átomo mais electronegativo, tornando essa parte negativa |
Sem deslocamento. Eletricamente neutro. |
|
Momento dipolo |
Não-zero |
Zero |
|
Presença de outros tipos de ligações em compostos |
Ligação ao hidrogénio |
Van der Waals bond |
|
Afinidade para a água |
Hidrofílica |
Hidrofóbica |
|
Propriedades físicas dos compostos |
>
Fusão elevada e pontos de ebulição |
Baixa volatilidade |
|
Volatilidade dos líquidos |
>Baixa volatilidade |
>Alta volatilidade |
|
Solubilidade dos compostos |
Solúvel em solventes polares |
Solúvel em solventes não polares |
|
Exemplos |
Água (H2O), amônia (NH3) e cloreto de hidrogênio (HCl) |
Hidrogênio (H2), oxigênio (O2) e nitrogênio (N2) |