US Pharm. 2012;37(6):26-29.
Doença renal crônica (DRC) é definida como lesão renal persistente acompanhada de redução da taxa de filtração glomerular (TFG) e da presença de albuminúria. A prevalência de CKD tem aumentado de forma constante nas últimas duas décadas e foi relatada para 13% da população dos EUA em 2004.1 Em 2009, mais de 570.000 pessoas nos Estados Unidos foram classificadas como portadoras de doença endógena (DRCT), incluindo quase 400.000 pacientes de diálise e mais de 17.000 receptores de transplante.2 Um paciente está determinado a ter DRCT quando necessita de terapia de substituição, incluindo diálise ou transplante renal. O aumento da incidência de DRC é atribuído a uma população idosa e aumenta a hipertensão arterial sistêmica (HTN), diabetes e obesidade dentro da população dos EUA. O CKD está associado com uma série de complicações, incluindo desequilíbrios eletrolíticos, distúrbios minerais e ósseos, anemia, dislipidemia e HTN. É bem conhecido que o CKD é um fator de risco para doença cardiovascular (DCV), e que a redução da taxa de filtração glomerular e a albuminúria estão independentemente associadas ao aumento da mortalidade incardiovascular e de todas as causas.3,4
HTN tem sido relatada para ocorrer em 85% a 95% dos pacientes com DCV (estágios 3-5).5 A relação entre o HTN e o CKD é cíclica por natureza. OHTN não controlado é um fator de risco para o desenvolvimento de CKD, está associado a uma progressão mais rápida da CKD e é a segunda causa principal de DRCT nos EUA.6,7 Entretanto, a doença renal progressiva pode exacerbar a expansão descontrolada da HTN devido à expansão volêmica e ao aumento da resistência vascular sistêmica.4 Múltiplas diretrizes discutem a importância de diminuir a pressão arterial (PA) para retardar a progressão da doença renal e reduzir a morbidade e mortalidade cardiovascular.8-10 No entanto, para alcançar e manter o controle adequado da PA, a maioria dos pacientes com DRC requer a combinação de agentes anti-hipertensivos; muitas vezes até três ou quatro classes de fármacos podem precisar ser empregadas.11
Patofisiologia
Hipertensão arterial é uma das principais causas de DCK devido aos efeitos deletérios que o aumento da PA tem sobre a vasculatura renal.12,13 Os danos ao aglomerúlo levam a um aumento da filtração protéica, resultando em quantidades inabituais de proteína na urina (microalbuminúria ou proteinúria).12,13 Microalbuminúria é a apresentação de pequenas quantidades de albumina na urina e é frequentemente o primeiro sinal deCKD. A proteinúria (relação proteína/criinina ≥200 mg/g) desenvolve-se como CKDprogressa, e está associada a um mau prognóstico tanto para a riquidise quanto para a DCV.3,4,14
Como discutido anteriormente, a relação entre CKD eHTN é cíclica, pois a CKD pode contribuir ou causar HTN. A PA elevada leva à lesão dos vasos sanguíneos dentro do rim, assim como em todo o corpo. Esse dano prejudica a capacidade do rim de filtrar fluido e resíduos do sangue, levando a um aumento do volume de fluido no sangue – causando um aumento da PA.
Estagio da CKD
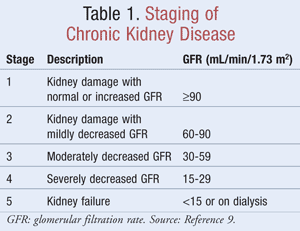
A TFG estimada, que ajuda os clínicos a determinar o quanto os rins estão filtrando resíduos, é usada no estadiamento da CKD. A National Kidney Foundation define CKD como lesão renal, identificada por marcadores na urina ou no sangue ou por imagens, com ou sem alterações na TFG, ou uma TFG <60 mL/min/1,73 m2 por um mínimo de 3 meses.9 A Tabela 1 descreve os critérios de estadiamento conforme determinado pelas diretrizes da Kidney Disease Outcomes Quality Initiative (K/DOQI).9
>
Goals of Therapy
>
Patientes com CKD não diabéticos e diabéticos devem ter uma meta de PA de <130/80 mmHg.8-10A manutenção do controle da PA e a minimização da proteinúria em pacientes com CKD e HTN é essencial para a prevenção da progressão da desidratação renal e do desenvolvimento ou piora da DCV.8,9
A literatura recente sugere que os alvos da PA em pacientes com CKD diabéticos e não diabéticos podem precisar ser individualizados com base na presença de proteinúria. Alguns estudos falharam em mostrar uma redução dos resultados incardiovasculares ou renais em pacientes diabéticos e não diabéticos com DCK quando um objetivo de PA de <130/80 mmHg é alcançado, comparado com a PA com tolerância de <140/90 mmHg.15,16 Entretanto, pacientes que têm proteinúria têm menor probabilidade de experimentar um declínio na renalfunção, insuficiência renal ou morte quando o objetivo de PA mais baixa é alcançado.15,17É provável que as orientações futuras possam incluir uma meta de PA inferior,<130/80 mmHg, para pacientes com proteinúria, mas manter uma meta de<140/90 mmHg para pacientes sem proteinúria.
Tratamento
Agentes que não só reduzem a PA mas também reduzem a proteinúria são recomendados como terapia de primeira linha para a maioria dos pacientes com CKD eHTN; os dados indicam que pode haver benefícios significativos a longo prazo, tanto nos resultados cardiovasculares como renais, quando a proteinúria é diminuída.9Várias classes de agentes anti-hipertensivos podem ter um papel no tratamento do CKD e HTN. Agentes que têm como alvo o sistema terenina-angiotensina-aldosterona (RAAS), como inibidores da enzima conversora da angiotensina (ECA) ou bloqueadores dos receptores da angiotensina (ARBs), são geralmente considerados anti-hipertensivos de primeira linha para esta população de pacientes.8,9,18 A TABELA 2 fornece orientações sobre agentes anti-hipertensivos recomendados para pacientes com CKD com ou sem diabetes e com ou sem proteinúria.
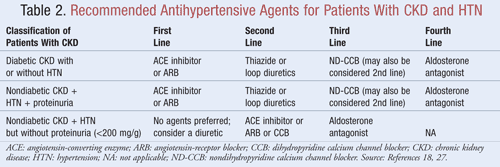
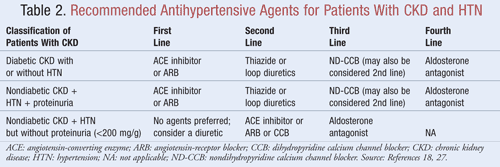
ACE Inibidores ou ARBs: Estudos demonstraram que os agentes anti-hipertensivos que têm como alvo a renina-angiotensina no sistema de prevenção do declínio renal são mais eficazes do que outros agentes, mesmo quando se atingem metas de PA semelhantes.19 Estes resultados foram encontrados principalmente em pacientes internados com proteinúria, enquanto o benefício foi menos substancial sem proteinúria. Com base nesses achados, as diretrizes recomendam o inibidorACE ou a terapia com ARB como tratamento de primeira linha para aqueles que apresentam doença renal não diabética, HTN e proteinúria. Dados indicam que os inibidores da ECA e as BRA são igualmente eficazes em diminuir a PA e reduzir a proteinúria.20 Uma análise recente da meta-análise sugere que a terapia com inibidores da ECA pode fornecer benefício superior à terapia com BRA para o tratamento da HTN devido a uma redução de 10% na mortalidade por todas as causas.21 Estes resultados foram determinados para pacientes com HTN e não se aplicaram a pacientes com co-morbidades adicionais, como a CKD. Portanto, a seleção de um agente sobre outro dependerá de fatores específicos do paciente, como potencial para efeitos colaterais e custo. O tratamento com um inibidor da ECA e uma ARB não é recomendado, uma vez que esta combinação mostrou piorar a função renal. A combinação de inibidor da ECA e terapia com ARB não reduziu a mortalidade ou morbidade cardiovascular em comparação com a monoterapia de um inibidor da ECA.20,21
ACE inibidores e ARBs são geralmente bem tolerados. Os inibidores da ECA podem causar tosse seca, o que infelizmente muitas vezes requer uma dor na terapia. As ARBs não estão associadas à tosse seca. O angioedema é muito raro; entretanto, pacientes iniciados com inibidores da ECA ou BRA devem ser informados sobre os sinais e sintomas que podem se apresentar com angioedema. Informar aos pacientes que o angioedema é improvável, mas se eles experimentarem angioedema na face (muitas vezes incluindo as pálpebras) e/ou extremidades, eles devem interromper o tratamento e procurar atenção médica imediatamente.18
Tiazida vs. Diuréticos de Loop: Para os pacientes sem proteinúria, uma terapia de primeira linha preferida não foi claramente estabelecida, e outros agentes, como a tiazida, podem ser considerados. Pacientes com CKD e HTN frequentemente experimentam retenção de líquidos ou sobrecarga de líquidos. Como resultado, os diuréticos são frequentemente necessários no seu regime de tratamento. Tiazidas são recomendadas para pacientes com DRC de 1 a 3 (TFG ≥30 mL/min), e têm sido estabelecidas como agentes efetivos para redução do risco de PA e DCV.22 Diuréticos em laço recomendados para pacientes com DRC de estágio 4 ou 5 (TFG <30 mL/min), a asthey tem se mostrado mais efetiva na redução do volume de fluido extracelular em pacientes com TFG gravemente reduzida.18 Entretanto, o efeito a longo prazo dos diuréticos de loop em resultados cardiovasculares não foi claramente estabelecido.23
Diuréticos de tiazida (clortalidona, hidroclorotiazida) e diuréticos de loop (bumetanida, furosemida, torsemida), todos causehyperuricemia (aumento da micção). Este aumento na perda de líquidos pode levar a um desequilíbrio electrolítico. É importante que os pacientes com esses agentes tenham seus eletrólitos monitorados para garantir que eles observem anormalidades eletrolíticas, como hipercalemia ou hipipomagnesemia. A hipotensão ortostática pode ocorrer em resposta a quaisquer agentes anti-hipertensivos; no entanto, é comum com os diuréticos. É importante aconselhar os pacientes que iniciam a terapia diurética sobre a necessidade de torturar lentamente a partir de uma posição sentada ou deitada.24,25
Calcium Channel Blockers: Os bloqueadores dos canais de cálcio (CCBs) são considerados terapia de segunda ou terceira linha no tratamento de HTN em pacientes com CKD.8,9Embora não possa haver diferença no efeito sobre a PA da redução da CCBs de não dihidropiridina (ND-CCBs; por exemplo, diltiazem, verapamil) e CCBs de dihidropiridina (por exemplo amlodipina, nifedipina), as ND-CCBs têm sido mostradas para reduzir significativamente a proteinúria quando usadas sozinhas ou incombinadas com um inibidor da ECA ou uma ARB.26 Como seu potencial para reduzir a proteinúria, além de seus efeitos anti-hipertensivos, as ND-CCBs devem ser consideradas como terapia de segunda ou terceira linha em pacientes com CKD diabéticos ou CKD não diabéticos com proteinúria. Os CCBs dihidropiridina podem ser usados como agentes de segunda linha em pacientes com CKD nondiabéticos sem proteinúria. Efeitos adversos comuns incluem edema e constipação com ND-CCBs (especialmenteverapamil) e rubor e edema periférico com diidropiridineagentes.18
Antagonistas de aldosterona: Aldosterona desempenha um papel severamente deletério na progressão do CKD. Antagonistas aldosteronereceptores (por exemplo, espironolactona, eplerenona) podem ter um lugar no papel da terapia com CKD quando as metas de PA não foram alcançadas com a terapia de primeira e segunda linha. Estes agentes mostraram em humantriais uma redução na proteinúria quando adicionados a um inibidor da ECA ou ARB.27,28
Antagonistas da aldosterona são diuréticos que economizam potássio, o que aumenta o risco de hipercalemia, particularmente se tomados com um inibidor da ECA ou ARB. É importante que os pacientes iniciados com diuréticos hipercalóricos tenham seus níveis de potássio verificados para garantir que não sofram anormalidades eletrolíticas. Os sintomas de hipercalemia incluem arritmia cardíaca e fraqueza muscular grave. Infelizmente, a hipercalemia pode se apresentar assintomática, o que destaca a importância da monitorização.18,27
Inibidor de Renina: Aliskiren é o único inibidor de renina atualmente disponível no mercado. Ele é indicado para o tratamento de HTN como monoterapia ou como terapia combinada comvalsartan. Dados recentes do ensaio ALTITUDE levaram a uma contra-indicação do seu uso com inibidores da ECA ou BRA em pacientes com retirada de diabetes ou comprometimento renal (TFG <60 mL/min) devido ao aumento do risco de comprometimento renal, hipotensão e hipercalemia.29Aliskiren pode ser considerado se o paciente não puder tomar um inibidor da ECA ou BRA; entretanto, seu uso não pode ser recomendado em pacientes com insuficiência renal em estágio4 ou 5.30
Beta-Blockers: Os dados que avaliam o efeito dos betabloqueadores na progressão da CKD e proteinúria são limitados.27 Embora os betabloqueadores não estejam incluídos na TABELA 2, esses agentes podem ser considerados como terapia de segunda ou terceira linha se o paciente tiver uma indicação convincente para um betabloqueador, como doença coronariana ou insuficiência cardíaca crônica.18
Nonfarmacologia Recomendações
Cronoterapia: Este tipo de terapia leva em consideração padrões circadianos de PA, e institui a administração de medicamentos anti-hipertensivos em relação aos padrões diários, passando da administração de todos os medicamentos anti-hipertensivos na manhã. Estudos adicionais identificaram benefícios da administração noturna de outras medicações anti-hipertensivas como inibidores da ECA ou BAR.33,34 A cronoterapia pode justificar alguma reflexão para aqueles incapazes de alcançar seu objetivo de PA quando administram todos os agentes anti-hipertensivos pela manhã. Se os pacientes tomam mais de dois agentes anti-hipertensivos, pode ser apropriado administrar dois agentes pela manhã e os agentes adicionais na convecção.
Modificação do estilo de vida: O aumento da atividade física, perda de peso e modificações dietéticas são recomendados para todos os pacientes com HTN.8A modificação do estilo de vida continua sendo um componente crítico da terapia para HTN, independentemente de os pacientes necessitarem de medicamentos para atingir seus objetivos de BP. A dieta Dietary Approaches to Stop Hypertension (DASH) enfatiza um aumento no consumo de frutas e vegetais, inclusão de baixo teor de gordura e proteína magra, e uma restrição de gorduras saturadas; este plano alimentar tem mostrado uma redução significativa da PA sistólica quase equivalente à redução alcançada pela monoterapia anti-hipertensiva.35 Além disso, a diminuição da ingestão de sódio e álcool tem sido estabelecida como uma intervenção efetiva para diminuir a PA.8Iniciar essas práticas dietéticas saudáveis enquanto aumenta a atividade diária aumenta o benefício recebido da terapia anti-hipertensiva e pode desempenhar um papel essencial no alcance dos objetivos da PA.
Sumário
A inter-relação entre CKD e HTN leva a uma maior ênfase na importância de alcançar o controle da PA e a diminuição da proteinúria, se presente. Os agentes que reduzem a proteinúria além da PBP são geralmente de primeira linha, mas os pacientes podem freqüentemente necessitar de três tofo de nossos agentes anti-hipertensivos para atingir seus objetivos e minimizar seu risco de DCV e DRCT. Além disso, as modificações do estilo de vida saudável devem ser sempre consideradas como um componente vital de qualquer regime de terapia anti-hipertensiva.
1. Coresh J, Selvin E, Stevens LA, et al. Prevalência de doença renal crônica nos Estados Unidos. JAMA. 2007;298:2038-2047.
2. Collins AJ, Foley RN, Chavers B, et al. U.S. renal data system 2011 annual data report. Am J Kidney Dis. 2012;59(suppl 1):evii.
3. Matsushita K, van der Velde M, Astor BC, et al.Association of estimated glomerular filtertion rate and albuminuria withall-cause and cardiovascular mortality in general population cohorts: acollaborative meta-analysis. Lanceta. 2010;375:2073-2081.
4. Rashidi A, Sehgal AR, Rahman M, O’Connor AS. O caso de doença renal crônica, diabetes mellitus e infarto do miocárdio são fatores de risco equivalentes para mortalidade cardiovascular em pacientes com mais de 65 anos de idade. Am J Cardiol. 2008;102:1668-1673.
5. Rao MV, Qiu Y, Wang C, Bakris G. Hypertension e CKD:Kidney Early Evaluation Program (KEEP) e National Health and NutritionExamination Survey (NHANES), 1999-2004. Am J Kidney Dis. 2008;51(suppl 2):S30-S37.
6. Botdorf J, Chaudhary K, Whaley-Connell A. Hypertension in cardiovascular and kidney disease. Med. cardiorrenal. 2011;1:183-192.
7. Segura J, Ruilope L. Hipertensão arterial em pacientes CKD não-diabéticos moderados a graves. Adv Chronic Kidney Dis. 2011;18:23-27.
8. Chobanian AV, Bakris GL, Black HR, et al. The seventhreport of the Joint National Committee on Prevention, Detection,Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA. 2003;289:2560-2572.
9. Fundação Nacional do Rim. K/DOQI clinical practiceguidelines for chronic kidney disease: evaluation, classification, andstratification. Am J Kidney Dis. 2002;39(suppl 1):S1-S266.
10. Associação Americana de Diabetes. Standards of medical care in diabetes-2012. Diabetes Care. 2012;35(suppl 1):S1-S63.
11. Bakris GL, Williams M, Dworkin L, et al. Preservingrenal function in adults with hypertension and diabetes: a consensusapproach. National Kidney Foundation Hypertension and Diabetes ExecutiveCommittees Working Group (Grupo de Trabalho sobre Hipertensão Arterial e Diabetes). Am J Kidney Dis. 2000;36:646-661.
12. Keane WF, Eknoyan G. Proteinuria, albuminúria, risco,avaliação, detecção, eliminação (PARADE): um documento de posição para a Fundação Nacional do Rim. Am J Kidney Dis. 1999;33:1004-1010.
13. Yoshioka T, Rennke HG, Salant DJ, et al. Role ofabnormally high transmural pressure in the permselectivity defect of permselectivity of aglomerular capillary wall: a study in early passive Heymann nephritis. Circ Res. 1987:61:531-538.
14. Sarnak M, Levey A, Schoolwerth A, et al. Kidneydisease como fator de risco para o desenvolvimento de doença cardiovascular: astatement from the American Heart Association Councils on Kidney inCardiovascular Disease, High Blood Pressure Research, ClinicalCardiology, and Epidemiology and Prevention. Circulação. 2003;108:2154-2169.
15. Upadhyay A, Earley A, Haynes SM, Uhlig K. Systematicreview: blood pressure target in chronic kidney disease and proteinuriaas an effect modifier. Ann Intern Med. 2011;154:541-548.
16. Cushman C, Evan GW Byington RP, et al. The ACCORDstudy group. Controlo intensivo da pressão sanguínea em diabetesmellitus tipo 2. N Engl J Med. 2010;363:1575-1585.
17. Brenner BM, Cooper ME, De Zeeuw D, et al. Effects oflosartan on renal and cardiovascular outcomes in type 2 diabetes andnephropathy. N Engl J Med. 2001;345:861-869.
18. K/DOQI – K/DOQI clinical practice guidelines on hypertension and antihypertensiveagents in chronic kidney disease. Am J Kidney Dis. 2004;43(suppl 1):S1-S290.
19. Remuzzi G, Chiurchiu C, Ruggenenti P. Proteinuria predizendo desfecho em doença renal: nefropatias nondiabéticas (REIN). Sup. Int. Rim. 2004;66:S90-S96.
20. Sharma P, Blackburn RC, Parke CL, et al.Angiotensin-converting enzyme inhibitors and angiotensin receptorblockers for adults with early (stage 1 to 3) noniabetic chronickidney disease. Cochrane Database Syst Rev. 2011;(10):CD007751.
21. van Vark LC, Bertrand M, Akkerhuis KM, et al.Angiotensin-converting enzyme inhibitors reduce mortality inhypertension: a meta-analysis of randomized clinical trials ofrenin-angiotensin-aldosterone system inhibitors involving 158,998patients. Eur Heart J. 2012 Abr 17; Epub ahead of print.
22. Principais resultados em pacientes hipertensivos de alto riscorandomizados a inibidor da enzima conversora da angiotensina ou bloqueador do canal de cálcio versus diurético: o tratamento anti-hipertensivo e lipídico para prevenir o ensaio de ataque cardíaco (ALLHAT). JAMA. 2002;288:2981-2997.
23. Musini VM, Wright JM, Bassett K, Jauca CD. Eficácia na redução da pressão arterial de diuréticos de loop para hipertensão primária. Cochrane Database Syst Rev. 2009;(4):CD003825.
24. Inserção da embalagem de microzida (cápsulas orais de hidroclorotiazida). Watson Pharma, Inc: Morristown, NJ; 2011.
25. Pasta de comprimidos de cloretalidona oral inserida. Mylan Pharmaceuticals, Inc.: Mylan Pharmaceuticals, Inc.: Mylan Pharmaceuticals, Inc: Morgantown, WV; 2006.
26. Bakris GL, Weir MR, Secic M, et al. Efeitos diferenciais das subclasses antagonistas do cálcio sobre os marcadores de nefropatiaprogressão. Kidney Int. 2004;65:1991-2002.
27. Navaneethan SD, Nigwekar SU, Sehgal AR, et al.Aldosterone antagonists for preventing the progression of chronic kidneydisease. Clin J Am Soc Nephrol. 2009;4:542-551.
28. Mehdi UF, Adams-Huet B, Raskin P, et al. Adição de bloqueio do receptor de angiotensina ou antagonismo mineralocorticóide à inibição da enzima conversora de maximalangiotensina na nefropatia diabética. J Am Soc Nephrol. 2009;20:2641-2650.
29. Medicamentos contendo Aliskiren: comunicação de segurança do medicamento – nova advertência e contra-indicação. MedWatch.20 de abril de 2012.www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm301120.htm?source=govdelivery;4/20/2012.Acesso em 1 de maio de 2012.
30. Trimarchi H. Papel do aliskiren no controle da pressão arterial e na renoproteção. Int J Nephrol Renovasc Dis. 2011;4:41-48.
31. Portaluppi F, Vergnani L, Manfredini R, et al.Time-dependent effect of isradipine on the nocturnal hypertension inchronic renal failure. Am J Hypertens. 1995;8:719-726.
32. Hermida RC, Calvo C, Ayala DE, et al. Dose e efeito dependente do tempo de administração do GITS nifedipina sobre a pressão sanguínea ambulatorial em indivíduos hipertensos. Chronobiol Int. 2007;24:471-493.
33. Hermida RC, Ayala DE. Chronotherapy with theangiotensin-converting enzyme inhibitor ramipril in essentialhypertension: improved blood pressure control with bedtime dosing. Hipertensão arterial. 2009;54:40-46.
34. Hermida RC, Calvo C, Ayala DE, et al. Efeitos dependentes do tempo de administração de valsartan em sujeitos ambulatoriais em hipertensão arterial. Hipertensão arterial. 2003;42:283-290.
35. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects onblood pressure of reduced dietary sodium and the Dietary Approaches toStop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group.N Engl J Med. 2001;344:3-10.