- Introduction
- Métodos
- Dados de Distribuição e Classificação do Bioma
- Composição das Espécies entre Biomas
- Dados de Tráfego
- Medição de Hipervolumes de Traço
- Distinção funcional e amplitude
- Espaço funcional e similaridade do bioma
- Discussão
- Informações de conhecimento
- Padrões comuns dentro dos biomas
- Comparações entre biomas
- Conclusões
- Data Availability
- Author Contributions
- Funding
- Conflict of Interest Statement
- Acknowledgments
- Material Suplementar
Introduction
Ecologistas e biogeógrafos organizam a biodiversidade das plantas terrestres em biomas determinados pelo clima, com fisionomias caracterizadas pelas formas de crescimento e características funcionais das espécies dominantes (Moncrieff et al., 2016). Na verdade, o conceito de bioma tem uma longa história que remonta a Carl Ludwig Willdenow e Alexander von Humboldt. Willdenow reconheceu que climas semelhantes suportam formas de vegetação semelhantes, e Humboldt observou a associação generalizada entre a distribuição das plantas, fisionomia e fatores ambientais. Em geral, o conceito de bioma reflete a suposição de que pressões ambientais similares selecionam para espécies com atributos funcionais similares, independentemente de sua história evolutiva. Ao mesmo tempo, os biomas existentes na Terra são, até certo ponto, filogenéticamente distintos, com muitas/mais das espécies características sendo extraídas de linhagens específicas exibindo adaptações chave não apenas para a seleção climática, mas para pressões adicionais como fogo ou megaherbívoros (Woodward et al., 2004; Pennington et al., 2006; Donoghue e Edwards, 2014). Como os biomas representam regularidades em larga escala na vegetação da Terra, compreender as diferenças funcionais entre os biomas é criticamente importante para modelar o ciclo global do carbono e o funcionamento do sistema Terra, incluindo respostas a mudanças globais antropogênicas (Bonan et al.., 2012; van Bodegom et al., 2014; Xia et al., 2015).
As duas últimas décadas têm visto um rápido crescimento na compreensão da dimensão funcional da biodiversidade vegetal através de escalas continentais (Swenson et al., 2012; Lamanna et al., 2014; Símová et al., 2018). Extensos esforços de síntese e análise de dados definiram um espaço limitado de características funcionais incorporando variação no tamanho geral das plantas, economia foliar e hidráulica, conhecidos como espectros de características funcionais (Wright et al., 2004; Díaz et al., 2016). Os espectros de traços funcionais definem trade-offs fisiológicos e ecológicos que determinam estratégias de história de vida das plantas (Westoby, 1998; Reich et al., 2003; Craine, 2009) e sua influência na montagem comunitária (Kraft et al., 2008), função do ecossistema (Lavorel e Garnier, 2002; Garnier et al., 2004; Kerkhoff et al., 2005; Cornwell et al., 2008), e até mesmo taxas de evolução (Smith e Donoghue, 2008; Smith e Beaulieu, 2009). A generalidade e utilidade dos espectros das características funcionais das plantas acelerou sua incorporação em modelos de distribuição global da vegetação (van Bodegom et al., 2014), ciclagem biogeoquímica (Bonan et al., 2012) e serviços ecossistêmicos (Díaz et al., 2007; Cadotte et al., 2011; Lavorel et al., 2011). Entretanto, poucos estudos examinaram medidas abrangentes da diversidade funcional na escala do bioma tanto em espécies dominantes e subordinadas quanto em formas de vida.
Existem dois conjuntos contrastantes de previsões sobre como a diversidade funcional varia entre biomas climática e fisionomicamente distintos. Por um lado, se a biodiversidade dos biomas reflete a variação no espaço de nicho ecológico disponível, biomas menos taxonomicamente diversos devem representar um subconjunto menor, em grande parte aninhado do espaço funcional ocupado por biomas mais diversos. Por outro lado, devido à natureza global de trade-offs fundamentais na estrutura e função das plantas, e pressões de seleção similares atuando de forma semelhante entre espécies, assemblages que ocupam ambientes diferentes podem de fato compartilhar áreas semelhantes de espaço de características (Reich et al., 2003; Wright et al., 2004; Díaz et al., 2016). Estudos recentes confirmam que as relações entre clima e diversidade funcional e taxonômica (ou seja, riqueza de espécies) são complexas e dependentes da escala. Em alguns casos, a diversidade funcional acompanha de perto os gradientes climáticos, com menor diversidade funcional em condições mais variáveis e extremas (Swenson et al., 2012; de la Riva et al., 2018), e o volume do espaço funcional em assemblages locais se expande com o aumento da riqueza taxonômica (Lamanna et al., 2014; Li et al., 2018). Entretanto, análises de conjuntos de espécies em escala regional sugerem que grandes mudanças na riqueza de espécies podem estar associadas a impactos mínimos na diversidade funcional (Lamanna et al., 2014; Símová et al., 2015). Além disso, as respostas da diversidade taxonômica e funcional ao clima podem diferir entre as principais formas de crescimento de plantas (Säimová et al., 2018), e a diversidade relativa de diferentes formas de crescimento pode mudar substancialmente ao longo dos gradientes climáticos que definem diferentes biomas (Engemann et al., 2016).
O progresso na análise da diversidade funcional em escalas continentais a globais tem sido limitado, em parte, pela falta de dados na catalogação dos aspectos taxonômicos, distributivos, filogenéticos e funcionais da biodiversidade (Hortal et al., 2015). Além disso, mesmo com os dados limitados disponíveis, desafios significativos de informática estão associados à padronização e integração de grandes e díspares conjuntos de dados que descrevem as distribuições geográficas, traços funcionais e relações filogenéticas das espécies (Violle et al., 2014). Aqui examinamos a distribuição da diversidade funcional das espécies de plantas pelos biomas da América do Norte e do Sul utilizando a base de dados da Rede de Informação Botânica e Ecologia (BIEN; Enquist et al., 2016; Maitner et al., 2018), que reúne informações distributivas e de características funcionais sobre >100.000 espécies de plantas terrestres. Especificamente, examinamos a variação na diversidade funcional e distintividade dos biomas, com base em mapas de distribuição de espécies de plantas terrestres em uma escala de 100 × 100 km de células de grade e um conjunto de dados abrangente de seis traços funcionais que refletem os principais eixos de variação nas estratégias ecológicas.
Nossos objetivos neste estudo são triplicados. Em primeiro lugar, a fim de destacar as persistentes deficiências de dados, documentamos a extensão dos dados disponíveis que caracterizam a diversidade funcional e a distintividade dos biomas. Em segundo lugar, dados os dados disponíveis, caracterizamos a distribuição da diversidade funcional dentro dos biomas, tanto nas formas de crescimento dominante como nas subordinadas. Estas análises permitem-nos quantificar melhor a distinção funcional de um bioma, identificando as estratégias funcionais mais comuns das espécies mais disseminadas no seu interior. Em terceiro lugar, perguntamos se os biomas são de fato caracterizados por coleções funcionalmente distintas de espécies, com base na sobreposição de hipervolumes multidimensionais no espaço de características funcionais.
Métodos
Dados de Distribuição e Classificação do Bioma
Para reduzir os efeitos do viés amostral característico dos conjuntos de dados de ocorrência compilados a partir de múltiplos recursos, utilizamos os mapas do intervalo BIEN 2.0 para 88.417 espécies de plantas distribuídas na América do Norte e do Sul (Goldsmith et al, 2016). A base de dados do BIEN integra observações padronizadas de plantas provenientes de espécimes de herbários e inventários de parcelas de vegetação. Os mapas de variação de espécies na base de dados BIEN foram estimados usando uma das três abordagens, dependendo das ocorrências disponíveis para cada espécie. Para espécies com apenas uma ou duas ocorrências (c. 35% das espécies), a área geográfica foi definida como uma área quadrada de 75.000 km2 em torno de cada ponto de dados. As faixas geográficas para espécies com três ou quatro ocorrências foram identificadas usando um casco convexo (c. 15% das espécies). Finalmente, os mapas de distribuição geográfica para espécies com pelo menos cinco ocorrências foram obtidos usando o algoritmo de modelagem da distribuição das espécies Maxent, usando 19 camadas climáticas como variáveis preditoras e 19 vetores próprios espaciais como filtros para restringir as previsões pelos modelos (ver Goldsmith et al, 2016 para mais detalhes sobre a metodologia do mapa de variação).
Sobrepomos os mapas de espécies de plantas BIEN 2.0 em um mapa de grade de 100 × 100 km com uma projeção de Lambert Azimuthal Equal Area para obter uma matriz de presença/ausência de espécies para cada quadrícula. Com base na classificação do bioma Olson et al. (2001), atribuímos cada matriz de quadrícula a uma das categorias de biomas. Devido a limitações computacionais para as análises subseqüentes, juntamos alguns biomas com base em suas semelhanças de clima e vegetação e literatura para obter uma classificação ampla como descrita na Tabela 1 (excluindo Água Interior, Rocha e Gelo e Manguezais). As eco-regiões Chaco e Caatinga foram classificadas como Xeric Woodlands e Dry forest, respectivamente, seguindo Prado e Gibbs (1993), Pennington et al. (2000), Banda et al. (2016), Silva de Miranda et al. (2018).
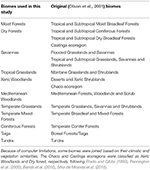
Tabela 1. Visão geral da classificação dos biomas adotada neste estudo e da classificação dos biomas equivalentes (Olson et al., 2001) (excluindo Água Interior, Rocha e Gelo e Mangues).
Composição das Espécies entre Biomas
Para entender a variação do espaço de características funcionais entre os biomas, exploramos primeiro as diferenças na composição das espécies vegetais entre eles. Com base na lista de espécies para cada quadrícula e bioma, definimos as espécies características de cada bioma como aquelas que têm a proporção máxima do seu alcance nesse bioma. Estas listas de espécies geograficamente predominantes num determinado bioma foram comparadas com a lista de espécies de outros biomas. Esta comparação em pares fornece uma forma simples de inferir uma sobreposição taxonómica direccional entre biomas (ou seja, a proporção de espécies predominantes de um bioma partilhado com outro bioma). Das 88.417 espécies com mapas de variação disponíveis, 44.899 espécies têm variações que abrangem mais de um bioma, e 43.518 espécies são endêmicas de um bioma específico.
Dados de Tráfego
Extraímos toda a informação de características de espécies de plantas no Novo Mundo disponível no conjunto de dados BIEN 3.0 (recuperado em 7 de fevereiro de 2018) dando um total de 80.405 observações de características de níveis de espécies. Filtramos então a informação para seis traços funcionais: altura máxima da planta (m), massa da semente (mg), densidade da madeira (mg/cm3), área específica de folhas SLA (cm2/g) e concentração de fósforo e nitrogênio foliar por unidade de massa (mg/g). Um total de 18.192 observações a nível de espécies foram deixadas após a filtragem. Destes, o subconjunto de 8.820 espécies com mapas de alcance e informações de traços foi usado para análises posteriores.
Para estimar o espaço de traços funcionais para cada bioma, necessitávamos de dados de traços completos. Por esta razão, nós imputamos filogenicamente os dados de traços ausentes (Bruggeman et al., 2009; Penone et al., 2014; Swenson, 2014; Swenson et al., 2017) usando o pacote R “Rphylopars” v 0.2.9 (Goolsby et al., 2017) e a filogenia de plantas de semente recentemente publicada por Smith e Brown (2018) como linha de base. A imputação filogenética é uma ferramenta para prever os dados em falta nos conjuntos de dados de características funcionais com base na suposição de que espécies estreitamente relacionadas tendem a ter valores de características semelhantes (Swenson, 2014). Utilizamos a árvore ALLBM (ou seja, banco de genes e árvore aberta de taxa de vida com uma espinha dorsal fornecida por Magallón et al., 2015) porque maximizou a sobreposição entre espécies com características disponíveis e informação distributiva. Após a imputação do traço, um total de 7.842 espécies com informação completa do traço e mapas de distribuição ficou para análise posterior.
Medição de Hipervolumes de Traço
Medimos a diversidade funcional relativa dos biomas através do cálculo de hipervolumes de traços de conjuntos de espécies dentro das células dos biomas. Devido a limitações computacionais, construímos os hipervolumes de traços usando uma amostra aleatória de 20% das células de cada bioma. Os hipervolumes para cada célula da grade foram estimados usando os seis traços funcionais extraídos e o pacote R “hipervolume” (Blonder et al., 2014, 2018), usando o método Gaussiano KDE com o estimador de largura de banda padrão Silverman. A massa da semente, altura e densidade da madeira foram transformadas em toras, enquanto o SLA foi transformado em raiz quadrada. Todos os traços foram escalados e centralizados antes da análise. Hipervolumes são relatados em unidades de desvio padrão (sd) para a potência para o número de traços utilizados (ou seja, sd6).
Distinção funcional e amplitude
Porque os biomas são caracterizados por sua vegetação dominante, também examinamos a comumidade geográfica e a distintividade funcional das espécies dentro dos biomas. Utilizando mapas de variedade de espécies e informações de traços funcionais, estimamos a distintividade funcional e a disseminabilidade de cada espécie em cada bioma, seguindo o quadro conceitual de raridade funcional de Violle et al. (2017). Usando todo o conjunto de características (medidas e imputadas), primeiro medimos a distância euclidiana no espaço de características padronizadas entre todos os pares de espécies. Em seguida, calculamos a distinção funcional (Di) para cada espécie em cada bioma como a distância funcional média de uma espécie para N outras espécies dentro do pool de espécies do bioma. Di foi escalado entre 0 e 1 dentro de cada bioma com valores mais baixos representando espécies que são funcionalmente comuns (redundantes) e valores mais altos representando espécies que são funcionalmente distintas, em comparação com as outras espécies do bioma. Também estimamos a amplitude geográfica (Wi) de uma espécie num bioma, medida como o número de células de grade ocupadas pela espécie dentro de um bioma sobre o número total de células desse bioma. Um valor de 1 indica que a espécie focal está presente em todas as células da grelha cobertas pelo bioma. Tanto a distinção funcional como a amplitude geográfica foram calculadas usando o pacote R “funrar” (Grenié et al., 2017).
Por falta de medidas abrangentes de dominância baseadas na abundância local ou biomassa, usamos as medidas Di e Wi para identificar para cada bioma as espécies mais “comuns” como as que estão tanto geograficamente disseminadas (Wi > 0,5) como funcionalmente semelhantes (Di < 0,25). Este último limiar foi utilizado desde o terceiro quantil de valores de diferenciação funcional entre os biomas, que variou de 0,2 a 0,3. Para discriminar espécies funcionalmente distintas vs. espécies funcionalmente semelhantes em análises subseqüentes, nós, portanto, usamos um valor de 0,25 como corte (i.e, espécies com valores distintivos < 0,25 foram consideradas funcionais comuns ou redundantes dentro de um bioma específico).
Espaço funcional e similaridade do bioma
Para estimar a sobreposição entre os hipervolumes dos biomas utilizamos o índice de similaridade de Sørensen usando (i) o número total de espécies e (ii) a lista de espécies consideradas como funcionalmente comuns e geograficamente disseminadas para cada bioma. A similaridade do espaço funcional foi calculada como a sobreposição fracional dos hipervolumes entre os biomas. A sobreposição fracionária foi calculada dividindo-se o dobro do volume da intersecção de dois hipervolumes pelo volume das suas uniões. Todos os hipervolumes foram estimados usando o “hipervolume” do pacote R (Blonder et al.(ver Figura 1, e Tabela Complementar 1). Esta sobreposição taxonómica é maior nos biomas tropicais e temperados, com relativamente poucas espécies a serem partilhadas entre estas duas zonas climáticas. Curiosamente, as florestas xéricas partilham espécies com ambos os biomas, tropical e temperado. Apesar da elevada proporção de espécies características das florestas tropicais húmidas (83%), este bioma também partilha um grande número de espécies com outros biomas tropicais, tais como florestas secas, savanas, bosques xericais e prados tropicais. A elevada sobreposição taxonómica de biomas temperados, tais como prados temperados, bosques mediterrânicos, taiga e tundra, sugere o potencial para uma baixa diferenciação funcional, com alguns biomas temperados a representarem um subconjunto mais pobre dos biomas tropicais mais ricos em espécies e com maior diversidade funcional.
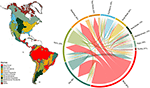
Figura 1. Sobreposição de espécies de plantas entre os biomas do Novo Mundo. Os valores percentuais expressam a fração de espécies que ocorrem em um bioma que tem a maior proporção de sua área geográfica nesse bioma, N = 84.413. A base de cada seta ramificada é posicionada para mostrar o bioma que inclui a maior proporção de uma faixa de espécies, enquanto a largura representa o número de espécies compartilhadas com os biomas nas pontas da seta. Veja a Tabela Complementar 1 para a matriz subjacente.
Com menos de 10% das espécies mapeadas representadas, os dados de características foram bastante esparsos para nossas assembléias de espécies em escala biológica (Figura 2A). Além disso, os dados de características disponíveis variaram substancialmente entre características, clades de plantas, e biomas. Filogenicamente, a densidade foliar P e a densidade da madeira foram particularmente mal representadas, faltando quaisquer dados disponíveis. Como resultado, dos aproximadamente 2/3 dos valores de traços para as nossas 7.842 espécies que tiveram que ser imputados, muitos tiveram que ser atribuídos na ausência de qualquer taxa intimamente relacionada. Geograficamente, SLA, altura e massa de sementes são subamostragens nos trópicos e na América do Sul temperada, enquanto o N foliar e a densidade de madeira são amostrados de forma mais uniforme entre as regiões. A Folha P é mal amostrada em todos os biomas. Os hipervolumes de traços criados a partir de grupos de espécies de uma selecção aleatória de 20% de células para cada bioma mostram principalmente diferenças entre biomas tropicais e temperados/frios (Figura 2B). Os hipervolumes de traços tendem a ser maiores e mais variáveis nos biomas tropicais, com a maior variação nas florestas tropicais húmidas e secas. Entre os biomas temperados/frios, a floresta mista conífera e temperada suporta os maiores hipervolumes de traços. Curiosamente, os arbustos xéricos apresentam uma distribuição de hiper-volumes mais semelhante aos tropicais do que aos biomas temperados.
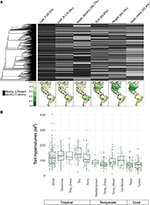
Figura 2. (A) Proporção de espécies na base de dados do BIEN 3.0 com valores de traços conhecidos (cinza) ou ausentes (preto). Phylogeny à esquerda corresponde à árvore de sementes ALLBM de Smith e Brown (2018) (ou seja, GenBank e Open Tree of life taxa com um backbone fornecido por Magallón et al., 2015). Os mapas representam a proporção de espécies com informação de características em relação ao número total de espécies na base de dados BIEN 2.0. (B) Distribuição dos hipervolumes de características de 20% de células de 100 × 100 km seleccionadas aleatoriamente em cada bioma. Hipervolumes são relatados em unidades de desvio padrão da potência do número de traços utilizados.
A relação entre a distintividade funcional e a distribuição geográfica é notavelmente similar entre os biomas (Figura 3). Em todos os biomas, a grande maioria das espécies são tanto geograficamente restritas como funcionalmente semelhantes. Ao mesmo tempo, as espécies mais funcionalmente distintas dentro de cada bioma também são geralmente restritas geograficamente, e as espécies mais disseminadas geograficamente são quase sempre funcionalmente semelhantes.
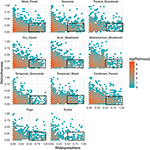
Figura 3. Padrões de distintividade funcional entre biomas. A distinguibilidade representa como as espécies estão funcionalmente distantes umas das outras dentro de um bioma (isto é, a distância fenotípica média ao par de uma espécie focal a todas as outras). Quanto maior o valor, mais distante está uma espécie do centróide do espaço funcional do bioma. A dispersão mede o quanto uma espécie é geograficamente comum dentro de um bioma. Um valor de 0 indica que uma espécie está presente em uma única célula do bioma. Os valores de posição são o número de espécies em uma escala de loge. Rectângulos representam as espécies consideradas funcionalmente semelhantes e disseminadas em cada bioma usando valores de 0,25 e 0,5 de distinguibilidade e disseminabilidade, respectivamente.
Encontramos variações consideráveis na distribuição proporcional das formas de crescimento dentro e entre os biomas. As espécies lenhosas representam as formas de crescimento dominantes nos biomas tropicais em termos de número de espécies, enquanto que as espécies herbáceas dominam em ambientes temperados (Figura 4). Quando consideramos apenas as espécies que são generalizadas e funcionalmente comuns em cada bioma, a distribuição das formas de crescimento pelos biomas mudou, especialmente na proporção de árvores, ervas e gramíneas. Por exemplo, nos biomas tropicais, a proporção de árvores diminuiu em cada bioma, exceto na floresta úmida. Nos biomas temperados, a proporção de gramíneas aumentou, especialmente em direção às regiões polares. Curiosamente, a distribuição das formas de crescimento nas matas xéricas assemelha-se mais à distribuição nos biomas temperados, quando apenas as espécies amplamente disseminadas e funcionalmente comuns são consideradas.
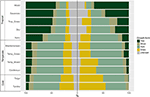
Figura 4. A distribuição das formas de crescimento em cada bioma (esquerda) usando o número total de espécies, e (direita) usando apenas as espécies que são funcionalmente semelhantes e disseminadas dentro do bioma (ver Figura 3).
Comparações da composição das espécies entre os biomas revelam três grupos principais representando as zonas climáticas tropicais, temperadas e polares (Figura 5A), refletindo a alta sobreposição taxonômica dentro, mas não entre, essas regiões (Figura 1). Comparações em pares de hiper-volumes de características entre os biomas mostram um agrupamento menos claro de zonas climáticas (Figura 5B). Neste caso, o espaço funcional das matas xéricas sobrepõe-se significativamente aos biomas temperados. Esta análise também revela a sobreposição no espaço funcional das taigás com os prados temperados e as florestas mistas. A comparação em pares dos hipervolumes de características entre os biomas utilizando apenas as espécies consideradas como funcionalmente comuns e generalizadas mostra uma menor sobreposição nos espaços de características entre e dentro das zonas climáticas (Figura 5C). No entanto, embora as florestas xéricas estejam agora agrupadas com o resto dos biomas tropicais, estes habitats juntamente com os prados tropicais apresentam uma grande sobreposição no espaço funcional com os biomas temperados, tais como as florestas mediterrânicas e os prados temperados.
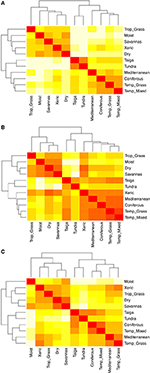
Figura 5. (A) Dissemelhança de pares na composição de espécies entre os biomas. (B) Dissemelhança de pares em hipervolumes de traços (1-Sørensen similaridade) entre os biomas usando o número total de espécies. (C) Dissemelhança de pares nos hipervolumes de características (semelhança de 1-Sørensen) entre biomas utilizando apenas as espécies consideradas funcionalmente semelhantes e disseminadas. Quanto mais leve a célula, maior a disparidade.
Discussão
As nossas análises produzem três importantes insights para a compreensão dos biomas terrestres através de uma lente funcional. Primeiro, mostramos que apesar do progresso na compilação e síntese de dados primários da biodiversidade, persistem deficiências significativas de conhecimento que podem limitar nossa capacidade de quantificar a biodiversidade funcional dos biomas em escala continental a global. Em segundo lugar, nossas análises dos dados disponíveis mostram que todos os biomas das Américas do Norte e do Sul compartilham um padrão comum notável no qual as espécies mais disseminadas geograficamente em qualquer bioma tendem a compartilhar traços funcionais comuns, enquanto as espécies mais funcionalmente distintas são invariavelmente restritas em sua distribuição. Em terceiro lugar, quando apenas as espécies disseminadas e funcionalmente comuns são consideradas, os biomas podem ser mais facilmente distinguidos funcionalmente, e os padrões de dissemelhança entre biomas parecem refletir uma correspondência entre clima e espaço de nicho funcional vegetal. Em conjunto, nossos resultados sugerem que, embora o estudo da diversidade funcional dos biomas ainda esteja em seus estágios formativos, um maior desenvolvimento do campo provavelmente produzirá insights ligando evolução, biogeografia, montagem da comunidade e função do ecossistema.
Informações de conhecimento
A base de dados BIEN foi projetada especificamente para fechar lacunas em nosso conhecimento da biodiversidade vegetal, mas, como Hortal et al. (2015) destacam, a interação das lacunas de conhecimento leva à incerteza na quantificação da biodiversidade em grandes escalas. Por exemplo, não só menos de 10% das nossas espécies mapeadas possuem dados de características e informações filogenéticas disponíveis, mas também os dados de características em falta (~66% dos valores de características das espécies) foram bastante estruturados, tanto filogenética como geograficamente. Assim, o défice Raunkiaeriano em dados de características funcionais (sensu Hortal et al., 2015) interage com o défice Wallacean em informação distributiva e o défice Darwiniano em conhecimento filogenético. E embora possamos usar o conhecimento filogenético para imputar razoavelmente esses valores em falta (Swenson et al., 2017), vários aspectos dos padrões resultantes que são importantes para a classificação do bioma permanecem incertos. Por exemplo, os dados existentes sobre as formas de crescimento sugerem que as espécies lenhosas dominam em todos os biomas tropicais, enquanto a diversidade proporcional das formas de crescimento herbáceo é muito maior nos biomas temperados e polares (ver também Engemann et al., 2016; Zanne et al., 2018). Este aumento latitudinal na diversidade relativa de plantas herbáceas reflete o viés amostral e a falta de conhecimento taxonômico sobre plantas herbáceas tropicais, ou reflete as diferentes histórias evolutivas e biogeográficas nos reinos Próximo e Neotropical? As formas de crescimento dominantes são uma das principais características distintivas dos biomas, portanto as mudanças sistemáticas nas mais diversas formas de crescimento (dominantes ou não) influenciarão necessariamente as nossas previsões sobre como a diversidade funcional pode mudar através dos biomas, e como essas mudanças afectarão a função e os serviços dos ecossistemas.
Usamos mapas de variação de espécies como dados de entrada principalmente para superar a questão inegável do viés de amostragem que é característico dos conjuntos de dados compilados a partir de múltiplas fontes (ver Figura Suplementar 1). No entanto, os mapas de distribuição de espécies podem representar um elemento adicional de incerteza em nossos resultados. Por exemplo, dada a resolução geográfica deste estudo e a complexidade espacial de certos biomas, estes modelos poderiam ter sobrestimado a extensão geográfica de algumas espécies desde células de um único bioma até células de biomas próximos e interdigitados. A utilização de dados de ocorrência não alterou os resultados gerais deste estudo (ver Figuras Suplementares 2-6); contudo, uma ligeira diminuição da sobreposição funcional entre os biomas poderia de facto revelar uma superestimação de algumas gamas de espécies (ver Figuras Suplementares 2, 5, e 6). A utilização de informação de ocorrência também alterou as relações gerais entre a distintividade funcional e a generalização nos nossos resultados, devido à sobreamostragem relativa das regiões temperadas vs. tropicais (ver Figura Suplementar 4). Neste caso, a nossa medida de generalização é limitada pela amostragem extremamente limitada da maioria das espécies em biomas tropicais. medida que os conjuntos de dados e a amostragem melhoram, é provável que haja espaço para reduzir essas incertezas no futuro.
A outra lacuna de dados que precisa ser resolvida para entender a diversidade funcional dos biomas é a falta de informação prestoniana em abundância. Abundância é particularmente importante em estudos de diversidade funcional porque os traços mais importantes para a montagem comunitária, funcionamento dos ecossistemas e ciclagem biogeoquímica são os das espécies mais dominantes. Como baseamos nossas assemblages em mapas de diversidade derivados de modelos de distribuição de espécies, poderíamos abordar apenas o componente geográfico de abundância, mas a relação positiva entre abundância local e diversidade geográfica, a chamada relação ocupação-abundância, sugere que as espécies mais disseminadas em cada bioma podem estar frequentemente entre as mais abundantes também (Borregaard e Rahbek, 2010; Novosolov et al., 2017). Como os biomas são geralmente caracterizados pelas formas de crescimento dominantes na região, a integração da informação de abundância pode resultar em biomas com menor sobreposição funcional. Entretanto, mesmo que o BIEN tenha compilado dados volumosos de plotagem que permitem estimativas da abundância local, fazer comparações razoáveis entre diferentes regiões e formas de crescimento é dificultado por amostragens desiguais, diferenças regionais na diversidade gama, e métodos de quantificação da abundância proporcional ao rendimento.
Padrões comuns dentro dos biomas
Embora persistam lacunas nos dados disponíveis, nossas análises revelaram uma relação não documentada previamente comum a todos os biomas do Hemisfério Ocidental: em qualquer bioma, as espécies mais disseminadas também tendem a apresentar baixa distintividade funcional, enquanto as espécies mais funcionalmente distintas são quase sempre restritas em sua distribuição (Figura 3). Esta relação de “ocupação-redundância” pode sugerir que as condições climáticas prevalecentes dentro de um bioma selecionam um conjunto de características comuns, com espécies mais funcionalmente distintas sendo restritas a um subconjunto mais raro de habitats dentro do bioma. A prevalência global de espécies funcionalmente semelhantes em todos os biomas e a relação “ocupação-redundância” são ambas consistentes com uma recente análise global da diversidade funcional a nível comunitário que sugere que a filtragem de habitats leva à coexistência de espécies funcionalmente semelhantes (Li et al., 2018), bem como estudos que mostram que as redundâncias funcionais aumentam a estabilidade da comunidade (por exemplo, Walker et al., 1999; Pillar et al., 2013). Além disso, juntamente com o alto grau de sobreposição taxonômica e funcional entre os biomas (Figuras 1, 5), o fato de espécies comuns e disseminadas serem funcionalmente semelhantes reforça a noção de que plantas terrestres em uma ampla gama de condições ambientais compartilham características comuns perto do núcleo do espectro de características funcionais (Wright et al., 2004; Díaz et al., 2016). Ao contrário de Umaña et al. (2017), nossos resultados mostram que espécies raras, geograficamente restritas, podem ou não ser funcionalmente distintas de espécies mais disseminadas e comuns. Assim, a questão permanece em aberto se espécies mais funcionalmente distintas são especialistas em ambientes particulares ou se suas combinações de características resultam em trade-offs demográficos ou fisiológicos que limitam sua distribuição geográfica.
Comparações entre biomas
Nossa comparação de distribuições de hipervolume de características entre biomas (Figura 2B) é consistente com a observação de que ambientes mais ricos em espécies também são mais diversificados funcionalmente (Swenson et al, 2012; Lamanna et al., 2014; Li et al., 2018; Símová et al., 2018). Nossos resultados são mais equívocos em relação à hipótese de que ambientes sazonais e climáticos extremos limitam consistentemente a diversidade funcional das espécies (de la Riva et al., 2018). Todos os biomas tropicais apresentam maior diversidade funcional média do que todos os biomas temperados, e os biomas polares apresentam os menores hipervolumes. No entanto, dentro de cada grupo, os biomas mais secos ou mais sazonalmente variáveis nem sempre apresentam hipervolumes menores (por exemplo, florestas secas, bosques xéricos), como seria de esperar seguindo a hipótese de tolerância de Currie et al. (2004), enquanto as condições climáticas ideais suportam mais combinações de parâmetros fisiológicos. Apenas a partir destes resultados não podemos determinar se os biomas temperados e polares são menos diversificados taxonomicamente devido aos limites de espaço de nicho funcional, ou se os seus hipervolumes funcionais são pequenos porque não são taxonomicamente diversificados. Abordagens de modelagem nula poderiam potencialmente ajudar a separar a diversidade taxonômica e funcional (Swenson et al., 2012; Lamanna et al., 2014; Sämímová et al., 2018), mas tal análise estava além do escopo deste estudo. Mais importante ainda, nossos resultados reforçam a importância de entender como a história evolutiva e biogeográfica molda a diversidade funcional dos biomas (Woodward et al., 2004; Pennington et al., 2006; Donoghue e Edwards, 2014; Moncrieff et al., 2016). A extensa partilha de espécies (e linhagens superiores) entre biomas dentro de diferentes reinos biogeográficos, mas em grande parte não entre eles, poderia servir tanto para homogeneizar a diversidade funcional dentro dos reinos como para fornecer pistas sobre os traços característicos que são seleccionados a favor ou contra, por diferentes ambientes (Douma et al, 2012; Zanne et al., 2014, 2018).
Embora haja sobreposição substancial de hipervolume entre todos os biomas (Figura Complementar 2), os biomas tropicais, temperados e frios parecem ocupar regiões distintas do espaço funcional (Figuras 5B,C). Os principais traços que diferenciam os biomas parecem ser traços relacionados ao tamanho total da planta, incluindo tanto a altura madura quanto a massa de sementes (Figuras Suplementares 7-10), ao invés de traços de economia foliar, como observado em análises mais locais, baseadas em parcelas (por exemplo, Douma et al., 2012). A exceção é a folha P, que mostrou diferenças substanciais entre os biomas tropical e temperado/polar (Figuras Suplementares 7-10), um padrão que tem sido observado em outras análises baseadas em valores específicos de espécies e medidas de ecossistemas inteiros (Kerkhoff et al., 2005; Swenson et al., 2012). Como a folha P foi nosso traço mais esparsamente amostrado, as diferenças entre os reinos tropical e temperado/polar podem estar sujeitas a vieses do procedimento de imputação. Entretanto, a folha P exibe um sinal filogenético significativo (Kerkhoff et al., 2006), o que sugere que as imputações devem ser imparciais (Swenson et al., 2017). A Folha P também é significativamente mais elevada nas formas de crescimento herbáceo (Kerkhoff et al., 2006), portanto a mudança latitudinal de diversidade predominantemente lenhosa para herbácea (Figura 4) também pode influenciar este padrão.
Quando limitamos as análises de hipervolume apenas às espécies mais disseminadas e funcionalmente mais comuns em cada bioma, os biomas individuais dentro de cada domínio biogeográfico sobrepuseram-se menos no espaço de traço funcional (compare as Figuras 5B,C), sugerindo que estas espécies podem refletir fenótipos mais bem adaptados a ambientes particulares. Neste contexto, o bioma xérico da floresta é particularmente interessante. Em parte devido à inclusão da ecorregião Chaco, o aglomerado de bosques xericais com os biomas tropicais taxonomicamente (Figura 5A). Mas quando se consideram os hipervolumes funcionais de todas as espécies, estas apresentam uma semelhança muito mais forte com os biomas temperados (Figura 5B). Finalmente, quando apenas as espécies mais difundidas e funcionalmente mais comuns são analisadas, as matas xéricas voltam a mostrar uma maior semelhança com os biomas tropicais, mas também mantêm uma elevada semelhança com os biomas das pastagens temperadas e mediterrânicas (Figura 5C). A transição de ambientes quentes, mesicos para ambientes mais frios, secos e sazonais é facilitada por características semelhantes, por exemplo, o hábito herbáceo (Douma et al., 2012; Zanne et al., 2014, 2018), e como ambientes mais frios, as comunidades em ambientes secos também tendem a ser mais agrupadas filogenicamente (Qian e Sandel, 2017). Além disso, a posição das zonas xéricas no limite da zona de convergência inter-tropical faz delas uma transição geográfica entre os reinos tropical e temperado. O facto das florestas xéricas serem intermédias entre os reinos tropical e temperado, tanto funcional como biogeograficamente, reforça ainda mais a ideia de que para melhor compreender a diversidade funcional dos biomas devemos ter em conta as suas histórias biogeográficas e filogenéticas (Pennington et al., 2006; Donoghue e Edwards, 2014; Moncrieff et al, 2016).
Conclusões
Ainda a classificação dos biomas terrestres impõe um pequeno número de categorias discretas em gradientes contínuos na distribuição climática e de espécies, e assim representa uma simplificação grosseira da complexa paisagem ecológica (Moncrieff et al., 2016, mas ver Silva de Miranda et al., 2018). No entanto, apesar do seu potencial de simplificação excessiva, os biomas são construções úteis para organizar e compreender a biodiversidade e o funcionamento dos principais ecossistemas terrestres da Terra, e as abordagens baseadas em características têm um elevado potencial para ajudar a modelar dinamicamente a distribuição global da vegetação.
Neste estudo, mostramos que grande parte da diversidade taxonómica de todos os biomas representa espécies que estão distribuídas de forma estreita e funcionalmente semelhantes. Além disso, dentro dos biomas as espécies mais funcionalmente distintas em cada bioma também tendem a ser geograficamente raras, enquanto as espécies disseminadas apresentam uniformemente uma baixa distintividade funcional. Apesar da extensa sobreposição taxonómica e funcional entre os biomas, estes agrupam-se em unidades distintas, biogeográficas e climatéricas, especialmente quando o agrupamento funcional se baseia nas espécies mais disseminadas e funcionalmente comuns em cada bioma. Entretanto, o avanço na compreensão funcional dos biomas exigirá não apenas uma melhor caracterização da variação de características dentro e entre tipos de vegetação, mas também informações sobre a história biogeográfica e filogenética de conjuntos de espécies e a relativa abundância de espécies dentro dos biomas.
Data Availability
Trait datasets e mapas de variação de espécies analisados para este estudo podem ser baixados através do pacote R BIEN (Maitner et al., 2018). Veja http://bien.nceas.ucsb.edu/bien/ para mais detalhes sobre a base de dados BIEN.
Author Contributions
SE-L, AK, BJE, DMN e CV desenharam o estudo; SE-L e AK analisaram os dados; SE-L e AK escreveram a primeira versão do manuscrito; CV, BB, NK, BSM, BM, RKP, BS, SS, J-CS, e SKW contribuíram para a compilação e criação da base de dados de traços e mapas de variação de espécies. Todos os autores contribuíram para o desenvolvimento e escrita do manuscrito.
Funding
SE-L, DMN, e AK foram apoiados por uma bolsa de pesquisa colaborativa da US National Science Foundation (DEB-1556651). A BJE foi apoiada pela National Science Foundation award DEB-1457812 e Macrosystems-1065861. O CV foi apoiado pelo Conselho Europeu de Investigação (Grant ERC-StG-2014-639706-CONSTRAINTS) e pela Fundação Francesa de Investigação sobre Biodiversidade (FRB; www.fondationbiodiversite.fr) no contexto do projecto CESAB Causas e consequências da raridade funcional das escalas local e global. J-CS considera este trabalho uma contribuição para o seu projecto VILLUM Investigator Biodiversity Dynamics in a Changing World financiado pela VILLUM FONDEN (subsídio 16549). SKW foi apoiado pelo Fundo de Investimento em Ciências Estratégicas do Grupo de Ciência e Inovação do Ministério de Negócios, Inovação e Emprego da Nova Zelândia.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Acknowledgments
Agradecemos Dan Griffith e dois revisores pelas suas críticas construtivas que melhoraram muito este manuscrito. Agradecemos também a todos os colaboradores do BIEN (ver http://bien.nceas.ucsb.edu/bien/data-contribuidores/ para uma lista completa).
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/fevo.2018.00219/full#supplementary-material
Banda, R.K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D., et al. (2016). Padrões de diversidade vegetal em florestas secas neotropicais e suas implicações na conservação. Science 353, 1383-1387. doi: 10.1126/science.aaf5080
PubMed Abstract | CrossRef Full Text | Google Scholar
Blonder, B., Lamanna, C., Violle, C., and Enquist, B. J. (2014). O hipervolume n-dimensional. Globo. Ecol. Biogeogr. 23, 595-609. doi: 10.1111/geb.12146
CrossRef Full Text | Google Scholar
Blonder, B., Morrow, C. B., Maitner, B., Harris, D. J., Lamanna, C., Violle, C., et al. (2018). Novas abordagens para delinear os hipervolumes n-dimensionais. Métodos Ecol. Evol. 9, 305-319. doi: 10.1111/2041-210X.12865
CrossRef Full Text | Google Scholar
Bonan, G. B., Oleson, K. W., Fisher, R. A., Lasslop, G., e Reichstein, M. (2012). Conciliação dos dados fisiológicos das folhas e do fluxo da copa: utilização das bases de dados TRY e FLUXNET no Community Land Model versão 4. J. Geophys. Res. Biogeosci. 117:G02026. doi: 10.1029/2011JG001913
CrossRef Full Text | Google Scholar
Borregaard, M. K., e Rahbek, C. (2010). Causalidade da relação entre a distribuição geográfica e a abundância de espécies. P. Rev. Biol. 85, 3-25. doi: 10.1086/650265
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruggeman, J., Heringa, J., e Brandt, B. W. (2009). PhyloPars: estimativa de valores de parâmetros ausentes usando a filogenia. Nucleic Acids Res. 37, W179-W184. doi: 10.1093/nar/gkp370
PubMed Abstract | CrossRef Full Text | Google Scholar
Cadotte, M. W., Carscadden, K., and Mirotchnick, N. (2011). Além das espécies: diversidade funcional e a manutenção de processos e serviços ecológicos. J. Appl. Ecol. 48, 1079-1087. doi: 10.1111/j.1365-2664.2011.02048.x
CrossRef Full Text | Google Scholar
Cornwell, W. K., Cornelissen, J. H., Amatangelo, K., Dorrepaal, E., Eviner, V. T., Godoy, O., et al. (2008). As características das espécies vegetais são o controle predominante das taxas de decomposição da ninhada dentro dos biomas em todo o mundo. Ecol. Lett. 11, 1065-1071. doi: 10.1111/j.1461-0248.2008.01219.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Craine, J. M. (2009). Estratégias de Recursos de Plantas Silvestres. New Jersey, NJ: Princeton University Press. doi: 10.1515/9781400830640
CrossRef Full Text | Google Scholar
Currie, D. J., Mittelbach, G. G., Cornell, H. V., Field, R., Guégan, J. F., Hawkins, B. A., et al. (2004). Predictions and tests of climate-based hypotheses of broad-scale variation in taxonomic wealth. Ecol. Lett. 12, 1121-1134. doi: 10.1111/j.1461-0248.2004.00671.x
CrossRef Full Text | Google Scholar
de la Riva, E. G., Violle, C., Pérez-Ramos, I. M., Marañón, T., Navarro-Fernández, C. M., Olmo, M., et al. (2018). Uma abordagem multidimensional de traços funcionais revela a marca do stress ambiental nas comunidades lenhosas mediterrânicas. Ecosystems 21, 248-262. doi: 10.1007/s10021-017-0147-7
CrossRef Full Text | Google Scholar
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S., Dray, S., et al. (2016). O espectro global da forma e função da planta. Nature 529, 167-171. doi: 10.1038/nature16489
PubMed Abstract | CrossRef Full Text | Google Scholar
Díaz, S., Lavorel, S., de Bello, F., Quétier, F., Grigulis, K., and Robson, T. M. (2007). Incorporação dos efeitos da diversidade funcional das plantas nas avaliações dos serviços ecossistêmicos. Proc. Natl. Acad. Sci. U.S.A 104, 20684-20689. doi: 10.1073/pnas.0704716104
PubMed Abstract | CrossRef Full Text | Google Scholar
Donoghue, M. J., e Edwards, E. J. (2014). Mudanças no bioma e evolução de nicho nas plantas. Annu. Rev. Ecol. Evol. Syst. 45, 547-572. doi: 10.1146/annurev-ecolsys-120213-091905
CrossRef Full Text | Google Scholar
Douma, J. C., Aerts, R., Witte, J. P. M., Bekker, R. M., Kunzmann, D., Metselaar, K., et al. (2012). Uma combinação de características de plantas funcionalmente diferentes fornece um meio de prever quantitativamente uma ampla gama de conjuntos de espécies no noroeste da Europa. Ecography 35, 364-373. doi: 10.1111/j.1600-0587.2011.07068.x
CrossRef Full Text | Google Scholar
Engemann, K., Sandel, B., Enquist, B. J., Jørgensen, P. M., Kraft, N., Marcuse-Kubitza, A., et al. (2016). Padrões e factores de dominância de grupos funcionais de plantas no Hemisfério Ocidental: uma reavaliação macroecológica baseada num conjunto massivo de dados botânicos. Bot. J. Linn. Soc. 180, 141-160. doi: 10.1111/boj.12362
CrossRef Full Text | Google Scholar
Enquist, B. J., Condit, R., Peet, R., Thiers, B., and Schildhauer, M. (2016). The botanical information and ecology network (BIEN): cyberinfrastructure for an integrated botanical information network to investigate the ecological impacts of global climate change on plant biodiversity. PeerJ Prepr. 4:e2615v2. doi: 10.7287/peerj.preprints.2615v2
CrossRef Full Text | Google Scholar
Garnier, E., Cortez, J., Billès, G., Navas, M. L., Roumet, C., Debussche, M., et al. (2004). Marcadores funcionais de plantas capturam propriedades do ecossistema durante a sucessão secundária. Ecology 85, 2630-2637. doi: 10.1890/03-0799
CrossRef Full Text | Google Scholar
Goldsmith, G. R., Morueta-Holme, N., Sandel, B., Fitz, E. D., Fitz, S. D., Boyle, B., et al. (2016). Plant-O-Matic: um guia dinâmico e móvel para todas as fábricas das Américas. Métodos Ecol. Evol. 7, 960-965. doi: 10.1111/2041-210X.12548
CrossRef Full Text | Google Scholar
Goolsby, E. W., Bruggeman, J., e Ané, C. (2017). Rphylopars: métodos comparativos multivariados rápidos de filogenética para dados ausentes e variação dentro da espécie. Métodos Ecol. Evol. 8, 22-27. doi: 10.1111/2041-210X.12612
CrossRef Full Text | Google Scholar
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F., e Violle, C. (2017). funrar: um pacote R para caracterizar a raridade funcional. Divers. Distrib. 23, 1365-1371. doi: 10.1111/ddi.12629
CrossRef Full Text | Google Scholar
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M., and Ladle, R. J. (2015). Sete carências que prejudicam o conhecimento da biodiversidade em larga escala. Annu. Rev. Ecol. Evol. Syst. 46, 523-549. doi: 10.1146/annurev-ecolsys-112414-054400
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Enquist, B. J., Elser, J. J., e Fagan, W. F. (2005). Alometria vegetal, estequiometria e a dependência da temperatura da produtividade primária. Globo. Ecol. Biogeogr. 14, 585-598. doi: 10.1111/j.1466-822X.2005.00187.x
CrossRef Full Text | Google Scholar
Kerkhoff, A. J., Fagan, W. F., Elser, J. J., e Enquist, B. J. (2006). Phylogenetic and growth form variation in the scaling of nitrogen and phosphorus in the seed plants. Am. Nat. 168, E103-E122. doi: 10.1086/507879
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraft, N. J., Valencia, R., e Ackerly, D. D. (2008). Traços funcionais e montagem de comunidades arbóreas baseadas em nichos de mercado em uma floresta amazônica. Science 322, 580-582. doi: 10.1126/science.1160662
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamanna, C., Blonder, B., Violle, C., Kraft, N. J., Sandel, B., et al. (2014). Espaço de traços funcionais e o gradiente de diversidade latitudinal. Proc. Natl. Acad. Sci. U.S.A. 111, 13745-13750. doi: 10.1073/pnas.1317722111
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavorel, S., e Garnier, E. (2002). Prevendo mudanças na composição da comunidade e no funcionamento do ecossistema a partir de traços vegetais: revisitando o Santo Graal. Diversão. Ecol. 16, 545-556. doi: 10.1046/j.1365-2435.2002.00664.x
CrossRef Full Text | Google Scholar
Lavorel, S., Grigulis, K., Lamarque, P., Colace, M.-P., Garden, D., Girel, J., et al. (2011). Usando traços funcionais de plantas para entender a distribuição paisagística de múltiplos serviços ecossistêmicos. J. Ecol. 99, 135-147. doi: 10.1111/j.1365-2745.2010.01753.x
CrossRef Full Text | Google Scholar
Li, Y., Shipley, B., Price, J. N., Dantas, V. de L., Tamme, R., Westoby, M., et al. (2018). A filtragem do habitat determina a ocupação funcional de nichos de mercado das comunidades vegetais em todo o mundo. J. Ecol. 106, 1001-1009. doi: 10.1111/1365-2745.12802
CrossRef Full Text | Google Scholar
Magallón, S., Gómez-Acevedo, S., Sánchez-Reyes, L. L., e Hernández-Hernández, T. (2015). Uma árvore de tempo metacalibrada documenta o crescimento precoce da diversidade filogenética vegetal florida. Novo Phytol. 207, 437-453. doi: 10.1111/nph.13264
PubMed Abstract | CrossRef Full Text | Google Scholar
Maitner, B. S., Boyle, B., Casler, N., Condit, R., Donoghue, J., Durán, S. M., et al. (2018). O pacote BIEN R: uma ferramenta de acesso à base de dados da rede de informação botânica e ecologia (BIEN). Métodos Ecol. Evol. 9, 373-379. doi: 10.1111/2041-210X.12861
CrossRef Full Text | Google Scholar
Moncrieff, G. R., Bond, W. J., e Higgins, S. I. (2016). Revising the biome concept for understanding and predicting global change impacts. J. Biogeogr. 43, 863-873. doi: 10.1111/jbi.12701
CrossRef Full Text | Google Scholar
Novosolov, M., Rodda, G. H., North, A. C., Butchart, S. H. M., Tallowin, O. J. S., Gainsbury, A. M., et al. (2017). Relação entre a densidade populacional e o tamanho da população revisitada. Globo. Ecol. Biogeogr. 26, 1088-1097. doi: 10.1111/geb.12617
CrossRef Full Text | Google Scholar
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C., et al. (2001). Ecorregiões terrestres do mundo: um novo mapa da vida na Terra: um novo mapa global das eco-regiões terrestres fornece uma ferramenta inovadora para a conservação da biodiversidade. Bioscience 51, 933-938.doi: 10.1641/0006-3568(2001)0512.0.CO;2
CrossRef Full Text | Google Scholar
Pennington, R. T., Prado, D. E., e Pendry, C. A. (2000). Florestas neotropicais sazonalmente secas e mudanças na vegetação quaternária. J. Biogeogr. 27, 261-273. doi: 10.1046/j.1365-2699.2000.00397.x
CrossRef Full Text | Google Scholar
Pennington, R. T., Richardson, J. E., e Lavin, M. (2006). Insights into the historical construction of species-richich biomas from dated plant phylogenies, neutral ecological theory and phylogenetic community structure. Novo Phytol. 172, 605-616. doi: 10.1111/j.1469-8137.2006.01902.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Penone, C., Davidson, A. D., Shoemaker, K. T., Di Marco, M., Rondinini, C., Brooks, T. M., et al. (2014). Imputação de dados ausentes em conjuntos de dados de traços da história de vida: qual a melhor abordagem? Métodos Ecol. Evol. 5, 961-970. doi: 10.1111/2041-210X.12232
CrossRef Full Text | Google Scholar
Pilar, V. D., Blanco, C. C., Müller, S. C., Sosinski, E. E., Joner, F., e Duarte, L. D. S. (2013). Redundância funcional e estabilidade nas comunidades de plantas. J. Veg. Sci. 24, 963-974. doi: 10.1111/jvs.12047
CrossRef Full Text | Google Scholar
Prado, D. E., e Gibbs, P. E. (1993). Patterns of species distributions in the dry seasonal forest of South America (Padrões de distribuição de espécies nas florestas secas sazonais da América do Sul). Ann. Mo. Bot. Gard. 80, 902-927. doi: 10.2307/2399937
CrossRef Full Text | Google Scholar
Qian, H., and Sandel, B. (2017). Estrutura filogenética de conjuntos de angiospermas regionais através de gradientes latitudinais e climáticos na América do Norte. Globo. Ecol. Biogeogr. 26, 1258-1269. doi: 10.1111/geb.12634
CrossRef Full Text | Google Scholar
Reich, P. B., Wright, I. J., Cavender-Bares, J., Craine, J. M., Oleksyn, J., Westoby, M., et al. (2003). A evolução da variação funcional das plantas: traços, espectros e estratégias. Int. J. Plant Sci. 164, S143-S164. doi: 10.1086/374368
CrossRef Full Text | Google Scholar
Silva de Miranda, P. L., Oliveira-Filho, A., Pennington, R. T., Neves, D. M., Baker, T. R., e Dexter, K. G. (2018). Usando inventários de espécies arbóreas para mapear biomas e avaliar suas sobreposições climáticas em terras baixas tropicais da América do Sul. Globo. Ecol. Biogeogr. 27, 899-912. doi: 10.1111/geb.12749
CrossRef Full Text | Google Scholar
Semímová, I., Violle, C., Kraft, N. J. B., Storch, D., Svenning, J.-C., Boyle, B., et al. (2015). Mudanças nos meios e variações de características em assemblages de árvores norte-americanas: os padrões de riqueza de espécies estão vagamente relacionados com o espaço funcional. Ecography 38, 649-658. doi: 10.1111/ecog.00867
CrossRef Full Text | Google Scholar
Šímová, I., Violle, C., Svenning, J.-C., Kattge, J., Engemann, K., Sandel, B., et al. (2018). Os padrões espaciais e as relações climáticas das principais características das plantas no Novo Mundo diferem entre as espécies lenhosas e herbáceas. J. Biogeogr. 45, 895-916. doi: 10.1111/jbi.13171
CrossRef Full Text | Google Scholar
Smith, S. A., e Beaulieu, J. M. (2009). A história de vida influencia as taxas de evolução do nicho climático em plantas em flor. Proc. Biol. Sci. 276, 4345-4352. doi: 10.1098/rspb.2009.1176
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., and Brown, J. W. (2018). Construindo uma filogenia de plantas de sementes amplamente inclusiva. Am. J. Bot. 105, 302-314. doi: 10.1002/ajb2.1019
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. A., e Donoghue, M. J. (2008). As taxas de evolução molecular estão ligadas à história de vida em plantas floridas. Science 322, 86-89. doi: 10.1126/science.1163197
PubMed Abstract | CrossRef Full Text | Google Scholar
Swenson, N. G. (2014). Atribuição filogenética de bases de dados de traços funcionais de plantas.Ecography 37, 105-110. doi: 10.1111/j.1600-0587.2013.00528.x
CrossRef Full Text
Swenson, N. G., Enquist, B. J., Pither, J., Kerkhoff, A. J., Boyle, B., Weiser, M. D., et al. (2012). A biogeografia e filtragem da diversidade funcional das plantas lenhosas na América do Norte e do Sul. Globo. Ecol. Biogeogr. 21, 798-808. doi: 10.1111/j.1466-8238.2011.00727.x
CrossRef Full Text | Google Scholar
Swenson, N. G., Weiser, M. D., Mao, L., Araújo, M. B., Diniz-Filho, J. A. F., Kollmann, J., et al. (2017). Phylogeny and the prediction of tree functional diversity across novel continental settings. Globo. Ecol. Biogeogr. 26, 553-562. doi: 10.1111/geb.12559
CrossRef Full Text | Google Scholar
Umaña, M. N., Mi, X., Cao, M., Enquist, B. J., Hao, Z., Howe, R., et al. (2017). O papel da singularidade funcional e da agregação espacial na explicação da raridade nas árvores. Globo. Ecol. Biogeogr. 26, 777-786. doi: 10.1111/geb.12583
CrossRef Full Text | Google Scholar
van Bodegom, P. M., Douma, J. C., e Verheijen, L. M. (2014). Uma abordagem totalmente baseada em traços para modelar a distribuição global da vegetação. Proc. Natl. Acad. Sci. U.S.A. 111, 13733-13738. doi: 10.1073/pnas.1304551110
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Reich, P. B., Pacala, S. W., Enquist, B. J., and Kattge, J. (2014). O surgimento e a promessa de biogeografia funcional. Proc. Natl. Acad. Sci. U.S.A. 111, 13690-13696. doi: 10.1073/pnas.1415442111
PubMed Abstract | CrossRef Full Text | Google Scholar
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W., et al. (2017). Raridade funcional: a ecologia dos outliers. Tendências Ecol. Evol. 32, 356-367. doi: 10.1016/j.tree.2017.02.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Walker, B., Kinzig, A., and Langridge, J. (1999). Diversidade de atributos vegetais, resiliência, e função do ecossistema: a natureza e o significado das espécies dominantes e menores. Ecosystems 2, 95-113. doi: 10.1007/s100219900062
CrossRef Full Text | Google Scholar
Westoby, M. (1998). Um esquema de estratégia de ecologia de plantas com semente em altura (LHS). Solo Vegetal 199, 213-227. doi: 10.1023/A:1004327224729
CrossRef Full Text | Google Scholar
Woodward, F. I., Lomas, M. R., e Kelly, C. K. (2004). O clima global e a distribuição dos biomas vegetais. Filosofia. Trans. R. Soc. Lond. B. Biol. Sci. 359, 1465-1476. doi: 10.1098/rstb.2004.1525
PubMed Abstract | CrossRef Full Text | Google Scholar
Wright, I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Baruch, Z., Bongers, F., et al. (2004). O espectro mundial da economia das folhas. Nature 428, 821-827. doi: 10.1038/nature02403
PubMed Abstract | CrossRef Full Text | Google Scholar
Xia, J., Niu, S., Ciais, P., Janssens, I. A., Chen, J., Ammann, C., et al. (2015). Controlo conjunto da produtividade primária bruta terrestre por fenologia e fisiologia vegetal. Proc. Natl. Acad. Sci. U.S.A. 112, 2788-2793. doi: 10.1073/pnas.1413090112
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Pearse, W. D., Cornwell, W. K., McGlinn, D. J., Wright, I. J., e Uyeda, J. C. (2018). Biogeografia funcional de angiospermas: a vida nos extremos. Novo Phytol. 218, 1697-1709. doi: 10.1111/nph.15114
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanne, A. E., Tank, D. C., Cornwell, W. K., Eastman, J. M., Smith, S. A., FitzJohn, R. G., et al. (2014). Três chaves para a radiação de angiospermas em ambientes gelados. Nature 506, 89-92. doi: 10.1038/nature12872
PubMed Abstract | CrossRef Full Text | Google Scholar