Avaliação | Biopsicologia | Comparativo |Cognitivo |Desenvolvimento |Linguagem | Diferenças individuais |Personalidade |Filosofia |Social |
Métodos |Estatísticas |Clínicas |Educativas |Industriais |Profissionais |Psicologia Mundial |
Biológica:Genética comportamental – Psicologia evolutiva – Neuroanatomia – Neuroquímica – Neuroendocrinologia – Neurociências – Psiconeuroimunologia – Psicologia Fisiológica – Psicofarmacologia(Index, Outline)
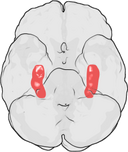
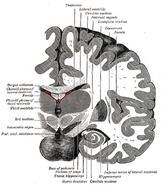
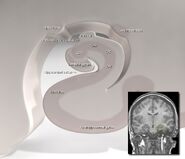
A localização do hipocampo no cérebro humano.
Para a revista com o mesmo nome, ver Hippocampus (revista)
O hippocampus é uma parte do antebraço, localizado no lobo temporal medial. Ele pertence ao sistema límbico e desempenha papéis importantes na memória a longo prazo e na navegação espacial. Humanos e outros mamíferos têm dois hipocampos, um em cada lado do cérebro. Nos roedores, onde tem sido estudado mais extensivamente, o hipocampo tem o formato de uma banana. Nos humanos, tem uma forma curva e convoluta que faz lembrar aos primeiros anatomistas um cavalo marinho. O nome, na verdade, deriva da palavra grega para cavalo marinho (grego: hippos = cavalo, campos = mar).
Na doença de Alzheimer, o hipocampo é uma das primeiras regiões do cérebro a sofrer danos; problemas de memória e desorientação aparecem entre os primeiros sintomas. Os danos no hipocampo também podem resultar de fome de oxigênio (anóxia), encefalite ou epilepsia do lobo temporal mesial. Pessoas com danos extensos no hipocampo podem experimentar amnésia, ou seja, incapacidade de formar ou reter novas memórias.
Funções do hipocampo
Talvez a ideia mais antiga tenha sido a de que o hipocampo está envolvido no olfato: isto parece ter sido sugerido principalmente pela sua localização no cérebro, junto ao córtex olfatório. Continua a haver algum interesse nas respostas olfativas hipocampais, mas quase ninguém agora acredita que a função primária do hipocampo seja olfativa.
Ao longo dos anos, três idéias principais da função hipocampais dominaram a literatura: inibição, memória e espaço. A teoria da inibição comportamental (caricaturada por O’Keefe e Nadel como “pisar nos freios”) foi muito popular até os anos 60. Ela derivou muito de sua força de duas observações: primeiro, animais com dano hipocampal tendem a ser hiperativos; segundo, animais com dano hipocampal geralmente têm dificuldade em aprender a inibir respostas que já foram ensinadas anteriormente. Jeffrey Gray desenvolveu esta linha de pensamento em uma teoria completa sobre o papel do hipocampo na ansiedade. A teoria da inibição não é, contudo, muito popular no momento.
A segunda importante linha de pensamento relaciona o hipocampo à memória. Embora tivesse precursores, esta idéia derivou sua força principal de um relatório muito conhecido de Scoville e Milner sobre os resultados da destruição cirúrgica do hipocampo (numa tentativa de aliviar crises epiléticas), em um paciente conhecido como H.M. O resultado inesperado foi uma amnésia severa: H.M. foi incapaz de lembrar conscientemente de eventos que ocorreram após sua cirurgia ou por vários anos antes dela. Este caso ocasionou um interesse tão grande que agora se diz que H.M. é o caso médico mais estudado intensivamente na história. Nos anos seguintes, outros pacientes com níveis semelhantes de dano hipocampal e amnésia (causada por acidente ou doença) também foram estudados, e literalmente milhares de experimentos estudaram a fisiologia da plasticidade neural no hipocampo. Existe agora um consenso quase universal de que o hipocampo desempenha algum tipo de papel importante na memória; contudo, a natureza precisa deste papel continua a ser amplamente debatida.
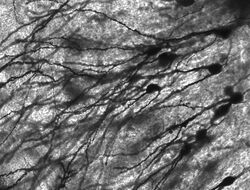
Neurónios manchados por Golgi no hipocampo roedor.
Papel na memória
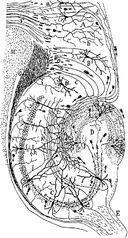
Desenho do circuito neural do hipocampo roedor. S. Ramón y Cajal, 1911.
Psychologists and neuroscientists disputam o papel preciso do hipocampo, mas geralmente concordam que ele tem um papel essencial na formação de novas memórias sobre eventos vividos pessoalmente (memória episódica ou autobiográfica). Alguns pesquisadores preferem considerar o hipocampo como parte de um sistema maior de memória do lobo temporal medial responsável pela memória declarativa geral (memórias que podem ser explicitamente verbalizadas – estas incluiriam, por exemplo, memória para fatos além da memória episódica).
Artigo principal: Papel do hipocampo na memória
Algumas evidências implicam o hipocampo no armazenamento e processamento de informação espacial. Estudos em ratos mostraram que os neurônios do hipocampo têm campos de queima espacial. Estas células são chamadas células de lugar. Algumas células disparam quando o animal se encontra em um determinado local, independentemente da direção da viagem, enquanto a maioria é pelo menos parcialmente sensível à direção da cabeça e direção da viagem.
Artigo principal: Papel do hipocampo na memória espacial e navegação
Hipocampo e depressão
- Perda de volume hipocampal, talvez refletindo os efeitos do excesso de glicocorticóides sobre
neurogênese foi identificada em grupos de pessoas deprimidas em comparação com controles.
Artigo principal: Depressão e o hipocampo
História
O anatomista Giulio Cesare Aranzi (cerca de 1564) usou pela primeira vez o termo hipocampo para descrever o órgão cerebral devido à sua semelhança visual com um cavalo marinho. Este órgão estava inicialmente ligado ao olfato, mais do que à sua função conhecida na aquisição de memória. O russo Vladimir Bekhterev notou o papel do hipocampo na memória por volta de 1900, baseado em observações de um paciente com profundos distúrbios de memória. Contudo, durante muitos anos, a visão convencional do hipocampo foi que, como o resto do sistema límbico, ele era responsável pela emoção.
A importância do hipocampo na memória foi trazida à atenção dos pesquisadores pelo paciente HM. HM sofria de uma série de deficiências de memória anterógrada e retrógrada temporalmente (tais deficiências são o tema do filme Memento) após a remoção bilateral de várias estruturas do lobo medial-temporal (incluindo ablação bilateral de seu hipocampo) para aliviar as frequentes convulsões epilépticas. De particular importância é que HM ainda foi capaz de aprender tarefas processuais (que estão associadas com o estriato) e tinha um QI acima da média. O HM demonstrou uma impressionante dissociação única entre inteligência e memória declarativa. O tamanho relativo da formação hipocampal em relação ao volume total do cérebro é frequentemente conservado na maioria das espécies de mamíferos. No entanto, verificou-se que estas áreas são relativamente hipotróficas em cetáceos.
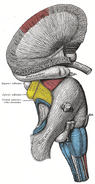
Anatomia
Artigo principal: Anatomia do hipocampo
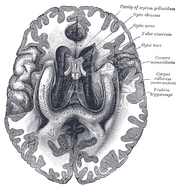
Human hippocampus.
Nissl-stained coronal section of the brain of a macaque macaque macaque, mostrando hippocampus (circulado). Fonte: brainmaps.org
Anatomicamente, o hipocampo é uma elaboração da borda docortex. Ele pode ser distinguido como uma zona onde o córtex se estreita em uma única camada de neurônios veridensamente embalados, que se enrolam em uma forma de S apertado. As estruturas que alinham a borda do córtex compõem o chamado sistema límbico (Latin limbus =border): estas incluem o hipocampo, córtex cingulado, olfactorycortex, e amígdala. Paul MacLean uma vez sugeriu, aspart da sua teoria do cérebro trino, que as estruturas límbicas compreendem a base neural da emoção. A maioria dos neurocientistas não acredita mais que o conceito de um “sistema límbico” unificado é válido, no entanto.
O hipocampo, como um todo, acaba parecendo algo como um tubo curvo, que foi analogizado de várias maneiras para um cavalo marinho, ou um corno de carneiro (Cornu Ammonis), ou uma banana. No rato, os dois hipocampos parecem espantosamente como um par de bananas, unidos ao caule. No cérebro humano ou do macaco, a porção do hipocampo em baixo, perto da base do lobo temporal, é mais mucosa do que a parte em cima. Uma das consequências desta complexgeometria é que as secções transversais através do hipocampo podem mostrar uma variedade desconcertante de formas, dependendo do ângulo e localização do corte.
As ligações mais fortes do hipocampo são com o córtex entorhinal (CE), que se encontra junto a ele no lóbulo temporal. As camadas superficiais do CE fornecem as entradas mais numerosas para o hipocampo, e as camadas profundas do CE recebem as saídas mais numerosas. O CE, por sua vez, é fortemente, e reciprocamente, conectado com muitas outras partes do córtex. O hipocampo também recebe uma projeção muito importante da área septal medial. A destruição da área septal abole o ritmo teta hipocampal, e prejudica severamente certos tipos de memória. (Pensa-se que as chamadas drogas de “violação de data” exercem os seus efeitos amnésticos pelo menos em parte antagonizando a projecção colinérgica do septo medial para o hipocampo.)
Fisiologia
Exemplos de EEG hipocampal de rato e actividade neural CA1 nos modos theta (desperto/comportamento) e LIA (sono de onda lenta). Cada gráfico mostra 20 segundos de dados, com um traço de EEG hipocampal no topo, espigões de 40 células piramidais CA1 registradas simultaneamente no meio (cada linha raster representa uma célula diferente), e um gráfico de velocidade de corrida na parte inferior. O gráfico superior representa um período de tempo durante o qual o rato procurava activamente pellets de alimentos dispersos. Para o gráfico inferior, o rato estava dormindo.
O hipocampo mostra dois “modos” principais de atividade, cada um associado a um padrão distinto de ondas EEG e atividade populacional neural. Estes modos são nomeados de acordo com os padrões EEG associados a eles:theta e grande atividade irregular (AII). Aqui estão algumas das suas principais características no rato, o animal que tem sido mais estudado:
O modo theta aparece durante estados de comportamento ativo, alerta (especialmente locomoção), e também durante o sono REM (sonhando). No modo theta, o EEG é dominado por grandes ondas regulares com intervalo de afrequência de 6-9 Hz, e os principais grupos de neurônios hipocampais (células piramidais e células granulares) mostram uma atividade populacional esparsa, o que significa que em qualquer intervalo de tempo curto, a grande maioria das células é silenciosa, enquanto a pequena fração restante dispara taxas atrelativamente altas, até 50 picos em um segundo para o mostativo deles. Uma célula ativa normalmente permanece ativa de meio segundo a alguns segundos. À medida que o rato se comporta, as células activas caem silenciosamente e as novas células tornam-se activas, mas a percentagem geral de células activas permanece mais ou menos constante. Em muitas situações, a atividade celular é determinada em grande parte pela localização espacial do animal, mas outras variáveis comportamentais também a influenciam claramente.
O modo LIA aparece durante o sono de onda lenta (sem sonhar), e também em estados de imobilidade acordada, como repouso ou alimentação. No modo LIA, o EEG é dominado por ondas agudas, que provocam grandes deflexões do sinal EEG com duração de 200-300msec. Essas ondas agudas também determinam os padrões de ativação neural da população. Entre elas, células piramidais e células granulométricas são muito agitadas (mas não silenciosas). Durante uma onda aguda, até 5-10% da população pode emitir potenciais de ação durante um período de 50 msec; muitas destas células emitem não uma, mas uma explosão de picos.
Estes dois modos de atividade hipocapampais podem ser vistos tanto em primatas quanto em ratos, com a importante exceção de que tem sido difícil encontrar teta rítmica robusta no primata hipocampo. Existem, no entanto, ondas agudas qualitativamente semelhantes, e alterações dependentes do estado semelhante na atividade neural da população…
O ritmo teta
Por causa de suas camadas neurais densamente compactas, o hipocampo gera o maior sinal de EEG de qualquer estrutura cerebral. Em algumas situações, o EEG é dominado por ondas regulares, muitas vezes continuando em quaisquer segundos. Este padrão de EEG é conhecido como o ritmo teta. Ele foi um dos primeiros fenômenos de EEG a ser descoberto: a primeira descrição veio de Jung e Kornmuller, em 1938. Mas só em 1954, com a publicação por Green e Arduini de um longo e minucioso estudo do ritmo teta em coelhos, gatos e macacos, é que o interesse realmente se expandiu. Talvez porque eles relacionaram o ritmo teta à excitação, que era o tema quente da época, o seu papel provocou uma enchente de estudos de acompanhamento, resultando na publicação de literalmente centenas de estudos da fisiologia e da farmacologia do theta durante os anos 50 e 60. Apesar deste conjunto assustador de trabalhos, muitas perguntas ficaram sem resposta, especialmente a questão da função. Mesmo no momento atual, esta crítica de perguntas ainda não foi respondida de forma convincente.
Theta rhythmicity é muito evidente em coelhos e roedores, e também claramente presente em gatos e cães. Se teta pode ser vista em reprimendas é uma pergunta irritante. Green e Arduini relataram apenas explosões de ritmos bastante irregulares em macacos, e estudos de mostlateres têm visto pouco mais. No entanto, variações na metodologia têm dificultado conclusões fortes.
Em ratos (os animais que foram de longe os mais estudados), theta é visto principalmente em duas condições: primeiro, quando um animal está caminhando ou de alguma outra forma interagindo ativamente com o ambiente; segundo, durante o sono REM. A frequência aumenta como função da velocidade de corrida, começando em cerca de 6,5 Hz na extremidade baixa e aumentando até cerca de 9 Hz na extremidade alta, embora por vezes se observem frequências mais elevadas para movimentos dramáticos, como saltos em grandes intervalos. Em outras espécies de animais, maiores, as freqüências são geralmente um pouco mais baixas. A dependência comportamental também varia de acordo com a espécie: em gatos e coelhos, o theta é frequentemente observado durante estados de alerta sem movimento. Isto tem sido relatado também para ratos, mas somente quando eles estão seriamente assustados.
Theta não está apenas confinada ao hipocampo. Em ratos, ele pode ser observado em muitas partes do cérebro, incluindo quase tudo que interage fortemente com o hipocampo. O marcapasso para o ritmo pensado para ficar dentro da área septal medial: esta área projeta-se para todas as regiões que mostram ritmicidade teta, e a destruição do mesmo elimina a teta por todo o cérebro. (Pode haver oneexception, uma pequena área no hipotálamo chamada supramamilarinucleus, que parece ser capaz de sustentar theta independentemente do septo em algumas situações.)
A função do theta, presumindo que tenha uma, ainda não foi convencionalmente explicada, embora numerosas teorias tenham sido propostas.A tendência mais popular tem sido relacioná-la à aprendizagem e à memória. Está bem estabelecido que as lesões do septo medial – o nó central do sistema theta – causam graves perturbações da memória. No entanto, o septo médio é mais do que apenas o controlador do theta, é também a principal fonte de projeções colinérgicas para ohipocampo. Não foi estabelecido que lesões do septo exerçam seus efeitos especificamente pela eliminação do theta.
Ondas agudas
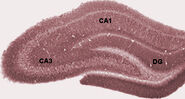
Durante o sono, ou durante estados de vigília, quando um animal está descansando ou não está envolvido com seu ambiente, o EEG hipocampal mostra um padrão de ondas lentas irregulares, um pouco maiores em amplitude que as ondas thantheta. Este padrão é ocasionalmente interrompido por grandes surtos de ondas agudas. Estes eventos estão associados com explosões de atividade de raios, com duração de 50-100 msec, em células piramidais de CA3 eCA1. Estão também associados a EEGoscilações de alta frequência de curta duração chamadas “ondulações”. As ondulações, com frequências na faixa de 150-200 Hz em ratos, normalmente só podem ser detectadas por eletrodos localizados dentro ou muito próximos da camada do corpo da célula CA1. Incontraste, eletrodos localizados em qualquer lugar dentro do hipocampo, ou mesmo nas estruturas cerebrais vizinhas, muitas vezes captam ondas agudas com deflexões de EEG muito lentas, durando 200-400 msec.
Em ratos, ondas agudas são mais robustas durante o sono, quando ocorrem a uma taxa média em torno de 1 por segundo, mas em um padrão temporal muito irregular. Ondas agudas também ocorrem durante estados inativos de vigília, mas são menos freqüentes do que elas e geralmente menores. Ondas agudas também têm sido observadas no lobo temporal humano e no hipocampo dos macacos. Em macacos, ondas agudas são bastante robustas, mas não ocorrem quase sempre como em ratos.
Um dos aspectos mais interessantes das ondas agudas é que elas parecem estar associadas à memória. Wilson e McNaughton 1994, e inúmeros estudos posteriores, relataram que quando as células hipocampais colocam campos de tiro espaciais sobrepostos (e, portanto, muitas vezes disparam em simultâneo), elas tendem a mostrar atividade correlacionada durante o sono, acompanhando a sessão comportamental. Esta melhora da correlação, comumente conhecida como reativação, foi encontrada confinada, principalmente, a ondas agudas. Tem sido proposto que ondas agudas são, de fato, reativações de padrões de atividade neural que foram memorizadas, impulsionadas pelo fortalecimento da conexão sináptica com o hipocampo. Esta idéia forma um componente chave da teoria da “memória em dois estágios”, defendida por Buzsaki e outros, que propõe que as memórias são armazenadas dentro do hipocampo durante o comportamento, e depois transferidas para o neocórtex durante o sono: ondas agudas são sugeridas para conduzir mudanças sinápticas Hebbianas em alvos entãoeocorticais dos caminhos de saída hipocampais.
Evolução
O hipocampo tem uma aparência geralmente semelhante em toda a gama de espécies de mamíferos, desde as basais como o ouriço-cacheiro até às mais “avançadas” como os humanos. Assim, o hipocampo ocupa um volume muito maior de corticalmanto em roedores do que em primatas.
Há também uma relação geral entre o tamanho do hipocampo e a memória espacial: quando comparações são feitas entre espécies semelhantes, aquelas que têm uma maior capacidade de memória espacial tendem a ter maiores volumes hipocampais… Esta relação também se estende a diferenças de sexo: inspeções onde machos e fêmeas mostram fortes diferenças na capacidade espacial, eles também tendem a mostrar diferenças correspondentes no volume inalatório do hipocampo
As espécies não mamíferas não têm uma estrutura cerebral que se parece com o hipocampo mamífero, mas eles têm uma que é considerada como sendo homóloga a ele. O hipocampo, como já foi apontado acima, é essencialmente a borda medial do córtex. Apenas os mamíferos têm o córtex desenvolvido, mas a estrutura de onde evoluiu, chamada depallium, está presente em todos os vertebrados, mesmo nos mais primitivos, como a lampreia ou o peixe-branco. O pálio é normalmente dividido em três zonas: medial, lateral e dorsal. O pálio medial forma o precursor do hipocampo. Não se assemelha ao hipocampo, porque as camadas não são deformadas em forma de S ou enroladas pelo giro dentado, mas sim a homologia em afinidades químicas e funcionais indicadas por bystrong. Há agora evidências de que estas estruturas semelhantes às hipocampais estão envolvidas na cognição espacial de aves, répteis e peixes.
Em aves, a correspondência está suficientemente bem estabelecida que a maioria dos anatomistas se refere à zona palial medial como “avianhippocampus”. Numerosas espécies de aves possuem fortes habilidades espaciais, particularmente aquelas que se alimentam em cache. Há evidências de que as aves que se alimentam de caça têm um hipocampo maior do que outros tipos de aves, e que os danos causados ao hipocampo prejudicam a memória inspiracional…
A história para os peixes é mais complexa. Nos peixes teleost (que compõem a grande maioria das espécies existentes), o cérebro anterior é estranhamente distorcido em comparação com outros tipos de vertebrados. Os mostneuroanatomistas acreditam que o cérebro teleost é essencialmente invertido, como uma meia virada de dentro para fora, de modo que estruturas que se encontram no interior, junto aos ventrículos, para a maioria dos vertebrados, são encontradas no exterior em peixes teleost, e viceversa. Uma das consequências disto é que o pálio medial (zona “hipocampal”) de um vertebrado típico corresponde ao pálio lateral de um peixe típico. Vários tipos de peixes (em particular peixes-peixe) têm demonstrado experimentalmente ter fortes capacidades de memória espacial, mesmo formando “mapas cognitivos” das áreas que habitam. Há evidências de que os danos no pálio lateral prejudicam a memória espacial (a navegação de longa distância, como o regresso ao mar pelo salmão, parece depender de mecanismos diferentes, no entanto)
Assim, o papel da região hipocampal na navegação parece começar de novo na evolução dos vertebrados, predando divisões que ocorreram centenas de milhões de anos atrás. Ainda não se sabe se o pálio medial desempenha um papel semelhante em vertebrados ainda mais primitivos, como os tubarões e as arraias, ou mesmo as lampreias e os peixe-branco. Alguns tipos de insetos, e os moluscos, como o polvo, também têm fortes habilidades de aprendizagem espacial e de navegação, mas estes parecem funcionar de forma diferente do sistema espacial dos mamíferos, por isso ainda não há uma boa razão para pensar que eles têm uma origem evolutiva comum; nem há similaridade suficiente na estrutura cerebral para permitir que qualquer coisa parecida com um “hipocampo” possa ser identificada nestas espécies.
Ver também
- Amygdalohippocampectomy
- Median forebrain bundle
- Septal nuclei
Referências & Bibliografia
Textos-chave
Livros
- Aboitiz, F, Morales D, Montiel J (2003). A origem evolutiva do isocórtex mamífero: Rumo a uma abordagem integrada de desenvolvimento e funcional. Comportamento. Brain Sciences 26: 535-552.
- Amaral, D; Lavenex P (2006). “Ch 3. Hippocampal Neuroanatomy” Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J The Hippocampus Book, Oxford University Press.
- Broglio, C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C (2002). Marcas de um plano comum de vertebrados forebrain: Áreas paleais especializadas para a memória espacial, temporal e emocional em peixes actinoptéricos. Res. Cérebro de Touro. 57: 397-399.
- Buzsáki, G (2002). Oscilações teta no hipocampo. Neurônio 33: 325-340.
- Buzsáki, G (2006). Ritmos do Cérebro.
- Cantero, JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (2003). As oscilações teta dependentes do sono no hipocampo e neocórtex humano. J. Neuroci. 23: 10897-10903.
- Colombo, M, Broadbent N (2000). O hipocampo aviário é um homólogo funcional do hipocampo de mamíferos? Neurosci. Biobehav. Rev. 24: 465-484.
- Eichnbaum, H; Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System, MIT Press.
- Ekstrom, AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, Fried I (2003). Redes celulares subjacentes à navegação espacial humana. Natureza 425: 184-188.
- Gray, JA; McNaughton N (2000). A Neuropsicologia da Ansiedade: An Enquiry into the Functions of the Septo-Hippocampal System, Oxford University Press.
- Green, JD, Arduini AA (1954). Atividade elétrica hipocampal em excitação. J. Neurophysiol. 17: 533-557.
- Jacobs, LF, Gaulin SJ, Sherry DF, Hoffman GE (1990). Evolução da cognição espacial: padrões de comportamento espacial específicos do sexo predizem o tamanho hipocampal. PNAS 87: 6349-6352.
- Jacobs, LF (2003). A Evolução do Mapa Cognitivo. O Comportamento Cerebral. Evol. 62: 128-139.
- Kirk, IJ, McNaughton N (1991). Disparo de células supramamilares e atividade hipocampal rítmica lenta. Neuroreport 11: 723-725.
- Maguire, EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, Frith CD (2000). Mudança estrutural relacionada com a navegação nos hipocampos dos taxistas. PNAS 97: 4398-4403.
- McNaughton, BL, Battaglia FP, Jensen O, Moser EI, Moser MB (2006). Integração do caminho e a base neural do ‘mapa cognitivo’. Nat. Rev. Neurosci. 7: 663-678.
- Moser, EI, Kropf E, Moser M-B (2008). Colocar Células, Células Grid, e o Sistema de Representação Espacial do Cérebro. Ann. Rev. Neurosci. 31.
- Nieuwenhuys, R (1982). An Overview of the Organization of the Brain of Actinopterygian Fishes (Uma Visão Geral da Organização do Cérebro de Peixes Actinoptéricos). Am. Zool. 22: 287-310.
- O’Kane, G, Kensinger EA, Corkin S (2004). Evidência para aprendizagem semântica em amnésia profunda: Uma investigação com o paciente H.M.. Hipocampus 14: 417-425.
- O’Keefe, J; Nadel L (1978). The Hippocampus as a Cognitive Map, Oxford University Press.
- Portavella, M, Vargas JP, Torres B, Salas C (2002). Os efeitos das lesões paleais telencefálicas na aprendizagem espacial, temporal e emocional em peixes vermelhos. Res. Cérebro Bull. 57: 397-399.
- Rodríguez, F, Lópeza JC, Vargasa JP, Broglioa C, Gómeza Y, Salas C (2002). Memória espacial e pálio hipocampal através da evolução dos vertebrados: insights de répteis e peixes teleost. Res. Cérebro de Touro. 57: 499-503.
- Sainsbury, RS, Heynen A, Montoya CP (1987). Correlatos comportamentais de hipocampais tipo 2 teta no rato. Fisiol. Comportamento. 39: 513-519.
- Scoville, WB, Milner B (1957). Perda de Memória Recente após Lesões Hipocampais Bilaterales. J. Neurol. Neurocirurgia. Psiquiatria. 20: 11-21.
- Shettleworth, SJ (2003). Memory and Hippocampal Specialization in Food-Storing Birds: Desafios para a Pesquisa em Cognição Comparativa. Comportamento do Cérebro. Evol. 62: 108-116.
- Skaggs, WE, McNaughton BL, Wilson MA, Barnes CA (1996). Pré-cessão da fase teta em populações neuronais hipocampais e a compressão de seqüências temporais. Hippocampus 6: 149-176.
- Squire, LR (1992). Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans. Psych. Rev. 99: 195-231.
- Squire, LR; Schacter DL (2002). The Neuropsychology of Memory, Guilford Press.
- Vanderwolf, CH (1969). Atividade elétrica hipocampal e movimento voluntário no rato. EEG & Clin. Neurofisiol. 26: 407-418.
- Vargas, JP, Bingman VP, Portavella M, López JC (2006). Telencéfalo e espaço geométrico em peixe-dourado. Eur. J. Neurosci. 24: 2870-2878.
- West, MJ (1990). Estudos estereológicos do hipocampo: uma comparação das subdivisões hipocampais de diversas espécies incluindo porcos-espinhos, roedores de laboratório, ratos selvagens e homens… Prog. Brain Res. 83: 13-36.
- Amaral DG e Cowan WM. 1980. Aferentes subcorticais à formação hipocampal no macaco. Journal of Comparative Neurology. Fev 15; 189(4):573-91.
- Duvernoy, H. (2005) The Human Hippocampus, 3rd ed. Berlin: Springer-Verlag.
- Google Scholar
- http://www.psycheducation.org/emotion/hippocampus.htm Grandes visitas ao cérebro!!
- Mapas Cerebrais na UCDavis hippocampus
- Hippocampus Artificial
- BrainInfo na Universidade de Washington hier-164
- John O’Keefe & Lynn Nadel (1978) The Hippocampus as a Cognitive Map , Oxford University Press. Texto completo
Papéis
Material adicional
Papéis
>
>
Imagens adicionais
Adicionar uma foto a esta galeria
Cérebro humano: Sistema límbico
Amígdala – Giro cingulado – Giro fornicado – Hipocampo – Hipotálamo – Corpo de mamífero – Núcleo acumbente – Córtex orbitofrontal – Giro parahipocampal
|
v-d-e
Cérebro humano: cérebro (cérebro – córtex cerebral – hemisférios cerebrais, matéria cinzenta) (TA A14.1.09.002-240, 301-320, GA 9.818-826) |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Lóbulo frontal |
|
||||||||||||||||
| Lóbulo Parietal |
|
Superolateral
|
Medial/inferior
|
>
Both
> |
|||||||||||||
| Lóbulo occipital |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Lóbulo temporal |
>
> |
Superolateral
|
Medial/inferior
|
||||||||||||||
| Interlobar sulci/fissuras |
|
Superolateral
|
Medial/inferior
|
||||||||||||||
| Lóbulo lombar |
|
Outros
|
|||||||||||||||
| Lóbulo insular |
Giro longo de ínsula -Giro curto de ínsula – Sulco circular de ínsula |
||||||||||||||||
| Geral |
Operculo – Pólos de hemisférios cerebrais |
||||||||||||||||
Algumas categorizações são aproximações, e algumas áreas de Brodmann abrangem gyri.
|
|||||||||||||||||
Esta página usa o conteúdo licenciado Creative Commons da Wikipedia (ver autores).