Relații de presiune, volum și temperatură în gazele reale
Pentru un gaz ideal, o reprezentare grafică a \(PV/nRT\) în funcție de \(P\) dă o linie orizontală cu o interceptare de 1 pe axa \(PV/nRT\). Cu toate acestea, gazele reale prezintă abateri semnificative de la comportamentul așteptat pentru un gaz ideal, în special la presiuni ridicate (Figura \(\PageIndex{1a}\)). Numai la presiuni relativ scăzute (mai puțin de 1 atm) gazele reale se apropie de comportamentul gazului ideal (Figura \(\(\PageIndex{1b}\)).
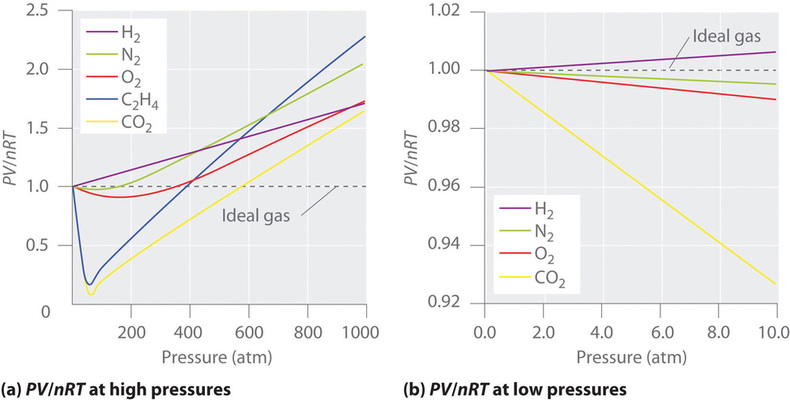
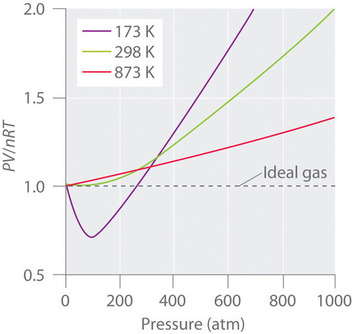
Gazele reale se apropie, de asemenea, mai mult de comportamentul gazului ideal la temperaturi mai ridicate, așa cum se arată în figura \(\PageIndex{2}\) pentru \(N_2\). De ce se comportă gazele reale atât de diferit de gazele ideale la presiuni ridicate și temperaturi scăzute? În aceste condiții, cele două ipoteze de bază care stau la baza legii gazelor ideale – și anume, că moleculele de gaz au un volum neglijabil și că interacțiunile intermoleculare sunt neglijabile – nu mai sunt valabile.
Pentru că se presupune că moleculele unui gaz ideal au volum zero, volumul disponibil pentru ele pentru mișcare este întotdeauna același cu volumul recipientului. În schimb, moleculele unui gaz real au volume mici, dar măsurabile. La presiuni scăzute, moleculele gazoase sunt relativ îndepărtate, dar pe măsură ce presiunea gazului crește, distanțele intermoleculare devin din ce în ce mai mici (Figura \(\PageIndex{3}\)). Ca urmare, volumul ocupat de molecule devine semnificativ în comparație cu volumul recipientului. În consecință, volumul total ocupat de gaz este mai mare decât volumul prezis de legea gazului ideal. Astfel, la presiuni foarte mari, valoarea măsurată experimental a PV/nRT este mai mare decât valoarea prezisă de legea gazului ideal.
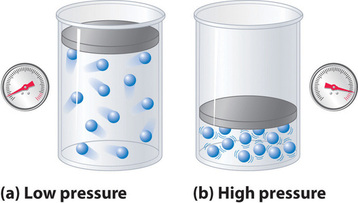
În plus, toate moleculele sunt atrase unele de altele printr-o combinație de forțe. Aceste forțe devin deosebit de importante în cazul gazelor la temperaturi scăzute și presiuni ridicate, unde distanțele intermoleculare sunt mai mici. Atracțiile dintre molecule reduc numărul de coliziuni cu peretele recipientului, un efect care devine mai pronunțat pe măsură ce numărul de interacțiuni atractive crește. Deoarece distanța medie dintre molecule scade, presiunea exercitată de gaz asupra peretelui recipientului scade, iar presiunea observată este mai mică decât cea așteptată (Figura \(\PageIndex{4}\)). Astfel, așa cum se arată în Figura \(\PageIndex{2}\), la temperaturi scăzute, raportul \(PV/nRT\) este mai mic decât cel prezis pentru un gaz ideal, un efect care devine deosebit de evident pentru gazele complexe și pentru gazele simple la temperaturi scăzute. La presiuni foarte mari, predomină efectul volumului molecular diferit de zero. Concurența dintre aceste efecte este responsabilă pentru minimul observat în graficul \(PV/nRT\) versus \(P\) pentru multe gaze.
Volumul molecular nenul face ca volumul real să fie mai mare decât cel prezis la presiuni ridicate; atracțiile intermoleculare fac ca presiunea să fie mai mică decât cea prezisă.
La temperaturi ridicate, moleculele au suficientă energie cinetică pentru a învinge forțele de atracție intermoleculare, iar efectele volumului molecular nenul predomină. Dimpotrivă, pe măsură ce temperatura scade, energia cinetică a moleculelor de gaz scade. În cele din urmă, se atinge un punct în care moleculele nu mai pot învinge forțele atractive intermoleculare, iar gazul se lichefiază (se condensează în lichid).
.