- Ce este o legătură covalentă polară?
- Proprietăți ale legăturilor covalente polare
- Exemple de legături covalente polare
- Apă (H2O)
- Clorura de hidrogen (HCl)
- Amoniacul (NH3)
- Bromură de hidrogen (HBr)
- Diferența dintre legăturile covalente polare și nepolare
- Legătura covalentă polară vs. legătura covalentă polară. Legătura covalentă nepolară
Ce este o legătură covalentă polară?
O legătură covalentă se formează atunci când doi atomi împart electroni între ei. Legătura covalentă este susceptibilă de a fi polară atunci când electronii sunt împărțiți în mod inegal. Asimetria apare din cauza diferenței dintre electronegativitățile celor doi atomi. Electronegativitatea este o măsură a tendinței unui atom de a atrage o pereche de electroni de legătură. Se măsoară folosind o scală cunoscută sub numele de scara Pauling și variază de la 0,7 la 4. Tabelul următor explică tipul de legătură chimică formată datorită acestei diferențe de electronegativitate .
| Tipul de legătură chimică | Diferența de electronegativitate |
|---|---|
| Covalentă nepolară | 0 |
| Covalentă ușor polară | 0.1 până la 0,4 |
| Covalentă polară | 0,5 până la 2 |
| Ionică | > 2 |
Cu cât diferența de electronegativitate este mai semnificativă, cu atât mai mare este polaritatea și rezistența legăturii. Prin urmare, legăturile covalente polare au o rezistență intermediară a legăturii.
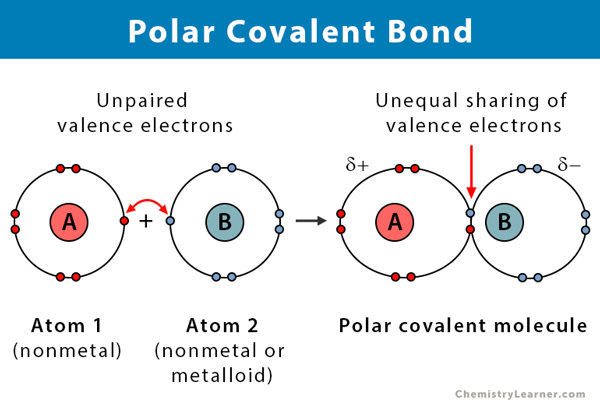
Proprietăți ale legăturilor covalente polare
Iată câteva date despre legăturile covalente polare.
- Se realizează între două nemetale sau între un nemetal și un metaloid
- Părtășirea inegală a electronilor într-un compus
- Diferența de electronegativitate între atomi este între 0.1 și 2
- Un capăt al legăturii este încărcat pozitiv, iar celălalt capăt este încărcat negativ
- Compușii polari se dizolvă într-un solvent polar
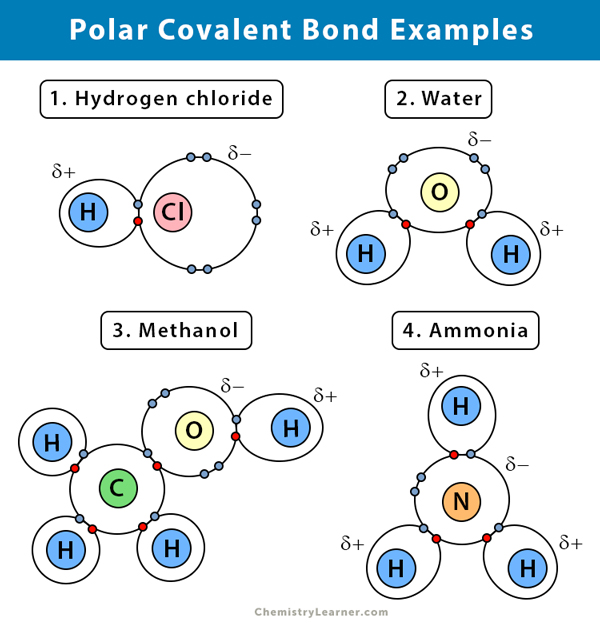
Exemple de legături covalente polare
Iată câteva exemple de legături covalente polare cu diferența de electronegativitate între cei doi atomi de legătură :
| Numele compusului | Formula moleculară | Legătura | Electronegativitatea | . diferență |
|---|---|---|---|---|
|
Apă |
H2O |
O-H |
||
| Fluorură de hidrogen | HF | H-F | 1.9 | |
| Clorură de hidrogen | HCl |
H-Cl |
0.9 | |
|
Bromură de hidrogen |
HBr |
HBr |
H-.Br |
|
|
Amonia |
NH3 |
NH3 |
N-.H |
|
|
Dioxid de sulf |
SO2 | S=O | 1 | |
| Sulfură de hidrogen | H2S | H-.S | 0.4 | |
| Metanol | CH3OH | O-H | 1,4 |
O explicație a legăturii covalente polare în unii compuși este dată mai jos.
Apă (H2O)
Apa este un solvent polar. O legătură covalentă polară se creează atunci când atomul de oxigen (O), fiind mai electronegativ decât hidrogenul, atrage spre el electronii comuni. Ca urmare, atomului de oxigen îi este asociată o sarcină parțial negativă. Hidrogenii (H), pe de altă parte, sunt în esență protoni și au asociată o sarcină pozitivă parțială.
Clorura de hidrogen (HCl)
Clorura de hidrogen este un compus covalent polar, deoarece atomul de clor (Cl) este mai electronegativ decât atomul de hidrogen (H). Astfel, clorul poartă o sarcină parțial negativă, în timp ce hidrogenul poartă o sarcină parțial pozitivă.
Amoniacul (NH3)
Amoniacul este o moleculă polară. Atomul central, azotul (N), este legat de trei atomi de hidrogen (H). Deoarece N este mai electronegativ decât H, electronii vor tinde să stea în jurul atomului de N.
Bromură de hidrogen (HBr)
Diferența de electronegativitate dintre hidrogen (H) și brom (Br) nu este prea mare. Prin urmare, gazul HBr are o legătură covalentă polarizată, iar atomul de hidrogen are o ușoară sarcină pozitivă, iar bromul are o ușoară sarcină negativă. Ca urmare, perechea de electroni este atrasă de brom.
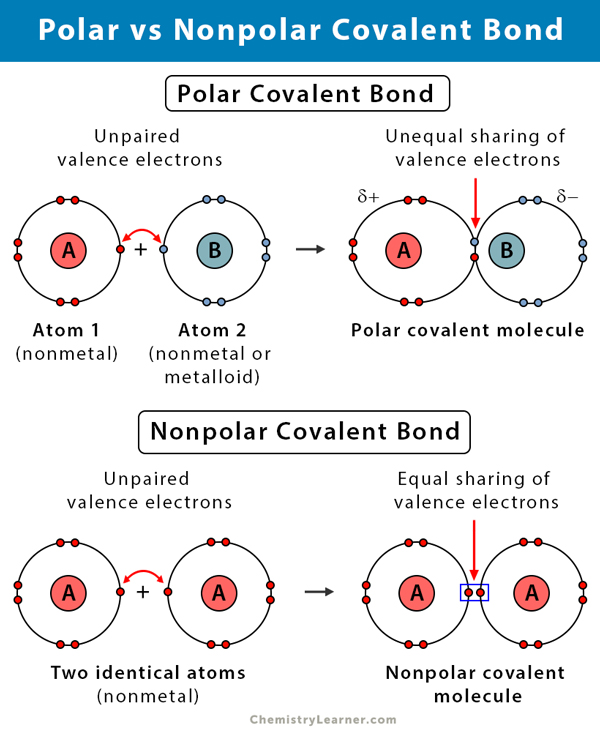
Diferența dintre legăturile covalente polare și nepolare
În tabelul următor se compară și se contrastează legăturile covalente polare și nepolare.
Legătura covalentă polară vs. legătura covalentă polară. Legătura covalentă nepolară |
||
| Polară | Nonpolară | |
|---|---|---|
|
Tipuri de atomi |
Între doi nemetali. cu electronegativități diferite |
Între doi nemetali cu aceleași electronegativități |
|
Diferența de electronegativitate |
0.1 – 2 |
|
|
Distribuția electronilor |
Asimetrică. Împărțire inegală. |
Simetrică. Partajare egală. |
|
Dislocarea electronilor partajați |
În direcția atomului mai electronegativ, făcând acea parte negativă |
Nici o deplasare. Neutru din punct de vedere electric. |
|
Moment dipolar |
Nu-.zero |
Zero |
|
Prezența altor tipuri de legături în compuși |
Legătura de hidrogen |
Legătura Van der Waals |
|
Afinitate față de apă |
Hidrofilă |
Hidrofobă |
|
Proprietăți fizice ale compușilor |
Fundare ridicată și puncte de topire și de fierbere |
Puncte de topire și de fierbere scăzute |
|
Volatilitatea lichidelor |
Volatilitate scăzută |
Volatilitate ridicată |
|
Solubilitatea compușilor |
Solubilitate în solvenți polari |
Solubilitate în solvenți nepolari |
|
Exemple |
Apă (H2O), amoniac (NH3) și clorură de hidrogen (HCl) |
Hidrogen (H2), oxigen (O2) și azot (N2) |
.