Relaciones de presión, volumen y temperatura en gases reales
Para un gas ideal, un gráfico de \(PV/nRT\) frente a \(P\) da una línea horizontal con una intercepción de 1 en el eje \(PV/nRT\). Los gases reales, sin embargo, muestran desviaciones significativas del comportamiento esperado para un gas ideal, particularmente a altas presiones (Figura \(\PageIndex{1a}\)). Sólo a presiones relativamente bajas (menos de 1 atm) los gases reales se aproximan al comportamiento de un gas ideal (Figura \(\PageIndex{1b})).
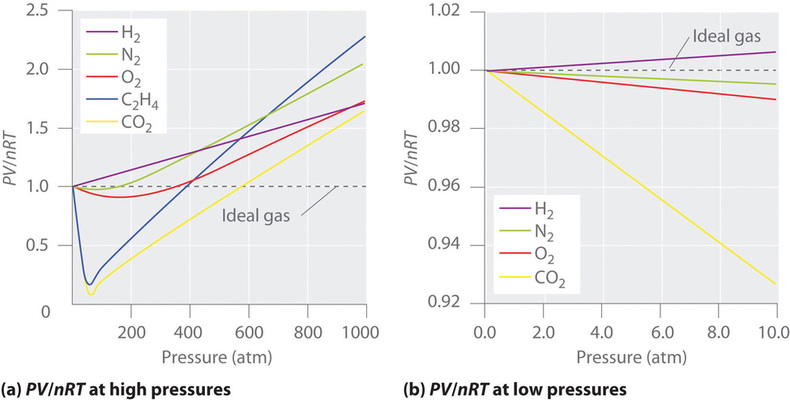
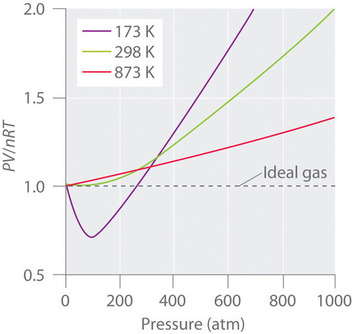
Los gases reales también se aproximan más al comportamiento de los gases ideales a temperaturas más altas, como se muestra en la Figura \(\PageIndex{2}) para \(N_2\). ¿Por qué los gases reales se comportan de forma tan diferente a los gases ideales a altas presiones y bajas temperaturas? En estas condiciones, las dos suposiciones básicas que subyacen a la ley de los gases ideales -a saber, que las moléculas de los gases tienen un volumen despreciable y que las interacciones intermoleculares son despreciables- ya no son válidas.
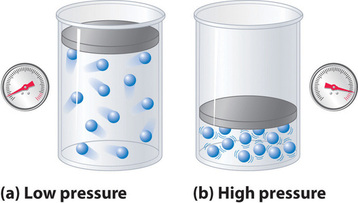
Debido a que se supone que las moléculas de un gas ideal tienen un volumen nulo, el volumen del que disponen para el movimiento es siempre el mismo que el volumen del recipiente. En cambio, las moléculas de un gas real tienen volúmenes pequeños pero medibles. A bajas presiones, las moléculas gaseosas están relativamente separadas, pero a medida que aumenta la presión del gas, las distancias intermoleculares son cada vez más pequeñas (Figura \(\PageIndex{3}\)). Como resultado, el volumen ocupado por las moléculas se vuelve significativo en comparación con el volumen del recipiente. En consecuencia, el volumen total ocupado por el gas es mayor que el volumen predicho por la ley de los gases ideales. Así, a presiones muy altas, el valor medido experimentalmente de PV/nRT es mayor que el valor predicho por la ley de los gases ideales.
Además, todas las moléculas son atraídas entre sí por una combinación de fuerzas. Estas fuerzas cobran especial importancia en los gases a bajas temperaturas y altas presiones, donde las distancias intermoleculares son más cortas. Las atracciones entre moléculas reducen el número de colisiones con la pared del recipiente, un efecto que se acentúa a medida que aumenta el número de interacciones atractivas. Debido a que la distancia media entre las moléculas disminuye, la presión ejercida por el gas sobre la pared del recipiente disminuye, y la presión observada es menor de lo esperado (Figura \(\PageIndex{4}\)). Así, como se muestra en la Figura \(\PageIndex{2}), a bajas temperaturas, la relación \(PV/nRT\) es menor que la predicha para un gas ideal, un efecto que se hace particularmente evidente para los gases complejos y para los gases simples a bajas temperaturas. A presiones muy altas, predomina el efecto del volumen molecular no nulo. La competencia entre estos efectos es responsable del mínimo observado en el gráfico de \(PV/nRT\) frente a \(P\) para muchos gases.
El volumen molecular no nulo hace que el volumen real sea mayor que el predicho a altas presiones; las atracciones intermoleculares hacen que la presión sea menor que la predicha.
A altas temperaturas, las moléculas tienen suficiente energía cinética para superar las fuerzas de atracción intermoleculares, y los efectos del volumen molecular no nulo predominan. Por el contrario, a medida que se reduce la temperatura, la energía cinética de las moléculas del gas disminuye. Finalmente, se alcanza un punto en el que las moléculas ya no pueden superar las fuerzas de atracción intermoleculares, y el gas se licua (se condensa en un líquido).