- ¿Qué es un enlace covalente polar?
- Propiedades de los enlaces covalentes polares
- Ejemplos de enlaces covalentes polares
- Agua (H2O)
- Cloruro de hidrógeno (HCl)
- El amoníaco (NH3)
- Bromuro de hidrógeno (HBr)
- Diferencia entre enlaces covalentes polares y no polares
- Enlace covalente polar frente a enlace covalente no polar. Enlace covalente no polar
¿Qué es un enlace covalente polar?
Un enlace covalente se forma cuando dos átomos comparten electrones entre ellos. El enlace covalente es probablemente polar cuando los electrones se comparten de forma desigual. La asimetría surge debido a la diferencia en las electronegatividades de los dos átomos. La electronegatividad es una medida de la tendencia de un átomo a atraer un par de electrones de enlace. Se mide utilizando una escala conocida como la escala de Pauling y va de 0,7 a 4. La siguiente tabla explica el tipo de enlace químico que se forma debido a esta diferencia de electronegatividad .
| Tipo de enlace químico | Diferencia de electronegatividad |
|---|---|
| Covalente no polar | 0 |
| Covalente ligeramente polar | 0.1 a 0,4 |
| Covalente polar | 0,5 a 2 |
| Iónico | > 2 |
Cuanto más significativa sea la diferencia de electronegatividad, mayor será la polaridad y la fuerza del enlace. Por lo tanto, los enlaces covalentes polares tienen una fuerza de enlace intermedia.
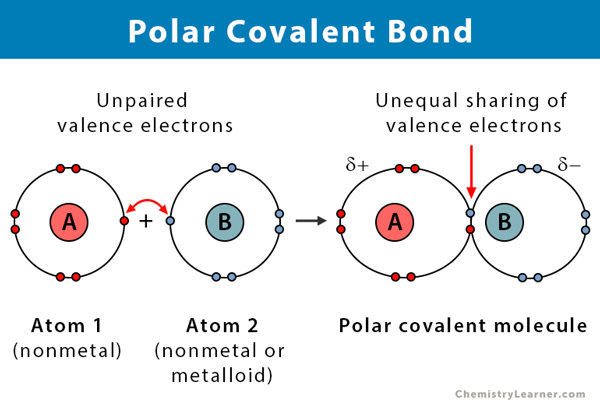
Propiedades de los enlaces covalentes polares
Aquí hay algunos datos sobre los enlaces covalentes polares.
- Tiene lugar entre dos no metales o entre un no metal y un metaloide
- Compartición desigual de electrones en un compuesto
- La diferencia de electronegatividad entre los átomos está entre 0.1 y 2
- Un extremo del enlace está cargado positivamente, y el otro extremo está cargado negativamente
- Los compuestos polares se disuelven en un disolvente polar
Ejemplos de enlaces covalentes polares
Aquí hay algunos ejemplos de un enlace covalente polar con la diferencia de electronegatividad entre los dos átomos enlazantes :
| Nombre del compuesto | Fórmula molecular | Enlace | Electronegatividad diferencia |
|---|---|---|---|
|
Agua |
H2O |
O-H |
|
| Fluoruro de hidrógeno | HF | H-F | 1.9 |
| Cloruro de hidrógeno | HCl |
H-Cl |
0.9 |
|
Bromuro de hidrógeno |
HBr |
H-Br |
|
|
Amoniaco |
NH3 |
N-H |
|
|
Dióxido de azufre |
SO2 | S=O | 1 |
| Sulfuro de hidrógeno | H2S | H-S | 0.4 |
| Metanol | CH3OH | O-H | 1,4 |
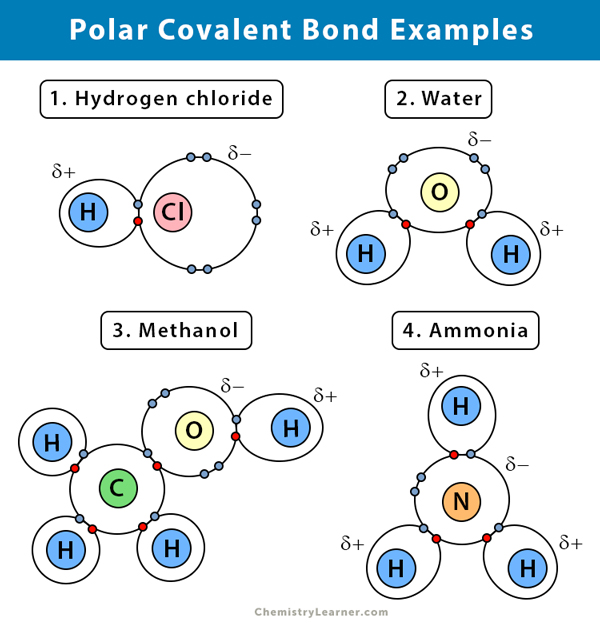
A continuación se explica el enlace covalente polar en algunos compuestos.
Agua (H2O)
El agua es un disolvente polar. Un enlace covalente polar se crea cuando el átomo de oxígeno (O), al ser más electronegativo que el hidrógeno, atrae hacia sí los electrones compartidos. Como resultado, el átomo de oxígeno tiene una carga parcial negativa asociada. Los hidrógenos (H), por otro lado, son esencialmente protones y tienen una carga positiva parcial asociada a ellos.
Cloruro de hidrógeno (HCl)
El cloruro de hidrógeno es un compuesto covalente polar ya que el átomo de cloro (Cl) es más electronegativo que el de hidrógeno (H). Así, el cloro lleva una carga parcial negativa, mientras que el hidrógeno lleva una carga parcial positiva.
El amoníaco (NH3)
El amoníaco es una molécula polar. El átomo central, el nitrógeno (N), está unido a tres átomos de hidrógeno (H). Como el N es más electronegativo que el H, los electrones tenderán a colgarse alrededor del átomo de N.
Bromuro de hidrógeno (HBr)
La diferencia de electronegatividad entre el hidrógeno (H) y el bromo (Br) no es demasiado alta. Por lo tanto, el gas HBr tiene un enlace covalente polarizado, y el átomo de hidrógeno tiene una ligera carga positiva, y el bromo una ligera carga negativa. Como resultado, el par de electrones es atraído por el bromo.
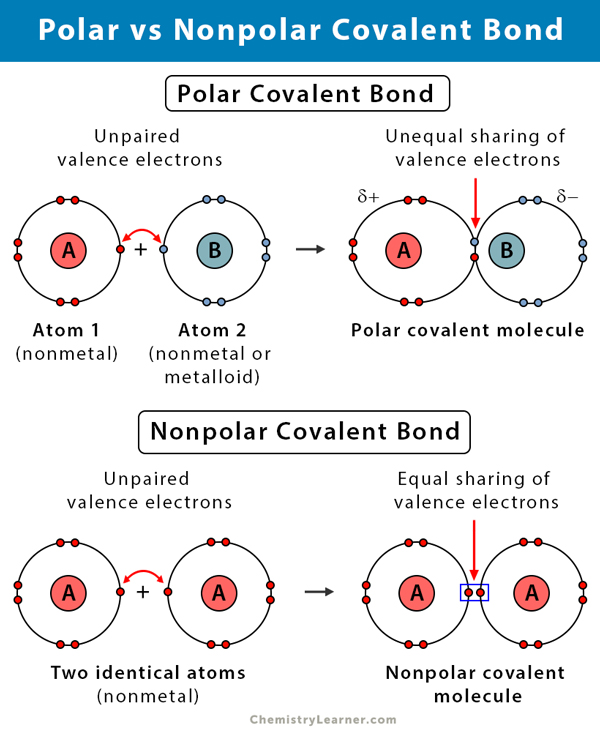
Diferencia entre enlaces covalentes polares y no polares
La siguiente tabla compara y contrasta los enlaces covalentes polares y no polares.
Enlace covalente polar frente a enlace covalente no polar. Enlace covalente no polar |
||
| Polar | No polar | |
|---|---|---|
|
Tipos de átomos |
Entre dos no metales con diferentes electronegatividades |
Entre dos no metales de iguales electronegatividades |
|
Diferencia de electronegatividad |
0.1 – 2 |
|
|
Distribución de electrones |
Asimétrica. Reparto desigual. |
Simétrica. Reparto igual. |
|
Desplazamiento de los electrones compartidos |
Hacia el átomo más electronegativo, haciendo esa parte negativa |
Sin desplazamiento. Eléctricamente neutro. |
|
Momento dipolar |
No-cero |
Cero |
|
Presencia de otros tipos de enlaces en los compuestos |
Enlace de hidrógeno |
Enlace Van der Waals |
|
Afinidad hacia el agua |
Hidrófilo |
Hidrófobo |
|
Propiedades físicas de los compuestos |
Altos puntos de fusión y puntos de fusión y ebullición |
Puntos de fusión y ebullición bajos |
|
Volatilidad de los líquidos |
Baja volatilidad |
Alta volatilidad |
|
Solubilidad de los compuestos |
Soluble en disolventes polares |
Soluble en disolventes no polares |
|
Ejemplos |
Agua (H2O), amoníaco (NH3) y cloruro de hidrógeno (HCl) |
Hidrógeno (H2), oxígeno (O2) y nitrógeno (N2) |
.