- Qué es el aluminio
- Donde se puede encontrar
- Historia
- Clasificación, propiedades y características del aluminio
- Propiedades generales
- Propiedades físicas
- Propiedades químicas
- Datos atómicos del aluminio
- ¿Para qué se utiliza comúnmente el aluminio
- ¿Tiene el elemento algún efecto tóxico
- Hechos interesantes
- Precio del aluminio
Qué es el aluminio
El aluminio (pronunciado como ah-LOO-men-em) es un metal blando y ligero, representado por la sustancia química Al. Existe en forma de varios compuestos minerales, teniendo una amplia gama de usos comerciales debido a su naturaleza no tóxica y su alta resistencia a la corrosión. Tiene 15 isótopos con números de masa que van del 22 al 35, de los cuales sólo el Al-26 es radiactivo con una vida media de 7,17×105años y el Al-27 existe de forma natural.

Donde se puede encontrar
El elemento constituye alrededor del 8,1% de la corteza terrestre, lo que lo convierte en uno de los metales más abundantes. Se puede encontrar combinado con otros metales en forma de minerales de silicato como la criolita y la bauxita. Su producción a escala comercial se realiza mediante un costoso proceso químico llamado proceso Hall-Heroult que implica una gran cantidad de energía.
Historia
Origen de su nombre: Su nombre deriva de la palabra latina para el alumbre llamada ‘alumen’ que significa sal amarga.
Quién lo descubrió: Hans Oersted
Cuándo, dónde y cómo se descubrió
Durante el siglo III en China se creía que la tumba de un líder militar llamado Chou-Chu contenía aproximadamente un 85% de aluminio. En el año 1700 también se acuñó la presencia del óxido del metal, pero no se pudieron hacer más análisis. De hecho, el químico de Cornualles Henry Davy intentó extraer el sodio y el potasio de sus respectivos óxidos, pero no se pudo obtener el Al.
No fue hasta 1825 cuando Oersted en Copenhague, Dinamarca, calentó cloruro de aluminio con potasio y extrajo una forma impura del metal. En 1827 Friedrich Wohler, el químico alemán, repitió finalmente el método utilizando sodio y obtuvo una muestra pura .

Clasificación, propiedades y características del aluminio
Propiedades generales |
|
| Masa atómica relativa/media | 26.982 |
| Masa atómica/peso | 26,982 unidades de masa atómica |
| Masa molecular/peso molecular | 26.982 g/mol |
| Número de masa | 27 |
Propiedades físicas |
|
| Color/Aspecto físico | Blanco plateado |
| Punto de fusión/punto de congelación | 660.323°C (1220.581°F) |
| Punto de ebullición | 2519°C (4566°F) |
| Densidad | 2.70 g/cm3 |
| Estándar/Estado físico de la materia a temperatura ambiente normal (sólido/líquido/gas) | Sólido |
| Ductilidad | Sí |
| Maleabilidad | Sí |
| Dureza | 2.9 Mohs |
| Conductividad eléctrica | 37.6676 x 106 Sm-1 |
| Conductividad térmica | 237 Wm-1K-1 |
| Capacidad calorífica específica | 0.90 Jg-1K-1 |
| Gravedad específica | 2,8 |
| Resistividad | 2.65 x10-8ρ (ohm m) |
| Resistencia a la tracción | 90 Mpa |
| Coeficiente de temperatura | 0.00393 α/°C |
| Cofrecimiento de tracción | 276 Mpa |
| Coeficiente de expansión térmica lineal/transferencia de calor | 23,1 10-6K-1 |
| Coeficiente de fricción | 1.35 |
Propiedades químicas |
|
| Inflamabilidad | Inflamable |
| Estados de oxidación (números) | 3 |
Datos atómicos del aluminio
| Electrones de valencia | 1 | ||||||
| Configuración de los electrones (configuración de los gases nobles) | 3s23p1 | ||||||
| Estructura de los cristales | Cúbicos centrados en la cara | ||||||
| Se trata de una estructura de los cristales.cúbica centrada | |||||||
| Constante/parámetro de red | 0.405 nm | ||||||
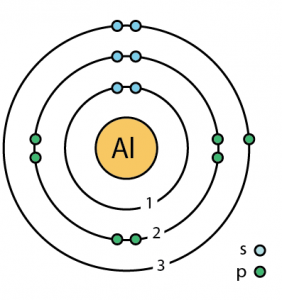
| Niveles de energía | |||||||
| Primer nivel de energía | 2 | ||||||
| Segundo nivel energético | 8 | ||||||
| Tercer nivel energético | 3 | ||||||
| Estructura atómica | |||||||
| – Número de electrones | 13 | ||||||
| – Número de neutrones | 14 | ||||||
| – Número de protones | 13 | ||||||
| Radio del átomo | |||||||
| – Radio atómico | 1.84 Å | ||||||
| – Radio covalente | 1,24 Å | ||||||
| Electronegatividad | 1.61 | ||||||
| Carga del ion | +1 | ||||||
| Energía de ionización
(kJmol-1) |
1ª | 2ª | 3ª | 4ª | 5ª | 6ª | 7ª |
| 577.539 | 1816.679 | 2744.781 | 11577.469 | 14841.857 | 18379.49 | 23326.3 | |
¿Para qué se utiliza comúnmente el aluminio
- Se utiliza en una amplia gama de productos como paneles para puertas de vallas, revestimientos, latas, tubos, cables, láminas, techos, frituras, sartenes, barandillas, revestimientos, cubiertas para patios, ruedas, varillas para soldar, puertas de pantalla, radiadores, depósitos de gas y postes .
- Un buen conductor de la electricidad, Al hace un sustituto ideal para el cobre en términos de costo y peso para hacer líneas de transmisión eléctrica .
- El aluminio se alea con otros metales como el cobre, el magnesio, el silicio y el manganeso para fabricar cojinetes de bolas, piezas de automóviles, cohetes y aviones.
- El metal se utiliza a menudo como revestimiento reflectante en los espejos de los telescopios, los juguetes, los paquetes y los papeles decorativos para protegerlos de la luz y el calor.
- Como alternativa a las costosas baterías y a los combustibles líquidos, las pilas/baterías de aire de iones de aluminio son más cómodas y portátiles para su uso .

¿Tiene el elemento algún efecto tóxico
La inhalación de polvos o humos que contienen Al afecta al sistema respiratorio, provocando tos y otros trastornos relacionados con los pulmones. La ingestión prolongada del metal en forma de algunos productos orales puede ser perjudicial para los riñones, así como aumentar la posibilidad de padecer la enfermedad de Alzheimer .

Hechos interesantes
- Antes del descubrimiento del proceso Hall-Heroult, el Al puro era más caro que el oro y por ello se le llamaba el “Rey de los Metales”.
- El metal puede ser reciclado varias veces sin comprometer su calidad .

Precio del aluminio
El coste del puro puede variar entre 0,9 y 1$.
- http://www.rsc.org/periodic-table/element/13/aluminium
- https://education.jlab.org/itselemental/ele013.html
- https://pubchem.ncbi.nlm.nih.gov/compound/aluminum#section=Computed-Properties
- https://www.chemicool.com/elements/aluminum.html
- http://hyperphysics.phy-astr.gsu.edu/hbase/Tables/rstiv.html
- https://www.tedpella.com/company_html/hardness.htm
- http://asm.matweb.com/search/SpecificMaterial.asp?bassnum=ma6061t6
- https://study.com/academy/answer/how-many-valence-electrons-does-aluminum-have.html
- http://www.chemicalelements.com/elements/al.html
- https://www.sciencedirect.com/science/article/pii/S0378775307002236
- https://www.atsdr.cdc.gov/phs/phs.asp?id=1076&tid=34