Co je to lutecium
Lutecium (vyslovuje se jako loo-TEE-shee-em) je stříbřitý, tvrdý, hustý kov vzácných zemin, který se řadí mezi lanthanoidy a označuje se chemickou značkou Lu . Jedná se o poslední chemický prvek patřící do řady lanthanoidů , přičemž nejrozšířenějším, přirozeně stabilním izotopem je 175Lu (97,4% zastoupení). Další dlouhožijící radioaktivní izotop 176Lu má dobu poločasu rozpadu 3,78 X 1010 let .

Lutecium Symbol
Kde se lutecium nachází
Lutecium se stejně jako ostatní lanthanoidy komerčně získává z minerálu monazitu . Protože se v monazitu vyskytuje v malém množství (asi 0,003 %) , může být jeho extrakce obtížná a provádí se redukcí bezvodého fluoridu pomocí kovového vápníku . Přestože se prvek vyskytuje ve stopovém množství téměř ve všech minerálech obsahujících yttrium, lze je považovat za přírodní zdroje lutecia . Mezi tři země s největší produkcí lutecia patří Čína, Rusko a Malajsie, zatímco mezi tři země s největšími zásobami patří Čína, země SNS a USA .

Lutecium
Historie
Původ jeho názvu:
Kdo tento prvek objevil: Název prvku je odvozen od římského slova “Lutetia”, což je starověký název francouzského města Paříž: Přestože prvek nezávisle na sobě objevili francouzský chemik Georges Urbain, americký chemik Charles James a rakouský vědec Carl Auer von Welsbach, zásluhy za objev připadly Urbainovi, protože jako první podal zprávu o výsledcích .
Kdy a jak byl objeven
Minerál gadolinit neboli yttrium, objevený v roce 1794, byl zdrojem yttria, terbia, erbia a dalších prvků vzácných zemin . Švýcarský chemik Jean Charles Marignac rozdělil erbium na dvě složky včetně ytterbia a erbia, z nichž ytterbium bylo považováno za sloučeninu ytterbia .
V roce 1907 Georges Urbain při pokusech na pařížské Sorbonně úspěšně izoloval ytterbium na dva prvky, které nazval lutecium a neoytterbium . Později však chemici tyto prvky přejmenovali na lutecium, respektive ytterbium . Carl Auer von Welsbach oddělil prvek od ytterbia a pojmenoval jej cassipoium podle cirkumpolárního souhvězdí Cassiopeia . Prvek úspěšně extrahoval také Charles James na univerzitě v New Hampshire .
Přestože je jeho příprava obtížná, byl v roce 1953 vyroben čistý kov lutecium .
Identifikace lutecia |
|||
| Atomové číslo | 71 | ||
| Číslo CAS | 7439-94-.3 | ||
| Pozice v periodické tabulce | Skupina | Období | Blok |
| Lanthanidy | 6 | f | |

Umístění Lutecia v periodické tabulce
Vlastnosti a charakteristika lutecia
Všeobecné vlastnosti |
||||||||||||||||
| Atomová hmotnost | 174.967 amu | |||||||||||||||
| Relativní atomová hmotnost | 174.967 | |||||||||||||||
Fyzikální vlastnosti |
||||||||||||||||
| Barva | Stříbřitě bílá | |||||||||||||||
| Teplota tání/teplota tuhnutí | 1663 °C, 3025 °F | |||||||||||||||
| Teplota varu | 3402 °C, 6156 °F | |||||||||||||||
| Hustota | 9.84 g cm-3 | |||||||||||||||
| Stav látky při pokojové teplotě (pevná látka/kapalina/plyn) | Pevná látka | |||||||||||||||
| Tvrdost | ||||||||||||||||
| – Brinell | 893 MPa | |||||||||||||||
| – Mohs | 2.6 | |||||||||||||||
| – Vickers | 1160 MPa | |||||||||||||||
| Elektrická vodivost | 1.8X106 S/m | |||||||||||||||
| Tepelná (tepelná) vodivost | 16 W/(m K) | |||||||||||||||
| Měrné teplo | 154 J kg-1 K-1 | |||||||||||||||
| Modul pružnosti | 47.6 GPa | |||||||||||||||
| Modul pružnosti ve smyku | 27,2 GPa | |||||||||||||||
| Youngův modul | 68.6 GPa | |||||||||||||||
| Tlak par | ||||||||||||||||
| – Teplota (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Tlak (Pa) | – | – | – | 3.28X 10-11 | 1,59X 10-7 | 6,79X 10-5 | 6,28X 10-3 | 0,211 | 3,18 | 26.7 | – | |||||
Chemické vlastnosti |
||||||||||||||||
| Oxidační stavy | 3 | |||||||||||||||
| Izotopy | Izotop | Hmotnost | Výskyt | Half-životnost | Způsob rozpadu | |||||||||||
| 175Lu | 174.941 | 97,40 | – | – | ||||||||||||
| 176Lu | 175,943 | 2,60 | 3.73 X 1010 let | β-
β+ EC |
||||||||||||
Atomické údaje lutecia (prvek 71)
| Valence elektrony | 3 | ||||||||
| Kvantová čísla | 2D3/2 | ||||||||
| Elektronová konfigurace (konfigurace vzácného plynu) | 4f145d16s2 | ||||||||
| Atomová struktura | |||||||||
| – Počet elektronů | 71 | ||||||||
| – Počet neutronů | . | 104 | |||||||
| – Počet protonů | 71 | ||||||||
| Poloměr atomu | |||||||||
| – Atomový poloměr | 2.24 Å | ||||||||
| – Kovalentní poloměr | 1,74 Å | ||||||||
| Elektronegativita (Paulingova stupnice) | 1,0 | ||||||||
| Elektronová afinita | 32.81 kJ mol-1 | ||||||||
| Ionizační energie (kJ mol-)1) | 1. | 2. | 3. | 4. | 5. | 6. | 7. | 8. | |
| 523.516 | 1341.1 | 2022.275 | 4365.96 | 6445.2 | – | – | – | ||
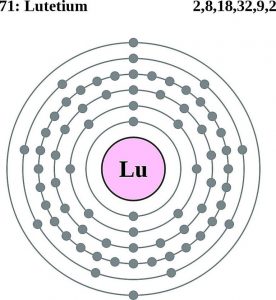
Luteciová elektronová konfigurace (Bohrův model)
K čemu se používá
Má malé praktické využití mimo vědecký výzkum . Níže je uvedeno několik komerčních využití lutecia:
- Může být použito jako katalyzátor pro krakování ropných produktů v ropných rafineriích .
- Radioimunoterapie s lutecium-177-dotátem se používá jako forma léčby rakoviny, zatímco lutecium-176 se používá pro radiometrické datování meteoritů .
- Oxyortosilikát lutecia se používá v detektorech PET (pozitronová emisní tomografie) pro provádění lékařského skenování, které vytváří 3D obraz buněčné aktivity v těle .
Možné účinky na zdraví
Lutecium má nízkou toxicitu a žádné známé biologické funkce v lidském těle ; i když se předpokládá, že je schopno pomáhat zvyšovat metabolismus. Předpokládá se také, že představuje nebezpečí výbuchu .
Zajímavá fakta
- Lutecium je nejtvrdší a nejhustší prvek ze skupiny lanthanoidů .
- Ve sloučeninách se vyskytuje zpravidla v trojmocném stavu, Lu3+ .
- Prvek je někdy vizuálně znázorňován obrázkem vycházejícím z erbu Paříže .
Cena lutecia
Čistá forma lutecia stojí asi 350 dolarů za gram , ale ve velkém stojí asi 7000 dolarů za 100 gramů .
- http://www.rsc.org/periodic-table/element/71/lutetium
- https://education.jlab.org/itselemental/ele071.html
- https://www.livescience.com/38425-lutetium.html
- https://www.webelements.com/lutetium/isotopes.html
- https://www.chemicool.com/elements/lutetium.html
- http://periodictable.com/Elements/071/data.html
- http://web.newworldencyclopedia.org/entry/Lutetium
- https://hobart.k12.in.us/ksms/PeriodicTable/lutetium.htm