Předmluva
Tento článek nabízí osobní vizi toho, co by mohlo být potřeba, aby fágová terapie konečně prorazila jako hlavní antibakteriální nástroj. Je ovlivněn historickými i nedávnými neúspěchy a nejistotami v oblasti fágové terapie a snaží se najít řešení na základě budoucích a nově vznikajících technologií, které mají modelovat vědu a společnost zítřka.
Fágová terapie
Bakteriofágy (fágy) jsou viry bakterií. Od nepaměti řídí růst a šíření svých bakteriálních hostitelů. Bakteriální viry jsou nejrozšířenějšími životními entitami v naší biosféře. Odhaduje se, že v oceánech je 10milionkrát více virů než hvězd ve vesmíru, a kdyby se všechny fágy na Zemi poskládaly na sebe, táhla by se tato věž dál než nejbližších 60 galaxií (Suttle, 2013). Lze je snadno nalézt všude tam, kde se daří bakteriím: v kanalizaci, řekách nebo v moči a stolici pacientů. Fágy lidských bakteriálních patogenů se nejčastěji skládají z ikosaedrické hlavy, koule s 20 plochými stěnami tvořené bílkovinami a obsahující genom nukleové kyseliny, k níž je připojen bílkovinný ocásek. Když přísně lytický fág přilne svými ocasními vlákny a hroty k povrchu cílové bakterie, stříkačkovitý obal ocasu se smrští a jádro ocasu prorazí bakteriální buněčnou stěnu a vstříkne genom fága do periplazmy bakteriální buňky. Bakteriální mechanismus syntézy DNA a proteinů je okamžitě unesen, aby vytvořil kopie fága. Některé fágy rozřezávají bakteriální DNA na kousky. Po latentní době v řádu minut až hodin nově vytvořené fágy vyrazí ze svých bakteriálních hostitelů, kteří jsou při tom usmrceni. Potomci fágů, kterých mohou být stovky na jednu bakterii, se pak vydají hledat nové hostitelské bakterie, aby je infikovali. Fágy tak lze považovat za samoreplikující se antimikrobiální látky. Důležité je, že fágy se vyvinuly tak, aby infikovaly pouze určité cílové bakterie a byly neškodné pro buňky savců.
Předčasné důkazy o látkách podobných virům s antibakteriální aktivitou podal anglický bakteriolog Frederick Twort a francouzsko-kanadský mikrobiolog Felix d’Hérelle v roce 1915, resp. 1917 (Sulakvelidze et al., 2001). V roce 1919 d’Hérelle poprvé využil terapeutický potenciál fágů, když jimi v Paříži vyléčil chlapce trpícího úplavicí. Fágová terapie byla okamžitě uznána jako terapeutický přístup k léčbě bakteriálních infekcí a komercializaci přípravků fágové terapie podniklo několik společností, například L’Oréal v Evropě a Eli Lilly Company ve Spojených státech (Sulakvelidze et al., 2001). V roce 1923 založil gruzínský mikrobiolog Giorgi Eliava v gruzínském Tbilisi Eliavův institut, který se věnoval výzkumu fágové terapie. Byl to začátek rozsáhlého výzkumu a vývoje fágové terapie v bývalém Sovětském svazu. První použití fágové terapie však bylo často nespolehlivé a probíhal také výzkum antibiotik. Úspěšné používání penicilinu během druhé světové války a jeho následný celosvětový prodej vedly k tomu, že západní vědci ztratili o fágovou terapii zájem. Sovětští vědci naopak pokračovali ve vývoji fágové terapie a publikovali své výsledky, ale kvůli železné oponě se jejich znalosti a zkušenosti nerozšířily do celého světa (Sulakvelidze et al., 2001). Na počátku třetího tisíciletí podnítila rostoucí zdravotní zátěž infekcí způsobených bakteriemi rezistentními vůči antibiotikům (Cassini et al., 2019) obnovený celosvětový zájem o fágovou terapii jako o další reálný nástroj klinické léčby bakteriálních infekcí (Thiel, 2004). Po celém světě vznikají centra fágové terapie, která jdou ve stopách institutu Eliava a jednotky fágové terapie v Hirszfeldově institutu v polské Vratislavi (Miêdzybrodzki et al., 2012).
Rok 2035
Přenesme se do budoucnosti Země roku 2035, pochmurného světa, který se vyznačuje přelidněním, velkým narušením ekosystémů, globálním oteplováním a xenofobií.
Když se doktor John Iverian, mikrobiolog v důchodu, máchal ve vaně, náhle ucítil nesmírně bolestivé bodnutí v zátylku, po němž následoval zvuk podobný vrtuli malého letadla. Zkontroloval okolí a koutkem oka spatřil podivný velký hmyz s dlouhýma plazivýma nohama a tykadly, který seděl na zdi vedle jeho designové vany. Osuri, systém řízení domácnosti Iverianova podkrovního bytu v centru Antverp, identifikoval hmyz jako hnědého smraďocha Halyomorpha halys, který se rozšířil po celém světě. Osuriho zpráva, promítaná na jedné z videoobrazovek v koupelně, zmiňovala, že lidé, kteří byli pokousáni, měli zpočátku na kůži v místě kousnutí malou červenou bolístku. Pokud byla rána po kousnutí ponechána bez dozoru, otékala a vytvářela hnis. Unavený a mourovatý, nonšalantní Iverian vyšel z vany a šel si lehnout. Rozhodl se, že nebude provádět složitý postup ošetření rány, který mu důrazně doporučil Osuri. Brzy ráno se však kousnutí změnilo v nekrotickou ránu vykazující jasné známky infekce.
Iverian znepokojeně aktivoval své zařízení Phage-BEAM. BEAM byla zkratka pro “Bedside Energized Anti-Microbial”. Přístroj měl velikost a tvar krabice od bot, ale elegantnější a uhlazenější vzhled. Na boku bezešvé bílé smaltované krabice byl barevnými písmeny vyveden název přístroje a jeho výrobce. Iverian vyjmul tampon ze sterilního obalu a jemně jím přejel po celé ploše rány, přičemž se ujistil, že exsudát z rány důkladně smáčí vatovou špičku tamponu. Když se tampon přiblížil k oblasti “vložit vzorek” v krabičce, jakoby zázrakem se otevřela malá dvířka a uvolnila deseticentimetrový hologram laborantky jménem Marcia. Ukázala Iverianovi, kam má vzorek vložit. Marcia byla vyvinuta tak, aby klienty provedla testovacím postupem. “Pro dosažení nejlepších výsledků vložte, prosím, novou kazetu s fágovým biologickým inkoustem, doktore Iveriane,” řekla Marcia. Stejně jako kdysi u loňských 2D tiskáren byla cena bioinkoustových kazet téměř stejně vysoká jako cena samotného zařízení Phage-BEAM. Podle serveru “Business Insider” byl fágový bio-ink druhou nejdražší tekutinou na Zemi, hned po Chanelu č. 8. Naštěstí jako jeden z vynálezců získal Iverian právo mít vždy zdarma k dispozici nejnovější verzi tohoto zařízení, včetně nepřetržité dodávky činidel.
Iverian dokonale věděl, jak zařízení funguje, takže Marciinu pomoc nepotřeboval. Nejprve ze špičky stěru extrahoval DNA a určil metagenom – veškerý genetický materiál přítomný ve vzorku, včetně infikujících bakterií. Poté byla tato genetická data odeslána na zabezpečený server “Phage XChange”, kde složitý algoritmus řízený umělou inteligencí předpověděl sekvenci genomu fága, který s největší pravděpodobností lyzoval infikující bakterie identifikované v metagenomu a měl u pacienta vyvolat nejslabší imunitní reakci. Údaje o genomu fága byly odeslány do zařízení Phage-BEAM, které nejprve syntetizovalo genom fága a poté fág pomocí patentovaného systému výroby fágů bez bakterií.
Za 1 hodinu po odběru vzorků by zařízení vyrobilo terapeutický fágový produkt připravený k použití. Výsledky postupu krok za krokem by se přenášely na obrovskou domácí video obrazovku v Iverianově obývacím pokoji. Iverian seděl ve svém křesle LC2, poslouchal Mozartovu Velkou mši c moll a s napětím čekal na výsledky. Měl z toho špatný pocit. Z výsledku Iverianovi přeběhl mráz po zádech. Identifikován bakteriální patogen: Streptococcus pyogenes kmen FE-2033! Osuri okamžitě aktivoval protokol varování před infekcí, poslal zprávu Světovému centru pro kontrolu nemocí a promítl znepokojivé základní informace o smrtícím masožravém bakteriálním kmeni, který byl od roku 2033 považován za bezprostřední hrozbu pro veřejné zdraví. Iverian na okamžik zvažoval, že infikovanou ránu a část okolní zdravé tkáně vyřízne kuchyňským nožem, ale uklidnil se a rozhodl se počkat a aplikovat blížící se přípravek Phage-BEAM. O hodinu později zařízení Phage-BEAM vyrobilo syntetické fágy. Tyto fágy byly poté smíchány s izolovanými bakteriemi ve validačním modulu, aby se otestovala jejich účinnost in vitro. O patnáct minut později dostala společnost Iverian zelenou k zahájení léčby. Společnost Iverian aplikovala fágy v pomalu se uvolňujícím obvazu na ránu na bázi hydrogelu, který byl nejprve smíchán s koncentrovanou suspenzí fágů vyrobenou zařízením Phage-BEAM a obsahoval také synergická antibiotika. Hydrogel dočasně zmírnil bolest, což ho dále uklidnilo. Iverian aplikaci hydrogelu s fágy a antibiotiky opakoval jednou denně. Infekce v ráně se zlepšila během 24 hodin a po 7 dnech byla rána téměř zcela zhojena. Iverianova potenciálně život ohrožující infekce byla úspěšně léčena, včas a bez opuštění domova. Po mnoho předchozích desetiletí však nebylo jisté, zda fágová terapie prorazí a stane se široce aplikovaným a klinicky užitečným antibakteriálním nástrojem. Lékařskému světu chvíli trvalo, než si uvědomil, že fágová terapie nemusí být totožná s antibiotickou terapií, a to především kvůli zvláštnostem účinných látek, fágů.
Některé důležité zvláštnosti fágů
Fágy vykazují řadu vlastností, které se liší od antibiotik a které bránily jejich vývoji jako farmaceutických produktů a použití v terapii. Za prvé, mají tendenci být specifické, pokud jde o to, které bakterie infikují. V lepším případě se zaměří na značnou část jednoho jediného bakteriálního druhu, ale v horším případě infikují pouze malý počet kmenů v rámci jednoho druhu. Terapeutické fágy tak mohou být vybrány tak, aby zabíjely především jeden bakteriální druh nebo jeho klinicky relevantní podskupinu a ušetřily pacientovi prospěšné bakterie (např. střevní, kožní nebo ústní komenzální flóru). Většina rutinně používaných antibiotik má naproti tomu široké spektrum účinku, což může způsobit “vedlejší škody” na komenzálních mikrobiomech pacienta, které následně mohou vést k nežádoucím účinkům, jako je selekce bakteriálních druhů rezistentních na antibiotika (např. Clostridium difficile) nebo průjem spojený s antibiotiky (Jernberg et al., 2010). Nevýhodou fágové specifity je, že před zahájením fágové terapie je třeba identifikovat infikující bakterie. Při empirické antibiotické terapii se naproti tomu obvykle používají širokospektré koktejly antibiotik, které působí na množství grampozitivních a gramnegativních bakterií a na různé houby. Pokud je známo více informací (např. z bakteriální kultivace), může léčba spočívat v použití antibiotik s úzkým spektrem, která jsou cíleněji zaměřena na bakterie nebo houby, u nichž bylo zjištěno, že způsobují onemocnění.
Zdruhé, bakterie a fágy jsou zapojeny do vztahu hostitel-parazit. Přísně lytické fágy jsou v prostředí všudypřítomné a k dokončení svého životního cyklu vyžadují smrt svého bakteriálního hostitele. Bez hostitele fágy nemohou existovat. Fágy provádějí selekci odolných hostitelů, kteří zase provádějí selekci účinných fágů. Výsledkem je tzv. antagonistická koevoluce, závody ve zbrojení mezi bakteriemi a fágy, charakterizované vzájemnou evolucí bakteriální rezistence a infekčnosti fágů (Buckling a Rainey, 2002). Stejně jako vůči většině antimikrobiálních látek se tak bakterie stanou rezistentní i vůči fágům (Luria a Delbrück, 1943; Schooley et al., 2017), ale na rozdíl od statických antibiotik mají fágy schopnost překonávat bakteriální rezistenci (Buckling a Rainey, 2002). Existují nicméně náznaky, že bakterie a fágy nebudou donekonečna zvyšovat svou příslušnou rezistenci a infekčnost (Fortuna et al., 2019).
Přístupy fágové terapie
V době oživení fágové terapie na počátku roku 2000 byly vyvinuty dva odlišné přístupy fágové terapie (Pirnay et al., 2011). V rámci přístupu, který by se dal nazvat přístupem “one-size-fits-all”, byly použity definované širokospektré koktejly fágů, které měly zasáhnout většinu bakterií podezřelých z vyvolání určitých infekčních onemocnění. Tyto předem definované širokospektré fágové koktejly byly vyvinuty, vyrobeny a testovány v rámci stávajících farmakoekonomických modelů, které byly navrženy pro “statická” léčiva, jako jsou antibiotika. Skutečně širokospektré fágové koktejly účinné proti většině grampozitivních a/nebo gramnegativních bakterií, které se běžně vyskytují u infekčních onemocnění, však musely obsahovat velké množství fágů a ukázalo se, že jejich vývoj je velmi obtížný. Bylo možné vyvinout koktejly s užším spektrem fágů, účinné proti jednomu nebo několika málo bakteriálním druhům, které by se používaly v určitých indikacích, přičemž by bylo nutné předem znát infikující bakteriální druhy. U některých bakteriálních druhů, jako je Staphylococcus aureus, byly izolovány a charakterizovány fágy vykazující mimořádně široký hostitelský rozsah (Vandersteegen et al., 2011). V randomizované kontrolované studii PhagoBurn byl úspěch při dosažení trvalého snížení zátěže Pseudomonas aeruginosa v popáleninových ranách spojen s počáteční citlivostí na koktejl fágů (Jault et al., 2019). Ukázalo se však, že u jedné třetiny zařazených pacientů se nacházely již existující kmeny P. aeruginosa rezistentní vůči fágovému koktejlu, který se skládal z nejméně 12 lytických fágů P. aeruginosa. Fágové koktejly, které byly původně navrženy jako účinné, bylo navíc nutné pravidelně aktualizovat (např. doplňovat o nové fágy) v reakci na vznik rezistence vůči fágům nebo zapojení nově cirkulujících klinicky relevantních kmenů. V neposlední řadě nebylo známo, zda konfrontace bakterií s vysokými koncentracemi fixních fágových koktejlů nezpůsobí vznik, šíření a přetrvávání bakteriální fágové rezistence v nemocnicích a v životním prostředí, podobně jako tomu bylo při masivním používání antibiotik.
V koncepcích personalizované fágové terapie byl jeden nebo více fágů vybrán z fágové banky nebo z prostředí a případně upraven (in vitro selekce fágových mutantů vykazujících zvýšenou infekčnost) tak, aby účinněji infikoval bakterie izolované z místa infekce pacienta (Friman et al., 2016). Některá centra fágové terapie zřídila a udržovala velké terapeutické fágové banky, které byly pravidelně doplňovány novými fágy, čímž se rozšiřoval a přizpůsoboval hostitelský rozsah banky neustále se měnícím bakteriálním populacím. Personalizované přístupy fágové terapie byly potenciálně udržitelnější, protože cílem je pouze infikující bakterie, což vede k menšímu selekčnímu tlaku na rezistenci bakterií vůči fágům. Byly však také propracovanější a logisticky složitější než univerzální přístupy, kdy se bakteriální kmeny a odpovídající fágy posílaly po celém světě (obrázek 1). Koncepty precizní medicíny navíc obecně nebyly slučitelné s většinou cest vývoje a licencování léčivých přípravků (léků ve Spojených státech), které vyžadovaly několik let a miliony eur (dolarů), a to pro každý fág v bance (Verbeken et al., 2012).
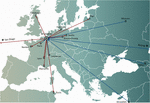
Obrázek 1: Koncepty precizní medicíny byly v zásadě neslučitelné s většinou cest vývoje a licencování léčivých přípravků (léků ve Spojených státech), které vyžadovaly několik let a miliony eur (dolarů), a to pro každý fág v bance (Verbeken et al., 2012). Mezinárodní přenosy fágů z (červené šipky) a do (modré šipky) Vojenské nemocnice královny Astrid (QAMH) v Bruselu s ohledem na klinické aplikace v období 2015-2020. Na národní úrovni byly fágy odeslány z QAMH do pěti univerzitních nemocnic (není zobrazeno). Kromě toho výběr odpovídajících fágů často zahrnoval přenos bakteriálních izolátů pacientů a pět mezinárodních pacientů (dva z Francie, dva z Nizozemska a jeden z Tuniska) bylo převezeno do Bruselu za účelem fágové terapie.
Vstup do syntetické biologie
S nástupem třetího tisíciletí byly stále více rozvíjeny přístupy syntetické biologie s cílem snížit specifičnost fágů a vznik rezistence bakterií vůči fágům (např, strukturně řízený design) (Pires et al., 2016; Dunne et al., 2019). Byly například vypracovány platformy na bázi kvasinek pro přepínání proteinů ocasních vláken fágů s cílem vytvořit hybridní fágy s předvídatelnějším a rozšířeným hostitelským rozsahem (Ando et al., 2015; Yosef et al., 2017) a strategie genetického inženýrství (např, CRISPR-Cas editační nástroje) byly vyvinuty k řešení dalších aspektů, jako jsou negativní interakce mezi pacientem a fágem (např. antifágová imunitní odpověď) (Brown et al., 2017), potenciální vznik a šíření mechanismů rezistence bakteriálních fágů a uvolňování škodlivého bakteriálního obsahu, jako jsou endotoxiny (Hwang et al., 2018). Syntetické fágové genomy bylo třeba restartovat, aby vzniklo fágové potomstvo (Barbu et al., 2016; Pires et al., 2016), a to prostřednictvím transformace L-forem Escherichia coli nebo Listeria monocytogenes (Kilcher et al., 2018) nebo pomocí bezbuněčných transkripčně-translačních systémů (TXTL) (Rustad et al., 2018). Západní regulační rámce postupně začaly vycházet vstříc precizním a personalizovaným přístupům fágové terapie využívajícím přirozeně se vyskytující fágy (Pirnay et al., 2018), konstruované fágy (Dedrick et al., 2019) a syntetické fágy.
Vývoj zařízení pro ad hoc a on-site produkci terapeutických fágů, jako je Phage-BEAM, neprobíhal hladce, připomněl Iverian. Na začátku bylo nutné provést in silico párování a návrh fágů na bázi umělé inteligence. Pro hledání vazeb mezi bakteriálními genomy a genomy infikujících fágů bylo zvoleno hluboké učení (Deep learning, Martorell-Marugán et al., 2019), podmnožina strojového učení, protože bylo snazší škálovat ho na větší počet vzorků. Metody hlubokého učení například nevyžadovaly tzv. extrakci rysů, která by vyžadovala anotaci genů/proteinů na úrovni fágových a bakteriálních genomů a omezovala by předpovědi na určité známé vztahy mezi bakteriálními a fágovými rysy, jako je například vazba struktur ocasních vláken fága na specifické receptory bakteriální buněčné stěny. Jako nevýhodu je třeba uvést, že by musel být napájen nepřetržitým přísunem obrovského množství dat, propojujících genomy lytických fágů s genomy hostitelských bakterií, a právě v tom ho tlačila bota. Sekvenování celých genomů pomalu pronikalo do praxe klinické mikrobiologie (American Academy of Microbiology, 2016), ale výzkumné ústavy a farmaceutické společnosti nebyly ochotny předávat svá data do jednotné centralizované databáze a nenašli se investoři, kteří by byli ochotni a schopni získat dostupná data a/nebo produkovat dostatečné množství nových dat. Druhou překážkou, kterou bylo třeba překonat, byla nedostupnost rychlé, spolehlivé a cenově dostupné syntézy velkých molekul DNA. Původní techniky syntézy DNA byly založeny na organické chemii a produkovaly relativně malé molekuly DNA. Syntéza genomů fágů de novo vyžadovala sestavení několika fragmentů genomu (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) v kvasince Saccharomyces cerevisiae, použití umělých chromozomů kvasinek (Ando et al., 2015) nebo chemické sestavení (Gibson et al., 2009). Syntézu fágového genomu usnadnil vývoj nové techniky syntézy DNA založené na enzymech syntetizujících DNA, které se nacházejí v buňkách imunitního systému (Palluk et al., 2018). Nakonec bylo třeba překonat některé překážky, aby bylo možné vyvinout generické systémy pro bezbuněčnou produkci fágů schopné produkovat fágy ve vysokých titrech a vykazující stejnou úroveň bakteriální infekčnosti jako jejich přirozené analogy.
Přelom
Hlavním problémem bylo, že se ukázalo jako velmi obtížné shromáždit obrovské množství propojených sekvencí fágů a bakteriálních genomů, které jsou nezbytné pro algoritmy hlubokého učení umělé inteligence, aby mohly předpovídat a/nebo navrhovat sekvence fágů s terapeuticky přijatelnou úrovní přesnosti. Iverian připomněl, že skutečný průlom nastal, když nezisková organizace “Phage XChange” spustila stejnojmennou globální platformu pro správu fágů s cílem vytvořit efektivní, standardizovaný, udržitelný a etický dodavatelský řetězec fágů (obr. 2). Phage XChange se skládala především z modulu umělé inteligence a distribuované účetní knihy (DL) (Thiebes et al., 2020). Modul AI platformy analyzoval propojené fágové a bakteriální genomy s cílem předvídat a navrhovat účinné fágy pro klienty. Předpovídal také, kterým bakteriálním patogenům je třeba věnovat nejnaléhavější pozornost, a to na základě internetu věcí (IoT) a velkých dat a informací poskytovaných mezinárodními organizacemi veřejného zdraví, jako je Světová zdravotnická organizace (WHO) a národní centra pro kontrolu nemocí. Tato data nasměrovala systém k izolaci a charakterizaci nejnaléhavějších fágů.
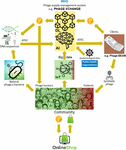
Obrázek 2. Vize, jak by mohl být organizován dodavatelský řetězec fágů v roce 2035. AI, umělá inteligence; ATGC, sekvence DNA; BEAM, bedside energized anti-microbial; DL, distribuovaná účetní kniha; IoT, internet věcí; P, PhageCoin; WHO, Světová zdravotnická organizace.
Modul DL platformy zajišťoval dostatečný, kvalitní a evidovaný vstup propojených sekvencí fágových/bakteriálních genomů do modulu AI a ditto dodávky fágových sekvencí klientům v souladu s ustanoveními Nagojského protokolu (Expert round table on acceptance and re-implementation of bacteriophage therapy et al., 2018). DL neměnně zaznamenával všechny zúčastněné strany (např. dodavatele dat, sekvenační služby a klienty), podrobnosti o transakcích a smlouvách. Zaznamenával také přesnou kvalitu, specifikace a hmotnost dodaného materiálu. Algoritmus určoval neredundanci a odhadoval váhu (např. virulenci a hostitelský rozsah fágů) a žádanost dodaného materiálu. Nejžádanější byly samozřejmě fágy zaměřené na nově se objevující bakteriální patogeny. Většina patentových otázek byla vyloučena. DL fungoval jako platební kniha, aby bylo zajištěno, že všechny strany dostanou zaplaceno včas a spravedlivě. Dodavatelům byla přidělena řada PhageCoinů (kryptoměna platformy) v závislosti na kvalitě, váze a žádanosti dodaného materiálu. Klienti extrahující výsledky predikce (sekvence fágů) prostřednictvím DL zaplatili částku PhageCoins, úměrnou odhadované hodnotě fágů. Tyto PhageCoiny byly použity k udržování DL, k zajištění dostatečného a nepřetržitého přísunu materiálu a k rozšíření údajů o virulenci fágů a rozsahu hostitelů (přiřazování fágů k bakteriím). Další finanční injekce a pobídka k dodávání materiálu se našla u výrobců a dodavatelů všech druhů zboží. Za okamžitě získané PhageCoiny mohli dodavatelé fágů nakupovat online nejrůznější produkty za silně snížené ceny, od laboratorního a školního vybavení až po sportovní potřeby. Toto zboží bylo poskytováno prostřednictvím firemního sponzoringu. Několik zavedených společností sponzorovalo PhageXchange výměnou za daňové úlevy, publicitu a image společensky odpovědné značky. Váha dodávaného materiálu, a tedy i jeho hodnota, byla zpočátku podhodnocena, ale v pravidelných intervalech byla přehodnocována (iterace) a dodavatelům bylo v odůvodněných případech přidělováno více PhageCoinů. Přestože byla platforma užitečná již od svého zavedení, skutečně úspěšnou se stala až ve chvíli, kdy byla pod ochranou WHO, analogicky k celosvětovému systému sledovatelnosti, transparentnosti, vigilance a dohledu nad léčivými přípravky humánního původu (Warwick et al., 2013). Formální dohoda mezi Phage XChange a WHO zvýšila mezinárodní důvěru v dlouhodobou udržitelnost platformy a ochranu před neetickým komerčním využitím. Hledání účinných terapeutických fágů se brzy stalo komunitním úsilím zaměřeným na řešení krize antibiotické rezistence, kdy nezávislí “lovci fágů”, školy, skautské skupiny, vesnice na březích Amazonky atd. izolovali a předkládali fágy platformě Phage XChange výměnou za PhageCoins. Na okraj toho různé společnosti a instituce vyvinuly periferní zařízení a služby, jako jsou soupravy pro izolaci fágů a platformy pro sekvenování a syntézu fágů (např. zařízení Phage-BEAM). V předstihu před těmito zařízeními se nabízela zprostředkovatelská řešení, kdy se samotné fágy získávaly prostřednictvím DL.
Epilog
Tento pohled na budoucnost fágové terapie poskytuje optimistické zakončení krize antibiotické rezistence. Výroba syntetických fágů ad hoc a na místě, spojená s globálním, komunitním systémem správy fágů, se ukázala být vítanou a cenově dostupnou (pro systémy sociálního zabezpečení) dodatečnou zbraní v boji proti bakteriálním infekcím odolným vůči antibiotikům. Nebyla to však zázračná kulka; jednalo se o synergický doplněk k zavedeným antimikrobiálním látkám. Okamžitá a bezbuněčná výroba syntetických fágů, ať už navržených nebo ne, měla oproti klasicky vyráběným (v bakteriálních hostitelích) přírodním fágům značné výhody:
(i) Nebylo třeba udržovat fyzické banky terapeutických fágů a rozesílat bakteriální izoláty pacienta a odpovídající terapeutické fágy po celém světě.
(ii) Syntetické fágy proti bakteriím způsobujícím eminentní hrozby pro veřejné zdraví, jako byla například epidemie E. coli O104:H4 v Německu v roce 2011 (Merabishvili et al., 2012), nebo bakterie (podezřelé z) použití pro bioterorismus (Joñczyk-Matysiak et al., 2014) by mohly být včas vyrobeny na místě.
(iii) Fágy proti bakteriím způsobujícím potenciálně smrtelná onemocnění, pro které nebyly k dispozici žádné neletální produkční hostitelské kmeny a jejichž množení dříve vyžadovalo opatření biologické ochrany na úrovni 3 (bsl-3), by mohly být syntetizovány v podmínkách bsl-1.
(iv) Pokud nebylo možné izolovat fágy z míst odběru vzorků, například proto, že bakteriální hostitelské kmeny použité při izolačních technikách nebyly citlivé na požadované fágy, byly použity (předpokládané) genomové sekvence fágů, získané z metagenomických dat (Reyes et al., 2010; Amgarten et al., 2018), mohly být použity k výrobě syntetických fágů.
(v) Přípravky syntetických fágů neobsahovaly žádné (nebo menší množství) molekul, které by mohly mít negativní dopad na pacienty (např. endotoxiny).
(vi) Zařízení byla uzpůsobena k výrobě syntetických fágů během delších vesmírných cest a kolonizace vesmíru (Taylor a Sommer, 2005).
Málo pravděpodobné je, že se tyto předpovědi naplní. Je pravděpodobně příliš krátkozraké se domnívat, že jádrem řešení současné celosvětové krize antibiotické rezistence by mohlo být komunitní úsilí podporované organizacemi veřejného zdraví a řízené globální, udržitelnou a etickou platformou. Některé části navrhovaného systému, jako například bezbuněčná výroba syntetických fágů pomocí zařízení u lůžka pacienta, mají rozumnou šanci na realizaci, zatímco jiné prvky, jako například sponzoring ze strany podniků, zůstanou pravděpodobně omezeny na oblast science fiction. Možná si řeknete, že jsem snílek, tak mě klidně v roce 2035 probuďte a konfrontujte mě s realitou!”
Příspěvky autorů
J-PP vymyslel vizi a vypracoval rukopis.
Financování
Náklady na publikaci hradila “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Střet zájmů
Autor prohlašuje, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Zpracovávající redaktor deklaroval minulé spoluautorství s autorem.
Poděkování
Osobní vize nebo sen, rozvinutý v tomto rukopise, vznikl jako výsledek interakcí s mnoha kolegy výzkumníky za posledních 15 let. Není možné je všechny vyjmenovat, ale nebylo by spravedlivé připsat si všechny zásluhy sám. Proto jsem se rozhodl některé z nich zde uvést (v abecedním pořadí), s rizikem – nebo lépe řečeno s jistotou – že na některé důležité ovlivňovatele zapomenu: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken a Kilian Vogele.
Americká akademie mikrobiologie (2016). Aplikace klinického mikrobiálního sekvenování nové generace: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P., da Silva, A. M., and Setubal, J. C. (2018). MARVEL, nástroj pro predikci bakteriofágních sekvencí v metagenomových koších. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., and Loessner, M. J. (2018). Cross-genus rebooting of custom-made, synthetic bacteriophage genomes in L-form bacteria. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., and Lu, T. K. (2018). Aplikace založené na fázích v syntetické biologii. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., and Delbrück, M. (1943). Mutace bakterií od citlivosti k virům k odolnosti vůči virům. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine,” in Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019.ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Výběr a charakterizace kandidátního terapeutického bakteriofága, který lyzuje kmen Escherichia coli O104:H4 z epidemie v Německu v roce 2011. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Klinické aspekty fágové terapie. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). Syntéza DNA de novo pomocí konjugátů polymerázy a nukleotidu. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu, T. K. (2016). Geneticky modifikované fágy: přehled pokroku za poslední desetiletí. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). The phage therapy paradigm: prêt-à-porter or sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). Magistraliter fág. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Viry ve fekální mikrobiotě jednovaječných dvojčat a jejich matek. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Bezbuněčná syntéza TXTL infekčního bakteriofága T4 v jediné reakci ve zkumavce. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Vývoj a použití personalizovaných terapeutických koktejlů na bázi bakteriofágů k léčbě pacienta s diseminovanou rezistentní infekcí Acinetobacter baumannii. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr (2001). Bakteriofágová terapie. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Viry: odemykání největší biodiverzity na Zemi. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., and Sommer, A. P. (2005). Na cestě k racionální léčbě bakteriálních infekcí během prodloužených vesmírných cest. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., and Sunyaev, A. (2020). Technologie distribuované účetní knihy v genomice: výzva pro Evropu. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Stará dogmata, nové triky – fágová terapie 21. století. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Mikrobiologické a molekulární hodnocení bakteriofága ISP pro kontrolu Staphylococcus aureus. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J. P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimalizace evropského regulačního rámce pro udržitelnou bakteriofágovou terapii v humánní medicíně. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., and Wang, H. (2013). Globálně konzistentní kódovací systémy pro léčivé přípravky humánního původu. Bull. World Health Organ. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., and Qimron, U. (2017). Rozšíření hostitelského rozsahu bakteriofágových částic pro transdukci DNA. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar
.