Forord
Denne artikel indeholder en personlig vision af, hvad der skal til, for at faget terapi endelig kan slå igennem som et almindeligt antibakterielt værktøj. Den er påvirket af historiske og nylige fiaskoer og usikkerheder på fagetoterapiområdet og sigter mod at finde løsninger baseret på fremtidige og nye teknologier, som formodes at modellere morgendagens videnskab og samfund.
Fagterapi
Bakteriofager (fager) er bakteriers vira. Siden tidernes morgen har de kontrolleret væksten og spredningen af deres bakterielle værter. Bakterievirusser er de mest allestedsnærværende livsvæsener i vores biosfære. Det anslås, at der er 10 millioner gange flere vira i havene, end der er stjerner i universet, og hvis alle fager på Jorden blev stablet oven på hinanden, ville dette tårn strække sig længere end de nærmeste 60 galakser (Suttle, 2013). De kan let findes overalt, hvor bakterier trives: i kloakker, floder eller i patienters urin og afføring. Fager af humane bakteriepatogener består oftest af et icosaedrisk hoved, en kugle med 20 flade flader lavet af proteiner og indeholdende et nukleinsyregenom, hvortil der er knyttet en proteinhale. Når en strengt lytisk fage klæber med sine halefibre og pigge til overfladen af sin målbakterie, trækker den sprøjselignende halekappe sig sammen, og halekernen drives gennem den bakterielle cellevæg, hvorved fagenes genom injiceres ind i bakteriecellens periplasma. Bakteriens DNA- og proteinsyntesemaskineri bliver straks kapret til at bygge kopier af fagen. Nogle fager skærer det bakterielle DNA i stykker. Efter en latent periode på minutter til timer sprænger de nyligt dannede fager ud af deres bakterielle værter, som dræbes i processen. Fagenes afkom, som kan være flere hundrede pr. bakterie, går derefter ud for at finde nye værtsbakterier, som de kan inficere. Som sådan kan fager betragtes som selvreplikerende antimikrobielle stoffer. Det er vigtigt, at fager har udviklet sig til kun at inficere visse målbakterier og er uskadelige for pattedyrsceller.
De første beviser på virallignende agenser med antibakteriel aktivitet blev rapporteret af den engelske bakteriolog Frederick Twort og af den fransk-canadiske mikrobiolog Felix d’Hérelle i henholdsvis 1915 og 1917 (Sulakvelidze et al., 2001). I 1919 udnyttede d’Hérelle for første gang fagenes terapeutiske potentiale, da han brugte dem til at helbrede en dreng, der led af dysenteri, i Paris. Phageterapi blev straks anerkendt som en terapeutisk metode til behandling af bakterieinfektioner, og flere virksomheder, f.eks. L’Oréal i Europa og Eli Lilly Company i USA, begyndte at markedsføre præparater til phageterapi (Sulakvelidze et al., 2001). I 1923 grundlagde den georgiske mikrobiolog Giorgi Eliava Eliava Institute i Tbilisi i Georgien, som var dedikeret til forskning i fagetterapi. Det var starten på en omfattende forskning og udvikling af fagterapi i det tidligere Sovjetunionen. De tidlige anvendelser af fagterapi var dog ofte upålidelige, og der var også forskning i antibiotika i gang. Den vellykkede anvendelse af penicillin under Anden Verdenskrig og den efterfølgende verdensomspændende markedsføring heraf fik vestlige forskere til at miste interessen for fageterapi. Sovjetiske forskere fortsatte derimod med at udvikle fagetterapi og med at offentliggøre deres resultater, men på grund af jerntæppet blev deres viden og erfaringer ikke spredt over hele verden (Sulakvelidze et al., 2001). Ved begyndelsen af det tredje årtusinde vakte den stigende sundhedsbyrde som følge af infektioner med antibiotikaresistente bakterier (Cassini et al., 2019) fornyet interesse på verdensplan for fagterapi som et levedygtigt supplerende værktøj til den kliniske behandling af bakterieinfektioner (Thiel, 2004). Over hele verden er der ved at blive oprettet phageterapicentre, der følger i fodsporene på Eliava-instituttet og phageterapienheden på Hirszfeld-instituttet i Wrocław, Polen (Miêdzybrodzki et al, 2012).
Året 2035
Fast forward til den fremtidige Jord i 2035, en dyster verden præget af menneskelig overbefolkning, store forstyrrelser i økosystemerne, global opvarmning og fremmedhad.
Mens han ligger i blød i sit bad, mærker Dr. John Iverian, en pensioneret mikrobiolog, pludselig et ekstremt smertefuldt stik i nakken, efterfulgt af en lyd som en propel fra et lille fly. Han undersøgte omgivelserne, og i øjenkrogen så han et mærkeligt stort insekt med lange uhyggelige ben og antenner sidde på væggen ved siden af hans designerbadekar. Osuri, hjemmestyringssystemet i Iverians loft i centrum af Antwerpen, identificerede insektet som det brunmarmorede stankelben Halyomorpha halys, som havde spredt sig over hele verden. Osuri’s rapport, der blev projiceret på en af badeværelsets videoskærme, nævnte, at folk, der blev bidt, i første omgang oplevede et lille rødt sår i bidområdet på deres hud. Når de ikke blev behandlet, svulmede bidsåret op og producerede væske. Træt og sløret, nonchalant trådte Iverian ud af sit bad og gik i seng. Han havde besluttet ikke at udføre den udførlige sårbehandlingsprocedure, som Osuri kraftigt havde anbefalet ham. Tidligt næste morgen var biddet imidlertid blevet til et nekrotisk sår, der viste tydelige tegn på infektion.
Angeligt aktiverede Iverian sin Phage-BEAM-enhed. BEAM stod for “Bedside Energized Anti-Microbial”. Apparatet havde størrelse og form som en skotøjsæske, men med et mere elegant og poleret udseende. Apparatets navn og dets producent var designet med farverige bogstaver på siden af den sømløse hvide emaljerede kasse. Iverian tog en vatpind ud af den sterile emballage og førte den forsigtigt hen over hele sårområdet, idet han sikrede sig, at sårekssudatet grundigt fugtede vatspidsen på vatpinden. Da vatpinden nærmede sig æskens område med “indsæt prøve”, åbnede en lille dør sig som ved et trylleslag og frigjorde et 10 tommer højt hologram af en laboratorietekniker ved navn Marcia. Hun viste Iverian, hvor han skulle lægge prøven. Marcia blev udviklet til at guide kunderne gennem testproceduren. “For at opnå de bedste resultater skal du indsætte en ny fage-bio-inkpatron, dr. Iverian”, sagde Marcia. Ligesom det var tilfældet med gårsdagens 2D-printere, var prisen på bio-blækpatronerne næsten lige så høj som prisen på selve Phage-BEAM-apparatet. Ifølge “Business Insider” var phage-bio-blæk den næstdyreste væske på jorden efter Chanel No. 8. Heldigvis havde Iverian som en af opfinderne opnået retten til altid at have den nyeste version af dette apparat til sin rådighed, herunder en løbende forsyning af reagenser, gratis.
Iverian vidste udmærket, hvordan apparatet fungerede, så han havde ikke brug for Marcias hjælp. Først blev der ekstraheret DNA fra spidsen af vatpinden, og metagenomet – alt det genetiske materiale, der var til stede i prøven, herunder de inficerende bakterier – blev bestemt. Dernæst blev disse genetiske data sendt til en sikret “Phage XChange”-server, hvor en kompleks AI-drevet algoritme forudsagde genomsekvensen af den fage, som med størst sandsynlighed ville lyze de inficerende bakterier, der var identificeret i metagenomet, og som skulle fremkalde den svageste immunreaktion hos patienten. Faggenomdataene blev sendt til Phage-BEAM-enheden, som først syntetiserede fagenes genom og derefter fagen ved hjælp af et proprietært bakteriefrit fageproduktionssystem.
I løbet af 1 time efter prøvetagning ville enheden producere et færdigt terapeutisk fageprodukt, der var klar til brug. Resultaterne af den trinvise procedure ville blive transmitteret til den enorme hjemmebilledskærm i Iverian’s stue. Iverian sad i sin LC2-lænestol og lyttede til Mozarts store messe i c-mol og ventede spændt på, at resultaterne skulle komme ind. Han havde en dårlig fornemmelse af det her. Resultatet sendte kuldegysninger ned ad Iverians rygsøjle. Bakterielt patogen identificeret: Streptococcus pyogenes stamme FE-2033! Osuri aktiverede straks infektionsalarmprotokollen og sendte en besked til World Center for Disease Control og fremlagde foruroligende baggrundsoplysninger om den dødelige kødædende bakteriestamme, som blev betragtet som en overhængende trussel mod folkesundheden siden 2033. Iverian overvejede et øjeblik at skære det inficerede sår og noget omkringliggende sundt væv ud med en køkkenkniv, men han faldt til ro og besluttede sig for at vente og anvende det forestående Phage-BEAM-produkt. En time senere havde Phage-BEAM-apparatet produceret syntetiske fager. Disse fager blev derefter blandet med de isolerede bakterier i et valideringsmodul for at teste deres in vitro-effektivitet. Et kvarter senere blev der givet grønt lys til, at Iverian kunne påbegynde behandlingen. Iverian anvendte fagerne i en hydrogelbaseret sårforbinding med langsom frigivelse, som først var blevet blandet med den koncentrerede fagesuspension, der var produceret af Phage-BEAM-enheden, og som også indeholdt synergistiske antibiotika. Hydrogelen lindrede midlertidigt smerten, hvilket beroligede ham yderligere. Iverian gentog påføringen af den fage- og antibiotikaladede hydrogel en gang om dagen. Sårinfektionen blev forbedret inden for 24 timer, og efter 7 dage var såret næsten helt helet. Iverians potentielt livstruende infektion blev behandlet med succes, rettidigt og uden at han skulle forlade sit hjem. Men i mange tidligere årtier havde det ikke været sikkert, at fagterapi ville slå igennem og blive et bredt anvendt og klinisk anvendeligt antibakterielt værktøj. Den medicinske verden havde været længe om at indse, at fagterapi ikke behøvede at være identisk med antibiotikabehandling, og dette primært på grund af de aktive stoffers, fagenes, særlige karakteristika.
Nogle relevante særtræk ved fager
Fagter udviser en række egenskaber, der adskiller sig fra antibiotika, og som har hindret deres udvikling som farmaceutiske produkter og anvendelse i terapi. For det første har de en tendens til at være specifikke med hensyn til, hvilke bakterier de inficerer. De vil i bedste fald være rettet mod en betydelig del af en enkelt bakterieart, men i værste fald vil de kun inficere et lille antal stammer inden for en art. Terapeutiske fager kan således udvælges til hovedsageligt at dræbe én bakterieart eller en klinisk relevant undergruppe heraf og skåne patientens gavnlige bakterier (f.eks. tarm-, hud- eller mundfloraen). De fleste rutinemæssigt anvendte antibiotika har derimod et bredt aktivitetsspektrum, hvilket kan forårsage “kollaterale skader” på patientens kommensale mikrobiomer, hvilket igen kan resultere i negative virkninger såsom udvælgelse af antibiotikaresistente bakteriearter (f.eks. Clostridium difficile) eller antibiotikaassocieret diarré (Jernberg et al., 2010). Ulempen ved fagespecificitet er, at de inficerende bakterier skal identificeres, før man påbegynder fagebehandling. Ved empirisk antibiotikabehandling anvendes derimod typisk bredspektret antibiotikacocktails, der påvirker et væld af Gram-positive og Gram-negative bakterier og forskellige svampe. Når der foreligger flere oplysninger (f.eks. fra bakteriekultur), kan behandlingen bestå af smalspektret antibiotika, som er mere specifikt rettet mod de bakterier eller svampe, der er identificeret som sygdomsfremkaldende.
For det andet er bakterier og fager involveret i et vært-parasit-forhold. Strengt lytiske fager er allestedsnærværende i miljøet og kræver, at deres bakterielle vært dør for at fuldføre deres livscyklus. Uden værter kan fager ikke eksistere. Fagene selekterer for resistente værter, som igen selekterer for effektive fager. Dette resulterer i det, der kaldes “antagonistisk koevolution”, et våbenkapløb mellem bakterier og fager, der er karakteriseret ved gensidig udvikling af bakteriel resistens og fageinfektivitet (Buckling og Rainey, 2002). Ligesom med de fleste antimikrobielle stoffer vil bakterier således også blive resistente over for fager (Luria og Delbrück, 1943; Schooley et al., 2017), men i modsætning til statiske antibiotika har fager evnen til at overvinde bakteriel resistens (Buckling og Rainey, 2002). Der er ikke desto mindre tegn på, at bakterier og fager ikke vil øge deres respektive resistens og infektivitet i det uendelige (Fortuna et al., 2019).
Fagterapi-tilgange
På tidspunktet for fagetoterapiens genoplivning i begyndelsen af 2000’erne var der udviklet to forskellige fagetoterapitilgange (Pirnay et al., 2011). I det, der kunne kaldes one-size-fits-all-tilgangen, blev der anvendt definerede fagecocktails med bredt spektrum, som skulle være målrettet mod størstedelen af de bakterier, der mistænkes for at forårsage visse infektionssygdomme. Disse foruddefinerede bredspektrede fagecocktails blev udviklet, produceret og testet inden for rammerne af de nuværende farmakoøkonomiske modeller, som var blevet udviklet til at tage højde for “statiske” lægemidler som f.eks. antibiotika. Virkelige bredspektrede fagecocktails, der er aktive mod de fleste Gram-positive og/eller Gram-negative bakterier, der almindeligvis forekommer i forbindelse med infektionssygdomme, skulle imidlertid indeholde store mængder fager og viste sig at være meget vanskelige at udvikle. Det var muligt at udvikle fagecocktails med et smallere spektrum, der er aktive mod en eller få bakteriearter, og som kan anvendes på bestemte indikationer, idet man dog skal være opmærksom på, at de inficerende bakteriearter er kendt i forvejen. For nogle bakteriearter, f.eks. Staphylococcus aureus, var der blevet isoleret og karakteriseret fager med et usædvanligt bredt værtsområde (Vandersteegen et al., 2011). I PhagoBurn, et randomiseret kontrolleret forsøg, var succesen med at opnå en vedvarende reduktion af Pseudomonas aeruginosa-burden i brandsår forbundet med den oprindelige modtagelighed for fagecocktailen (Jault et al., 2019). Det blev imidlertid vist, at en tredjedel af de inkluderede patienter havde allerede eksisterende P. aeruginosa-stammer, der var resistente over for fagecocktailen, som bestod af ikke mindre end 12 lytiske P. aeruginosa-fager. Desuden skulle fagecocktails, der oprindeligt var designet til at være effektive, regelmæssigt opdateres (f.eks. suppleres med nye fager) som reaktion på fremkomsten af fagerresistens eller inddragelse af nye cirkulerende klinisk relevante stammer. Endelig vidste man ikke, om det at konfrontere bakterier med høje koncentrationer af faste fagecocktails ville medføre fremkomst, spredning og persistens af bakteriel fageresistens på hospitaler og i miljøet i lighed med det, der var sket efter den massive anvendelse af antibiotika.
I koncepter for personlig fageterapi blev en eller flere fager udvalgt fra en fagebank eller fra miljøet og eventuelt tilpasset (in vitro udvælgelse af fagemutanter, der udviser øget infektivitet) til mere effektivt at inficere de bakterier, der er isoleret fra patientens infektionssted (Friman et al, 2016). Nogle fageterapicentre oprettede og vedligeholdt store terapeutiske fagebanker, som regelmæssigt blev opdateret med nye fager, hvilket udvidede og tilpassede bankens værtsområde til de stadigt skiftende bakteriepopulationer. Personaliserede metoder til fageterapi var potentielt mere bæredygtige, da kun den inficerende bakterie er målrettet, hvilket resulterer i et mindre selektionspres i retning af bakteriel fageresistens. De var imidlertid også mere udførlige og logistisk komplekse end de metoder, der er baseret på en standardløsning, idet bakteriestammer og matchende fager skal sendes over hele verden (figur 1). Desuden var koncepter for præcisionsmedicin generelt ikke kompatible med de fleste udviklings- og licensveje for lægemidler (lægemidler i USA), som krævede flere år og millioner af euro (dollars) at gennemføre, og dette for hver eneste fage i banken (Verbeken et al., 2012).
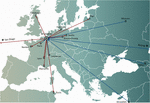
Figur 1. Internationale overførsler af fager fra (røde pile) og til (blå pile) Dronning Astrid Militærhospitalet (QAMH) i Bruxelles med henblik på kliniske anvendelser i perioden 2015-2020. På nationalt plan blev fager afsendt fra QAMH til fem universitetshospitaler (ikke vist). Desuden omfattede udvælgelsen af matchende fager ofte overførsel af patienternes bakterieisolater, og fem internationale patienter (to fra Frankrig, to fra Nederlandene og en fra Tunesien) blev overført til Bruxelles med henblik på fageterapi.
Enter Syntetisk biologi
Med indgangen til det tredje årtusinde var der i stigende grad blevet udviklet syntetisk biologiske tilgange for at reducere fagenes specificitet og fremkomsten af bakteriel fageresistens (f.eks, strukturstyret design) (Pires et al., 2016; Dunne et al., 2019) (Pires et al., 2016; Dunne et al., 2019). For eksempel blev gærbaserede platforme til phage tail fiberproteinskifte udarbejdet for at konstruere hybridfager med mere forudsigelig og udvidet værtsområde (Ando et al., 2015; Yosef et al., 2017) og genteknologiske strategier (f.eks, CRISPR-Cas-redigeringsværktøjer) blev udviklet for at løse andre aspekter såsom negative patient-fage-interaktioner (f.eks. anti-fage-immunrespons) (Brown et al., 2017), den potentielle fremkomst og spredning af bakterielle fage-resistensmekanismer og frigivelse af skadeligt bakterielt indhold såsom endotoxiner (Hwang et al., 2018). Syntetiske fage-genomer skulle genstartes for at producere fageafkom (Barbu et al., 2016; Pires et al., 2016), gennem transformation af Escherichia coli eller Listeria monocytogenes L-former (Kilcher et al., 2018) eller ved hjælp af cellefri transkription-translation (TXTL)-systemer (Rustad et al., 2018). Vestlige reguleringsrammer var gradvist begyndt at tage højde for præcisions- og personaliserede fagterapitiltag ved hjælp af naturligt forekommende fager (Pirnay et al., 2018), manipulerede fager (Dedrick et al., 2019) og syntetiske fager.
Udviklingen af ad hoc- og on-site terapeutiske fageproduktionsanordninger, såsom Phage-BEAM, forløb ikke glat, mindede Iverian om. Til at begynde med krævede det kunstig intelligens (AI)-baseret in silico phage matching og design. Deep learning (Martorell-Marugán et al., 2019), en delmængde af Machine Learning, blev valgt til at søge efter forbindelser mellem bakterielle genomer og inficerende fage-genomer, fordi det var lettere at skalere til et større antal prøver. For eksempel krævede deep learning-metoderne ikke såkaldt feature ekstraktion, hvilket ville kræve annotation på gen-/proteinniveau af fage- og bakteriegenomer og ville begrænse forudsigelser til visse kendte relationer mellem bakterie- og fagefunktioner, såsom fagehalefiberstrukturer, der binder sig til specifikke bakterielle cellevægsreceptorer. Som en ulempe skulle den drives af en kontinuerlig forsyning af massive mængder data, der knyttede lytiske fage-genomer til værtsbakteriegenomer, og det var der, skoen trykkede. Helgenomsekventering var langsomt trængt ind i praksis inden for klinisk mikrobiologi (American Academy of Microbiology, 2016), men forskningsinstitutter og medicinalvirksomheder var ikke ivrige efter at indsende deres data til en enkelt centraliseret database, og der blev ikke fundet nogen investorer, der var villige og i stand til at erhverve de tilgængelige data og/eller producere tilstrækkelige mængder af nye data. En anden hindring, der skulle overvindes, var den manglende adgang til hurtig, pålidelig og økonomisk overkommelig syntese af store DNA-molekyler. De første DNA-syntese-teknikker var baseret på organisk kemi og producerede relativt små DNA-molekyler. De novo-syntese af fage-genomer krævede samling af flere genomfragmenter (Barbu et al., 2016; Pires et al., 2016; Lemire et al., 2018) i gæren Saccharomyces cerevisiae, ved hjælp af kunstige kromosomer fra gær (Ando et al., 2015) eller kemisk samling (Gibson et al., 2009). Udviklingen af en ny teknik til at syntetisere DNA, baseret på DNA-syntetiserende enzymer, der findes i celler i immunsystemet (Palluk et al., 2018), har lettet fage-genomsyntesen. Endelig skulle nogle forhindringer overvindes for at udvikle generiske cellefrie fageproduktionssystemer, der kunne producere fager i høje titre og udvise samme niveauer af bakterieinfektivitet som deres naturlige analoger.
Gennembruddet
Det største problem var, at det viste sig at være meget vanskeligt at indsamle de massive mængder af sammenkædede fage- og bakteriegenomsekvenser, der er nødvendige for de deep learning AI-algoritmer til at forudsige og/eller designe fagersekvenser med en terapeutisk acceptabel grad af nøjagtighed. Iverian huskede, at det virkelige gennembrud kom, da nonprofitorganisationen “Phage XChange” lancerede sin globale phage governance-platform af samme navn for at skabe en effektiv, standardiseret, bæredygtig og etisk phageforsyningskæde (figur 2). Phage XChange bestod hovedsagelig af et AI-modul og en distribueret hovedbog (DL) (Thiebes et al., 2020). Platformens AI-modul analyserede sammenkoblede fage- og bakteriegenomer for at forudsige og designe potente fager til kunderne. Den forudsagde også, hvilke bakterielle patogener der havde brug for den mest presserende opmærksomhed, baseret på Internet of Things (IoT) og Big Data og oplysninger fra internationale folkesundhedsorganisationer såsom Verdenssundhedsorganisationen (WHO) og nationale centre for sygdomsbekæmpelse. Disse data styrede systemet mod isolering og karakterisering af de fager, der var mest presserende behov for.
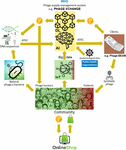
Figur 2. Vision af, hvordan fagenes forsyningskæde kan være organiseret i 2035. AI, kunstig intelligens; ATGC, DNA-sekvens; BEAM, bedside energized anti-microbial; DL, distributed ledger; IoT, Internet of Things; P, PhageCoin; WHO, World Health Organization.
Platformens DL-modul sikrede en tilstrækkelig, kvalitativ og registreret indgang af sammenkædede fage/bakteriegenomsekvenser til AI-modulet og ditto levering af fage-sekvenser til klienterne i overensstemmelse med bestemmelserne i Nagoya-protokollen (Expert round table on acceptance and re-implementation of bacteriophage therapy et al, 2018). DL registrerede uforanderligt alle interessenters (f.eks. leverandører af data, sekventeringstjenester og kunder), transaktions- og kontraktoplysninger. Den registrerede også den nøjagtige kvalitet, specifikationer og vægt af det leverede materiale. En algoritme bestemte, at der ikke var tale om redundans, og vurderede vægten (f.eks. fagenes virulens og værtsområde) og det indsendte materiales ønskværdighed. Fager, der er rettet mod nye bakteriepatogener, var naturligvis mest efterspurgt. De fleste patentspørgsmål blev undgået. DL fungerede som en betalingsbog for at sikre, at alle parter blev betalt rettidigt og retfærdigt. Et antal PhageCoins (platformens kryptovaluta) blev tildelt leverandørerne i forhold til kvaliteten, vægten og ønskværdigheden af det leverede materiale. Kunder, der ekstraherede forudsigelsesresultater (fage-sekvenser) gennem DL, betalte et beløb i PhageCoins, der stod i forhold til den anslåede værdi af fagerne. Disse PhageCoins blev brugt til at vedligeholde DL, til at sikre en tilstrækkelig og kontinuerlig tilstrømning af materiale og til at udvide data om fagenes virulens og værtsområde (matchning af fager til bakterier). En yderligere indsprøjtning af midler og et incitament til at levere materiale blev fundet hos producenter og leverandører af alle slags varer. Med de PhageCoins, der blev tjent med det samme, kunne fagenes leverandører købe alle slags produkter online til stærkt nedsatte priser, lige fra laboratorie- og skoleudstyr til sportsartikler. Disse varer blev leveret gennem virksomhedssponsorater. Flere etablerede virksomheder sponsorerede PhageXchange i bytte for skattelettelser, reklame og et image som et socialt ansvarligt mærke. Vægten af det leverede materiale, og dermed også dets værdi, blev i begyndelsen undervurderet, men blev revurderet med jævne mellemrum (iteration), og leverandørerne fik tildelt flere PhageCoins, når det var berettiget. Selv om platformen var nyttig fra det øjeblik, den blev indført, blev den først rigtig vellykket, da den blev sat under WHO’s beskyttelse i analogi med det verdensomspændende system for sporbarhed, gennemsigtighed, årvågenhed og overvågning af lægemidler af menneskelig oprindelse (Warwick et al., 2013). En formel aftale mellem Phage XChange og WHO øgede den internationale tillid til platformens bæredygtighed på lang sigt og beskyttelsen mod uetisk kommerciel udnyttelse. Søgningen efter potente terapeutiske fager blev snart en fællesskabsindsats, der havde til formål at løse antibiotikaresistenskrisen, med uafhængige “fagejægere”, skoler, spejdergrupper, landsbyer på Amazonflodens bredder osv., der isolerede og indsendte fager til Phage XChange i bytte for PhageCoins. I tilknytning hertil udviklede forskellige virksomheder og institutioner perifert udstyr og tjenester, f.eks. kits til isolering af fager og platforme til sekventering og syntese af fager (f.eks. Phage-BEAM-enheden). I afventning af disse apparater blev der tilbudt mellemløsninger, hvor selve fagerne blev indhentet gennem DL.
Epilog
Dette syn på fremtiden for fagterapi giver en optimistisk afslutning på antibiotikaresistenskrisen. Ad hoc- og on site-produktion af syntetiske fager, der er knyttet til et globalt, fællesskabsbaseret fageforvaltningssystem, viste sig at være et velkomment og økonomisk overkommeligt (for socialsikringssystemerne) ekstra våben i kampen mod antibiotikaresistente bakterieinfektioner. Det var dog ikke en magisk kugle, men et synergistisk supplement til de etablerede antimikrobielle stoffer. Den øjeblikkelige og cellefri produktion af syntetiske fager, uanset om de var designet eller ej, havde betydelige fordele i forhold til klassisk producerede (i bakterielle værter) naturlige fager:
(i) Der var ikke behov for at opretholde fysiske terapeutiske fagebanker og sende patientens bakterieisolater og de matchende terapeutiske fager over hele verden.
(ii) Syntetiske fager mod bakterier, der forårsager eminente trusler mod folkesundheden, som f.eks. udbruddet af E. coli O104:H4 i 2011 i Tyskland (Merabishvili et al, 2012), eller bakterier (mistænkt for at være) anvendt til bioterrorisme (Joñczyk-Matysiak et al, 2014) kunne produceres rettidigt på stedet.
(iii) Fager mod bakterier, der forårsager potentielt dødelige sygdomme, for hvilke der ikke var nogen ikke-dødelige produktionsværtsstammer til rådighed, og hvis formering tidligere krævede bioindkapslingsforanstaltninger på biosikkerhedsniveau 3 (bsl-3), kunne syntetiseres under bsl-1-betingelser.
(iv) Når der ikke kunne isoleres fager fra prøvetagningssteder, f.eks. fordi de bakterielle værtsstammer, der blev anvendt i isoleringsteknikkerne, ikke var modtagelige over for de ønskede fager, kunne (forudsagte) fage-genomsekvenser, uddraget fra metagenomiske data (Reyes et al, 2010; Amgarten et al., 2018), kunne bruges til at fremstille syntetiske fager.
(v) Syntetiske fagepræparater indeholdt ingen (eller mindre mængder af) molekyler, der kunne have en negativ indvirkning på patienter (f.eks. endotoksiner).
(vi) Anordninger blev tilpasset til at fremstille syntetiske fager under længerevarende rumrejser og rumkolonisering (Taylor og Sommer, 2005).
Der er ringe chance for, at disse forudsigelser vil blive til virkelighed. Det er nok for kortsigtet at tro, at en fællesskabsbaseret indsats, der støttes af folkesundhedsorganisationer og forvaltes af en global, bæredygtig og etisk platform, kunne være kernen i en løsning på den nuværende verdensomspændende antibiotikaresistenskrise. Nogle dele af det foreslåede system, som f.eks. cellefri produktion af syntetiske fager ved hjælp af et bedside-apparat, har en rimelig chance for at blive realiseret, mens andre elementer, som f.eks. virksomhedssponsorering, sandsynligvis vil forblive begrænset til science fiction-området. Man kan sige, at jeg er en drømmer, så du er velkommen til at vække mig i 2035 for at konfrontere mig med virkeligheden!
Author Contributions
J-PP udtænkte visionen og udarbejdede manuskriptet.
Funding
Publikationsomkostningerne blev dækket af “Société Scientifique du Service Médical Militaire – Wetenschappelijke Vereniging van de Militaire Medische Dienst”.
Interessekonflikter
Forfatteren erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Den behandlende redaktør erklærede tidligere medforfatterskab med forfatteren.
Akkreditering
Den personlige vision, eller drøm, der er udviklet i dette manuskript, opstod som et resultat af interaktioner med mange forskerkolleger i løbet af de sidste 15 år. Det er umuligt at nævne dem alle, men det ville ikke være retfærdigt at tage alle æren for dem alene. Derfor har jeg besluttet at anerkende nogle af dem her (i alfabetisk rækkefølge), med risiko – eller bedre, sikkerhed – for at glemme nogle vigtige indflydelsesrige personer: Joana Azeredo, Nata Bakuradze, Bob Blasdel, Dimitri Boeckaerts, Angus Buckling, Yves Briers, Pieter-Jan Ceyssens, Nina Chanishvili, Laurent Debarbieux, Sarah Djebara, Dorien Dams, Daniel De Vos, Quirin Emslander, Alan Fauconnier, Ville Friman, Andrzej Górski, Téa Glonti, Nino Grdzelishvili, Serge Jennes, Elene Kakabadze, Betty Kutter, Rob Lavigne, Cédric Lood, Alice Maestri, Khatuna Makalatia, Maya Merabishvili, Tobi Nagel, Thomas Rose, Patrick Soentjens, Michiel Stock, Rüdiger Trojok, An Van den Bossche, Mario Vaneechoutte, Gilbert Verbeken, og Kilian Vogele.
American Academy of Microbiology (2016). Anvendelser af klinisk mikrobiel næste generations sekventering af kliniske mikroorganismer: Report on an American Academy of Microbiology Colloquium Held in Washington, DC, in April 2015. Washington, DC: American Society for Microbiology.
Google Scholar
Amgarten, D., Braga, L. P. P. P., da Silva, A. M., og Setubal, J. C. (2018). MARVEL, et værktøj til forudsigelse af bakteriofagsekvenser i metagenomiske bins. Front. Genet. 9:304. doi: 10.3389/fgene.2018.00304
PubMed Abstract | CrossRef Full Text | Google Scholar
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., og Loessner, M. J. (2018). Genusoverskridende genus genstart af specialfremstillede, syntetiske bakteriofaggenomer i L-form-bakterier. Proc. Natl. Acad. Sci. U.S.A. 115, 567-572. doi: 10.1073/pnas.1714658115
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemire, S., Yehl, K. M., og Lu, T. K. (2018). Fage-baserede anvendelser i syntetisk biologi. Annu. Rev. Virol. 5, 453-476. doi: 10.1146/annurev-virology-092917-043544
PubMed Abstract | CrossRef Full Text | Google Scholar
Luria, S. E., og Delbrück, M. (1943). Mutationer af bakterier fra virusfølsomhed til virusresistens. Genetics 28, 491-511.
Google Scholar
Martorell-Marugán, J., Tabik, S., Benhammou, Y., del Val, C., Zwir, I., Herrera, F., et al. (2019). “Deep learning in omics data analysis and precision medicine,” in Computational Biology, ed. H. Husi (Brisbane: Codon Publications), 37-53. doi: 10.15586/computationalbiology.2019.ch3
PubMed Abstract | CrossRef Full Text | Google Scholar
Merabishvili, M., De Vos, D., Verbeken, G., Kropinski, A. M., Vandenheuvel, D., Lavigne, R., et al. (2012). Udvælgelse og karakterisering af en terapeutisk kandidatbakteriofag, der lyserer Escherichia coli O104:H4-stammen fra udbruddet i Tyskland i 2011. PLoS One 7:e52709. doi: 10.1371/journal.pone.0052709
PubMed Abstract | CrossRef Full Text | Google Scholar
Miêdzybrodzki, R., Borysowski, J., Weber-Da̧browska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). Kliniske aspekter af fagterapi. Adv. Virus Res. 83, 73-121. doi: 10.1016/B978-0-12-394438-2.00003-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Palluk, S., Arlow, D. H., de Rond, T., Barthel, S., Kang, J. S., Bector, R., et al. (2018). De novo DNA-syntese ved hjælp af polymerase-nucleotidkonjugater. Nat. Biotechnol. 36, 645-650. doi: 10.1038/nbt.4173
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., og Lu, T. K. (2016). Genetisk manipulerede fager: en gennemgang af fremskridt i løbet af det sidste årti. Microbiol. Mol. Biol. Rev. 80, 523-543. doi: 10.1128/MMBR.00069-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., De Vos, D., Verbeken, G., Merabishvili, M., Chanishvili, N., Vaneechoutte, M., et al. (2011). Fagterapiparadigmet: prêt-à-porter eller sur-mesure? Pharm. Res. 28, 934-937. doi: 10.1007/s11095-010-0313-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De Vos, D., Ameloot, C., et al. (2018). Den magistrale fage. Viruses 10:E64. doi: 10.3390/v10020064
PubMed Abstract | CrossMed Full Text | Google Scholar
Reyes, A., Haynes, M., Hanson, N., Angly, F. E., Heath, A. C., Rohwer, F., et al. (2010). Virus i den fækale mikrobiota hos monozygote tvillinger og deres mødre. Nature 466, 334-338. doi: 10.1038/nature09199
PubMed Abstract | CrossRef Full Text | Google Scholar
Rustad, M., Eastlund, A., Jardine, P., and Noireaux, V. (2018). Cellefri TXTL-syntese af infektiøs bakteriofag T4 i en enkelt reagering i et reagensglas. Synth. Biol. 3:ysy002.
Google Scholar
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L., et al. (2017). Udvikling og anvendelse af personaliserede bakteriofagbaserede terapeutiske cocktails til behandling af en patient med en dissemineret resistent Acinetobacter baumannii-infektion. Antimicrob. Agents Chemother. 61:e0954-17. doi: 10.1128/AAC.02221-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sulakvelidze, A., Alavidze, Z., og Morris, J. G. Jr. (2001). Bakteriofagterapi. Antimicrob. Agents Chemother. 45, 649-659.
Google Scholar
Suttle, C. A. (2013). Virus: frigør den største biodiversitet på Jorden. Genome 56, 542-544. doi: 10.1139/gen-2013-0152
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, P. W., og Sommer, A. P. (2005). På vej mod rationel behandling af bakterieinfektioner under længerevarende rumrejser. Int. J. Antimicrob. Agents 26, 183-187. doi: 10.1016/j.ijantimicicag.2005.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiebes, S., Schlesner, M., Brors, B., og Sunyaev, A. (2020). Distributed ledger-teknologi inden for genomforskning: en opfordring til Europa. Eur. J. Hum. Genet. 28, 139-140. doi: 10.1038/s41431-019-0512-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, K. (2004). Gamle dogmer, nye tricks – fagterapi i det 21. århundrede. Nat. Biotechnol. 2, 31-36. doi: 10.1038/nbt0104-31
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandersteegen, K., Mattheus, W., Ceyssens, P. J., Bilocq, F., De Vos, D., Pirnay, J.-P., et al. (2011). Mikrobiologisk og molekylær vurdering af bakteriofagen ISP til bekæmpelse af Staphylococcus aureus. PLoS One 6:e24418. doi: 10.1371/journal.pone.0024418
PubMed Abstract | CrossRef Full Text | Google Scholar
Verbeken, G., Pirnay, J.-P., De Vos, D., Jennes, S., Zizi, M., Lavigne, R., et al. (2012). Optimering af de europæiske lovgivningsmæssige rammer for bæredygtig bakteriofagterapi i humanmedicin. Arch. Immunol. Ther. Exp. 60, 161-172. doi: 10.1007/s00005-012-0175-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Warwick, R. M., Chapman, J., Pruett, T. L., og Wang, H. (2013). Globalt konsistente kodningssystemer for medicinske produkter af menneskelig oprindelse. Bull. World Health Organ. 91, 314-314A. doi: 10.2471/BLT.12.116988
PubMed Abstract | CrossRef Full Text | Google Scholar
Yosef, I., Goren, M. G., Globus, R., Molshanski-Mor, S., og Qimron, U. (2017). Udvidelse af værtsområdet for bakteriofagpartikler til DNA-transduktion. Mol. Cell. 66, 721.e3-728.e3. doi: 10.1016/j.molcel.2017.04.025
PubMed Abstract | CrossRef Full Text | Google Scholar