Tryk-, volumen- og temperaturforhold i reelle gasser
For en ideel gas giver et plot af \(PV/nRT\) mod \(P\) en vandret linje med et skæringspunkt på 1 på \(PV/nRT\)-aksen. Reelle gasser viser imidlertid betydelige afvigelser fra den adfærd, der forventes for en ideal gas, især ved høje tryk (figur \(\(\PageIndex{1a}\)\). Kun ved relativt lave tryk (mindre end 1 atm) nærmer virkelige gasser sig den ideelle gasadfærd (figur \(\PageIndex{1b}\)).
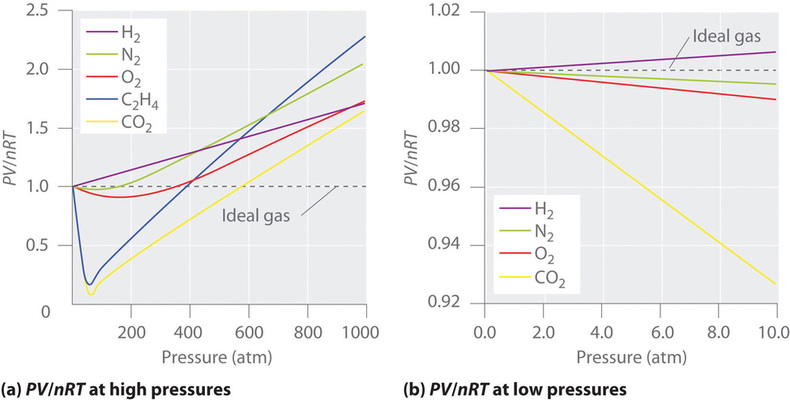
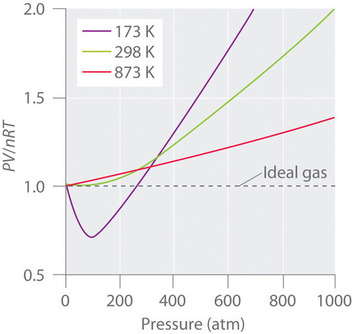
Egte gasser nærmer sig også idealgasadfærd mere ved højere temperaturer, som det fremgår af figur \(\PageIndex{2}\) for \(N_2\). Hvorfor opfører virkelige gasser sig så forskelligt fra ideelle gasser ved høje tryk og lave temperaturer? Under disse forhold er de to grundlæggende antagelser bag loven for ideelle gasser – nemlig at gasmolekyler har et ubetydeligt volumen, og at intermolekylære vekselvirkninger er ubetydelige – ikke længere gyldige.
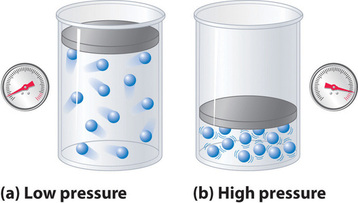
Da molekylerne i en idealgas antages at have et volumen på nul, er det volumen, der er til rådighed for dem til bevægelse, altid det samme som beholderens volumen. I modsætning hertil har molekylerne i en virkelig gas små, men målelige volumener. Ved lavt tryk er gasmolekylerne relativt langt fra hinanden, men efterhånden som gassens tryk stiger, bliver de mellemmolekylære afstande mindre og mindre (figur \(\(\PageIndex{3}\)). Som følge heraf bliver det volumen, der optages af molekylerne, betydeligt i forhold til beholderens volumen. Det samlede volumen, som gassen optager, er derfor større end det volumen, der forudsiges af loven for den ideelle gas. Ved meget høje tryk er den eksperimentelt målte værdi af PV/nRT således større end den værdi, der forudsiges af den ideelle gaslov.
Og desuden tiltrækkes alle molekyler til hinanden af en kombination af kræfter. Disse kræfter bliver særligt vigtige for gasser ved lave temperaturer og høje tryk, hvor de intermolekylære afstande er kortere. Tiltrækninger mellem molekyler reducerer antallet af kollisioner med beholdervæggen, en effekt, der bliver mere udtalt, efterhånden som antallet af attraktive vekselvirkninger øges. Da den gennemsnitlige afstand mellem molekylerne falder, falder det tryk, som gassen udøver på beholdervæggen, og det observerede tryk er mindre end forventet (figur \(\PageIndex{4}\)). Som det fremgår af figur \(\PageIndex{2}\), er forholdet mellem \(PV/nRT\) ved lave temperaturer lavere end forudsagt for en ideal gas, hvilket er en effekt, der er særlig tydelig for komplekse gasser og for simple gasser ved lave temperaturer. Ved meget høje tryk dominerer effekten af et molekylært volumen, der ikke er nul. Konkurrencen mellem disse virkninger er ansvarlig for det minimum, der observeres i plottet \(PV/nRT\) versus \(P\) for mange gasser.
Molekylvolumen uden nul gør det faktiske volumen større end forudsagt ved høje tryk; intermolekylære tiltrækninger gør trykket mindre end forudsagt.
Til høje temperaturer har molekylerne tilstrækkelig kinetisk energi til at overvinde intermolekylære tiltrækningskræfter, og virkningen af molekylvolumen uden nul dominerer. Omvendt falder gasmolekylernes kinetiske energi, efterhånden som temperaturen sænkes. Til sidst nås et punkt, hvor molekylerne ikke længere kan overvinde de intermolekylære tiltrækningskræfter, og gassen bliver flydende (kondenserer til en væske).