Abstract
Diagnosen af en halsmasse kan være en udfordring. Hos den voksne er den mest almindelige diagnose malignitet, og både primære og metastaserede tumorer bør overvejes. Andre hyppige muligheder er infektiøse processer. Vi præsenterer et tilfælde af en 88-årig kvindelig patient med en submandibulær masse med inflammatoriske tegn, der ikke reagerede på antibiotikabehandling, og hvor en finnålsaspirationsbiopsi viste en inflammatorisk læsion. Massen udviklede sig i løbet af en måned med tilhørende anoreksi, hvilket resulterede i indlæggelse med henblik på diagnosticering med åben biopsi. Efter indlæggelsen blev der diagnosticeret et invasivt karcinom i højre bryst, og mykobakteriekulturen af biopsien af den submandibulære masse var positiv for Mycobacterium tuberculosis. Immunosenescens de ældre bidrager til sårbarhed over for kræftformer, men også infektioner, som kan præsentere sig atypisk og dermed resultere i forsinket diagnose.
Introduktion
Den differentielle diagnose af halsmasser er yderst udfordrende, da flere faktorer skal tages i betragtning. De vigtigste diagnostiske muligheder hos voksne er malignitet, enten primær, metastatisk fra tumorer i de øvre luftveje eller fordøjelseskanalen, eller lymfom . Benigne neoplasmer som lipomer, fibromer og hæmangiomer kan også findes.
Syvogtyve procent af halsmasserne hos patienter over 40 år er maligne , og risikoen stiger med alderen. Læsionens størrelse og symptomernes varighed er andre vigtige prædiktorer for risikoen for malignitet , samt kronisk soleksponering, rygning, alkoholforbrug, dårlig tandpleje, miljøeksponering og familiehistorie.
De fysiske karakteristika ved massen er også vigtige for differentialdiagnosen. Faste, hårde eller faste med uregelmæssige grænser tyder på solide maligniteter; flere bløde og gummiagtige masser tyder på lymfom; masser med inflammatoriske tegn tyder på infektiøse årsager .
Inflammatoriske masser kan skyldes betændelse i lymfeknuder (cervikal adenitis), som normalt er selvbegrænsede og forsvinder spontant . Kronisk betændelse i submandibulære eller parotis-kirtler med kronisk sialadenitis er også mulig .
Infektiøse årsager kan være af viral, bakteriel eller svampeagtig karakter . Virale infektioner såsom Cytomegalovirus (CMV), Epstein-Barrvirus (EBV), mæslinger, Adenovirus, Echovirus, Rhinovirus og Respiratory Syncitial Virus (RSV) viser sig normalt med flere lymfeknuder med cervikal adenitis. Bakterieinfektioner kan forårsage nekrose med abscesdannelse, spontan dræning og endog kronisk fisteldannelse . Andre agenser bør også overvejes nemlig mykobakterielle , kattekridtsygdom ved Bartonella , actinomycosis , Toxoplasma gondii .
Andre mindre hyppige årsager er gigt , inflammatorisk pseudotumor , Kimuras sygdom , Castlemans sygdom og sarkoidose .
Diagnosen stilles normalt ved finnålsaspirationscytologi, som er en hurtig og følsom metode. Hvis diagnosen fortsat er uklar, kan det være nødvendigt med en åben biopsi . Laboratorieprøver varierer med præsentationen, men bør omfatte inflammatoriske parametre, herunder leukocytantal, erytrocytsedimentationshastighed (ESR), C-reaktivt protein (CRP), viral og bakteriel serologi i henhold til klinisk anamnese og undersøgelse og tuberkulinhudtest . Karakterisering af massen kan foretages med ultralyd, som skelner mellem cystiske læsioner, spytkirteltumorer, reaktive eller maligne lymfeknuder ved hjælp af kriterier som størrelse og vaskularisering . Computertomografi (CT) og magnetisk resonansbilleddannelse (MRI) hjælper yderligere med at karakterisere masserne ud fra størrelse og morfologiske abnormiteter (central nekrose, fedtstrenge og heterogenitet) . Positronemissionstomografi kan bruges til at undersøge halsmasser, da den påviser øget metabolisme , men den anbefales ikke som en selvstændig test, da den ikke skelner mellem inflammatoriske og neoplastiske læsioner . Hvis der er mistanke om malignitet, bør der foretages yderligere undersøgelser, herunder CT-scanning af hele kroppen og endoskopiske undersøgelser fra de øvre luftveje og fordøjelseskanalen .
Case Report
Vi præsenterer et tilfælde af en 88-årig skrøbelig kvinde, der bor på et plejehjem, og som præsenterede sig på skadestuen på grund af et 3 til 4 ugers progressivt forløb med prostration, anoreksi og en højre submandibulær masse med inflammatoriske tegn. Hun blev undersøgt af den kæbekirurgiske afdeling, som havde foretaget en finnålsaspirationscytologi af massen, som afslørede inflammatoriske celler, der var negative for neoplastiske celler. Desuden var hun allerede blevet medicineret med oral amoxicillin-clavulansyre (875 mg/125 mg 3id i 7 dage) uden forbedring.
Hendes tidligere sygehistorie omfattede essentiel hypertension, sinus bradykardi, perifer arteriel sygdom, let kognitiv svækkelse og depression. Hun var polymedicineret med aspirin, olmesartan, pentoxifyllin, paroxetin og alprazolam.
Ved undersøgelsen var hun overvægtig, udviste en ikke-sårbar submandibulær masse på 3 × 3 cm, solid, men gummiagtig, med inflammatoriske tegn, uden eksudat (Figur 1). Hun forblev afebril uden andre relevante kliniske tegn.
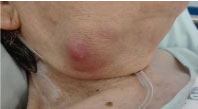 Figur 1: Foto af den højre submandibulære masse. Se figur 1
Figur 1: Foto af den højre submandibulære masse. Se figur 1
I betragtning af sygdommens progression blev patienten indlagt til yderligere undersøgelser, herunder en åben biopsi af massen, og blev startet på empirisk behandling med intravenøs amoxicillin-clavulansyre (1000 mg/200 mg i yderligere 9 dage) og clindamycin (600 mg 4id i 7 dage), også uden klinisk bedring.
Blodprøver viste kun en mikrocytisk hypokromisk anæmi med jernmangel og negative inflammatoriske parametre (tabel 1).
Tabel 1: Blodprøver fra patienten.Se tabel 1
En computertomografi (CT) af hele kroppen viste flere nekrotiske cervikale lymfeknuder, de største i venstre supraklavikulære fossae og en knude i højre brystkirtel, uregelmæssig med hyperattenueringstegn, der tyder på vaskularisering (Figur 2 og Figur 3).
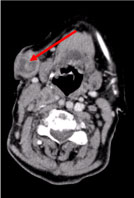 Figur 2: CT-scanning af halsen: Multiple nekrotiske cervikale lymfeknuder, de største subkutane, 27 mm i diameter (pil). Se figur 2
Figur 2: CT-scanning af halsen: Multiple nekrotiske cervikale lymfeknuder, de største subkutane, 27 mm i diameter (pil). Se figur 2
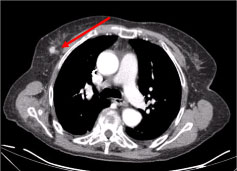 Figur 3: CT-scanning af brystkassen: 10 mm stor læsion på højre brystkirtel, nodulært uregelmæssig, med et hyperattenueringstegn, der tyder på vaskularisering (pil). Se figur 3
Figur 3: CT-scanning af brystkassen: 10 mm stor læsion på højre brystkirtel, nodulært uregelmæssig, med et hyperattenueringstegn, der tyder på vaskularisering (pil). Se figur 3
Der blev foretaget en åben biopsi, som viste blødvævsinfiltration af polymorfe kerneleukocytter og histiocytter samt vaskulitis. Gram-, Grocott-, Ziehl-Neelsen- og PAS-farver var negative; polymerase chain reaction (PCR)-baseret assay til påvisning af Mycobacterium tuberculosis i vævet var også negativ.
Patienten blev udskrevet med videre opfølgning i brystkirurgiske og kæbekirurgiske klinikker.
På brystkirurgisk klinik blev der foretaget en ultralydsvejledt kerne-nålsbiopsi af brystlæsionen. Der blev stillet diagnosen invasivt brystkarcinom NOS, grad 1. Tumoren var ER-positiv (90 %), PR-positiv (90 %), HER2 2+ ved immunohistokemi, ISH negativ, med et proliferationsindeks (Ki67) på 10 % (luminal A molekylær subtype) (figur 4). Den blev klassificeret cT1N0M0. På dette tidspunkt blev patienten sat i tamoxifen.
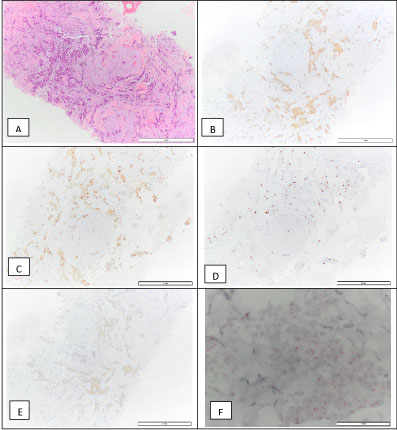 Figur 4: Biopsi af invasivt brystkarcinom: H&E (A), positiv for østrogenreceptor – 90 % (B), positiv for progesteronreceptor – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E), og en negativ D-ISH HER2-amplifikation (F), hvilket er foreneligt med en luminal A molekylær subtype. Se figur 4
Figur 4: Biopsi af invasivt brystkarcinom: H&E (A), positiv for østrogenreceptor – 90 % (B), positiv for progesteronreceptor – 90 % (C), Ki67 – 10 % (D), HER2 2+ (E), og en negativ D-ISH HER2-amplifikation (F), hvilket er foreneligt med en luminal A molekylær subtype. Se figur 4
To måneder senere var mykobakteriekulturen af den åbne biopsi positiv for Mycobacterium tuberculosis complex, følsom over for alle første linje antibiotika. Patienten indledte behandling med antituberkulostatika i første linje (300 mg isoniazid, 600 mg rifampicin, 1500 mg pyrazinamid og 1200 mg ethambutol i 2 måneder, efterfulgt af 4 måneder med 300 mg isoniazid og 600 mg rifampicin) og blev henvist til Tuberkuloseklinikken til opfølgning.
Patienten døde 1 år efter den oprindelige diagnose.
Diskussion
Som tidligere omtalt er diagnosen af en halsmasse påvirket af flere faktorer. Alder og skrøbelighed er vigtige faktorer at tage hensyn til.
Aldring er forbundet med et fald i immunforsvaret, ofte beskrevet som Immunosenescence . Det påvirker både det adaptive og det medfødte system på forskellige måder . Det adaptive immunsystem er ofte nedsat i funktion, normalt ved et fald i T-celleaktiviteten . På den anden side er det medfødte immunsystem blevet beskrevet som værende overdrevet på grund af manglende regulerende evne, hvilket kan resultere i en proinflammatorisk tilstand, som også er skadelig . Immunosenescens er blevet forbundet med en stigning i hyppigheden og sværhedsgraden af infektioner , en lavere immunovervågning af maligne celler og en nedsat effektivitet ved vaccination .
Der er immunosenescens medvirkende årsag til den øgede diagnosticering af kræft hos ældre, med en medianalder på 70 år ved diagnosticering . Andre faktorer spiller en rolle, såsom den øgede tid udsat for carcinogenese eller ældre cellers større modtagelighed for carcinogenese , men også det øgede paradoksale inflammatoriske respons .
Infektioner er hyppigere hos ældre, især luftvejsinfektioner , med stor dødelighed til følge. Tuberkulose er et vigtigt folkesundhedsproblem, der berører 9,6 millioner mennesker på verdensplan og har været stigende i befolkningen over 65 år . Det er blevet foreslået, at tuberkulose hos ældre ofte skyldes reaktivering af latent tuberkulose, efterhånden som det cellulære immunforsvar aftager . Den kan dog også skyldes primær infektion eller reinfektion hos en tidligere behandlet patient . Andre faktorer øger risikoen for tuberkulose hos ældre, f.eks. ophold på et plejehjem, som øger risikoen 2-3 gange . Nogle komorbiditeter, som diabetes mellitus , kronisk obstruktiv lungesygdom , leversygdom, malignitet og kardiovaskulære sygdomme ; immunosuppressive behandlinger med kortikoider og anti-TNF ; og underernæring .
Tuberkulose hos ældre har en atypisk klinisk præsentation . Den vigtigste præsentation er stadig pulmonal i 75 % af tilfældene , men ekstrapulmonale steder er hyppigere . Organspecifikke symptomer er mindre hyppige, og patienterne udviser mere vage symptomer, såsom astheni og kognitiv svækkelse . Diagnosen er også vanskeligere, da de ældre har hyppige kroniske abnormiteter som f.eks. unormale leverenzymer, hypoalbuminæmi, hyponatriæmi, hypokaliæmi og anæmi . Radiografisk set er der færre kroniske forandringer . Tuberkulinhudprøven er ofte ubestemmelig på grund af anergi, og der er behov for en gentagelse, hvor man udnytter boost-effekten . Prøvekulturer kan være negative . Behandlingen er også en udfordring hos ældre mennesker på grund af dårligere compliance og polyfarmaci med øget risiko for toksicitet, især hepatotoksicitet . Mortaliteten er også betydeligt højere; med op til 10 gange .
Denne case report illustrerer udfordringerne ved diagnosticering af en halsmasse hos ældre. Lokale inflammatoriske tegn tydede på infektion, men de systemiske symptomer gav anledning til mistanke om malignitet. Set i bakspejlet kan vi argumentere for, at flere tegn og laboratorieprøver kunne tyde på tuberkulose, såsom inflammatoriske tegn, resistens over for antibiotika, anæmi og hyponatriæmi. Den samtidige diagnose af invasivt brystkarcinom var et tilfældigt fund. Det er dog rimeligt at antage, at kræft kan have bidraget til immunosenescens, hvilket har lettet reaktiveringen af latent tuberkulose.
Financial Support
Der var ingen finansiel støtte.
Authors Contribution
Alle forfattere bidrog ligeligt.
- Gleeson M, Herbert A, Richards A (2000) Management of lateral neck masses in adults. BMJ 320: 1521-1524.
- Schwetschenau E, Kelley DJ (2002) The adult neck mass. Am Fam Physician 66: 831-838.
- Armstrong WB, Giglio MF (1998) Is this lump in the neck anything to worry about? Postgrad Med 104.
- Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307. Bhattacharyya N (1999) Predictive factors for neoplasia and malignancy in a neck mass. Arch Otolaryngol Head Neck Surg 125: 303-307.
- Barnes L (1996) Pathology of the head and neck: Generelle overvejelser. (3rd edn), In: Myers EN, Suen JY, 17-32.
- Goffart, Y, Hamoir M, Deron P, Claes J, Remacle M (2005) Management of neck masses in adults. B-ENT 1: 133-140.
- Karem KL, Paddock CD, Regnery RL (2000) Bartonella henselae, B. quintana, and B. bacilliformis: historical pathogens of emerging significance. Microbes Infect 2: 1193-1205.
- Mccabe RE, Brooks RG, Dorfman RF, Remington JS (1987) Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 9: 754-774.
- Landau A, Reese DJ, Blumenthal DR, Chin NW (1990) Tophaceous neck mass presenting as a thyroglossal duct cyst. Arthritis Rheum 33: 910-911.
- Hytiroglou P, Brandwein MS, Strauchen JA, Mirante JP, Urken ML, et al. (1992) Inflammatory pseudotumor of the parapharyngeal space: case report and review of the literature. Head Neck 14: 230-234.
- Armstrong WB, Allison G, Pena F, Kim JK (1998) Kimura’s disease: two case reports and a literature review. Ann Otol Rhinol Laryngol 107: 1066-1071.
- YI AY, deTar M, Becker TS, Rice DH (1995) Giant lymph node hyperplasia of the head and neck (Castleman’s disease): a report of five cases. Otolaryngol Head Neck Surg 113: 462-466.
- Shah Uk, White JA, Gooey JE, Hybels RL (1997) Otolaryngologic manifestations of sarcoidosis: presentation and diagnosis. Laryngoscope 107: 67-75.
- Underhill T, Mcguirt F, Williams D (2000) Advances in imaging head and neck tumors. Current Opinion in Otolaryngology Head and Neck Surgery 8: 91-97.
- Ponnappan S, Ponnappan U (2011) Aging and immune function: molecular mechanisms to interventions. Antioxid Redox Signal 14: 1551-1585.
- Gruver AL, Hudson LL, Sempowski GD (2007) Immunosenescence of ageing. J Pathol 211: 144-156.
- Foster AD, Sivarapatna A, Gress RE (2012) The aging immune system and its relationship with cancer. Aging health 7: 707-718.
- Stervbo U, Meier S, Mälzer JN, Baron U, Bozzetti C, et al. (2015) Effects of aging on human leukocytes (part I): immunophenotyping of innate immune cells. Age (Dordr) 37: 92.
- Mcelhaney JE, Effros RB (2009) Immunosenescence: hvad betyder det for sundhedsresultater hos ældre voksne? Curr Opin Immunol 21: 418-424.
- Gloeckler Ries LA, Reichman ME, Lewis DR, Hankey BF, Edwards BK (2003) Cancer survival and incidence from the Surveillance, Epidemiology, and End Results (SEER) program. Oncologist 8: 541-552.
- Finkel T, Serrano M, Blasco MA (2007) The common biology of cancer and ageing. Nature 448: 767-774.
- Vasto S, Carruba G, Lio D, Colonna-Romano G, Di Bona D, et al. (2009) Inflammation, aldring og kræft. Mech Ageing Dev 130: 40-45.
- Gardner ID (1980) The effect of aging on susceptibility to infection. Rev Infect Dis 2: 801-810.
- Bellmann-Weiler R, Weiss G (2009) Pitfalls in the diagnosis and therapy of infections in elderly patients–a mini-review. Gerontology 55: 241-249.
- LI J, Chung PH, Leung CLK, Nishikiori N, Chan EYY, et al. (2017) The strategic framework of tuberculosis control and prevention in the elderly: a scoping review towards End TB targets (Den strategiske ramme for tuberkulosebekæmpelse og -forebyggelse hos ældre: en scoping gennemgang mod End TB-mål). Infect Dis Poverty 6: 70.
- Byng-Maddick R, Noursadeghi M (2016) Does tuberculosis threaten our ageing populations? BMC Infect Dis 16: 119.
- Negin J, Abimbola S, Marais BJ (2015) Tuberculosis among older adults–time to take notice. Int J Infect Dis 32: 135-137.
- Rajagopalan S (2001) Tuberkulose og aldring: et globalt sundhedsproblem. Clin Infect Dis 33: 1034-1039.
- Rajagopalan S (2016) Tuberkulose hos ældre voksne. Clin Geriatr Med 32: 479-491.
- Chan E (2006) Tuberkulose hos ældre mennesker: Hold et højt indeks af mistanke. Journal of Respiratory Diseases 27: 307-315.
- Jeon CY, Murray MB (2008) Diabetes mellitus øger risikoen for aktiv tuberkulose: en systematisk gennemgang af 13 observationsundersøgelser. PLoS Med 5: e152.
- Inghammar M, Ekbom A, Engström G, Ljungberg B, Romanus V, et al. (2010) COPD and the risk of tuberculosis–a population-based cohort study. PLoS One 5: e10138.
- Brode SK, Jamieson FB, Ng R, Campitelli MA, Kwong JC, et al. (2015) Increased risk of mycobacterial infections associated with anti-rheumatic medications. Thorax 70: 677-682.
- Morris CD (1990) Pulmonal tuberkulose hos ældre: en anderledes sygdom? Thorax 45: 912-913.
- Pérez-Guzmán C, Vargas MH, Torres-Cruz A, Villarreal-Velarde H (1999) Does aging modify pulmonary tuberculosis? En meta-analytisk gennemgang. Chest 116: 961-967.
- Dutt AK, Stead WW (1993) Tuberculosis in the elderly. Med Clin North Am 77: 1353-1368.
- Nagami Ph, Yoshikawa Tt (1983) Tuberkulose hos den geriatriske patient. J Am Geriatr Soc 31: 356-363.
- Kwon YS, Chi SY, Oh IJ, Kim KS, Kim YI, et al. (2013) Clinical characteristics and treatment outcomes of tuberculosis in the elderly: a case control study. BMC Infect Dis 13: 121.
- Thompson NJ, Glassroth JL, Snider DE Jr, Farer LS (1979) The booster phenomenon in serial tuberculin testing. Am Rev Respir Dis 119: 587-597.
- Borgdorff MW, Veen J, Kalisvaart NA, Nagelkerke N (1998) Mortalitet blandt tuberkulosepatienter i Nederlandene i perioden 1993-1995. Eur Respir J 11: 816-820.
Citation
de Figueiredo IR, Alves RV, Castro SG, Lourenço F, Antunes AM, et al. (2019) A Submandibular Mass in an Elderly Patient. J Geriatr Med Gerontol 5:064. doi.org/10.23937/2469-5858/1510064